Objetivos de aprendizaje
- Describir los componentes que intervienen en una contracción muscular
- Explicar cómo los músculos se contraen y se relajan
- Describir el modelo de filamentos deslizantes de la contracción muscular
La secuencia de acontecimientos que dan lugar a la contracción de una fibra muscular individual comienza con una señal -el neurotransmisor ACh-de la neurona motora que inerva esa fibra. La membrana local de la fibra se despolariza al entrar iones de sodio (Na+) cargados positivamente, lo que desencadena un potencial de acción que se extiende al resto de la membrana que se despolariza, incluidos los túbulos T. Esto desencadena la liberación de iones de calcio (Ca++) del almacenamiento en el retículo sarcoplásmico (RS). El Ca++ inicia entonces la contracción, que se mantiene gracias al ATP (Figura 1). Mientras los iones Ca++ permanezcan en el sarcoplasma para unirse a la troponina, que mantiene los sitios de unión a la actina «desprotegidos», y mientras el ATP esté disponible para impulsar el ciclo de puentes cruzados y la tracción de las hebras de actina por parte de la miosina, la fibra muscular seguirá acortándose hasta un límite anatómico.

Figura 1. Contracción de una fibra muscular. Se forma un puente cruzado entre la actina y las cabezas de miosina desencadenando la contracción. Mientras los iones de Ca++ permanezcan en el sarcoplasma para unirse a la troponina, y mientras haya ATP disponible, la fibra muscular seguirá acortándose.
La contracción muscular suele detenerse cuando finaliza la señalización de la neurona motora, que repolariza el sarcolema y los túbulos T, y cierra los canales de calcio activados por voltaje en el RE. Los iones de Ca++ son entonces bombeados de vuelta al RE, lo que hace que la tropomiosina vuelva a proteger (o cubrir) los sitios de unión en los filamentos de actina. Un músculo también puede dejar de contraerse cuando se queda sin ATP y se fatiga (Figura 2).

Figura 2. Relajación de una fibra muscular. Los iones Ca++ son bombeados de vuelta al SR, lo que hace que la tropomiosina vuelva a proteger los sitios de unión en los filamentos de actina. Un músculo también puede dejar de contraerse cuando se queda sin ATP y se fatiga.
Los eventos moleculares del acortamiento de la fibra muscular ocurren dentro de los sarcómeros de la fibra (ver Figura 3). La contracción de una fibra muscular estriada se produce cuando los sarcómeros, dispuestos linealmente dentro de las miofibrillas, se acortan a medida que las cabezas de miosina tiran de los filamentos de actina.
La región donde los filamentos gruesos y finos se superponen tiene un aspecto denso, ya que hay poco espacio entre los filamentos. Esta zona donde se superponen los filamentos finos y gruesos es muy importante para la contracción del músculo, ya que es el lugar donde comienza el movimiento de los filamentos. Los filamentos finos, anclados en sus extremos por los discos Z, no se extienden completamente en la región central que sólo contiene filamentos gruesos, anclados en sus bases en un punto llamado línea M. Una miofibrilla se compone de muchos sarcómeros que se extienden a lo largo de su longitud; por lo tanto, las miofibrillas y las células musculares se contraen a medida que los sarcómeros se contraen.
El modelo del filamento deslizante de la contracción
Cuando recibe la señal de una neurona motora, una fibra muscular esquelética se contrae a medida que los filamentos finos son arrastrados y luego se deslizan por los filamentos gruesos dentro de los sarcómeros de la fibra. Este proceso se conoce como el modelo de filamentos deslizantes de la contracción muscular (Figura 3). El deslizamiento sólo puede ocurrir cuando los sitios de unión de la miosina en los filamentos de actina están expuestos por una serie de pasos que comienzan con la entrada de Ca++ en el sarcoplasma.

Figura 3. El modelo de filamentos deslizantes de la contracción muscular. Cuando un sarcómero se contrae, las líneas Z se acercan y la banda I se hace más pequeña. La banda A mantiene la misma anchura. En plena contracción, los filamentos fino y grueso se superponen.
La tropomiosina es una proteína que se enrolla alrededor de las cadenas del filamento de actina y cubre los sitios de unión de la miosina para evitar que ésta se una a la miosina. La tropomiosina se une a la troponina para formar un complejo troponina-tropomiosina. El complejo troponina-tropomiosina impide que las «cabezas» de miosina se unan a los sitios activos de los microfilamentos de actina. La troponina también tiene un sitio de unión para los iones Ca++.
Para iniciar la contracción muscular, la tropomiosina tiene que exponer el sitio de unión de la miosina en un filamento de actina para permitir la formación de puentes cruzados entre los microfilamentos de actina y miosina. El primer paso en el proceso de contracción es que el Ca++ se una a la troponina para que la tropomiosina pueda deslizarse fuera de los sitios de unión en los filamentos de actina. Esto permite que las cabezas de miosina se unan a estos sitios de unión expuestos y formen puentes cruzados. Las cabezas de miosina tiran entonces de los filamentos finos para deslizarse por delante de los filamentos gruesos hacia el centro del sarcómero. Pero cada cabeza sólo puede tirar una distancia muy corta antes de que haya alcanzado su límite y debe ser «re-cock» antes de que pueda tirar de nuevo, un paso que requiere ATP.
ATP y la contracción muscular
Para que los filamentos delgados continúen deslizándose más allá de los filamentos gruesos durante la contracción muscular, las cabezas de miosina deben tirar de la actina en los sitios de unión, separarse, re-cock, unirse a más sitios de unión, tirar, separarse, re-cock, etc. Este movimiento repetido se conoce como ciclo de puentes cruzados. Este movimiento de las cabezas de miosina es similar al de los remos cuando una persona rema en un barco: La pala de los remos (las cabezas de miosina) tiran, se levantan del agua (se desprenden), se vuelven a colocar (se vuelven a amarrar) y se vuelven a sumergir para tirar (Figura 4). Cada ciclo requiere energía, y la acción de las cabezas de miosina en los sarcómeros tirando repetidamente de los filamentos finos también requiere energía, que es proporcionada por el ATP.
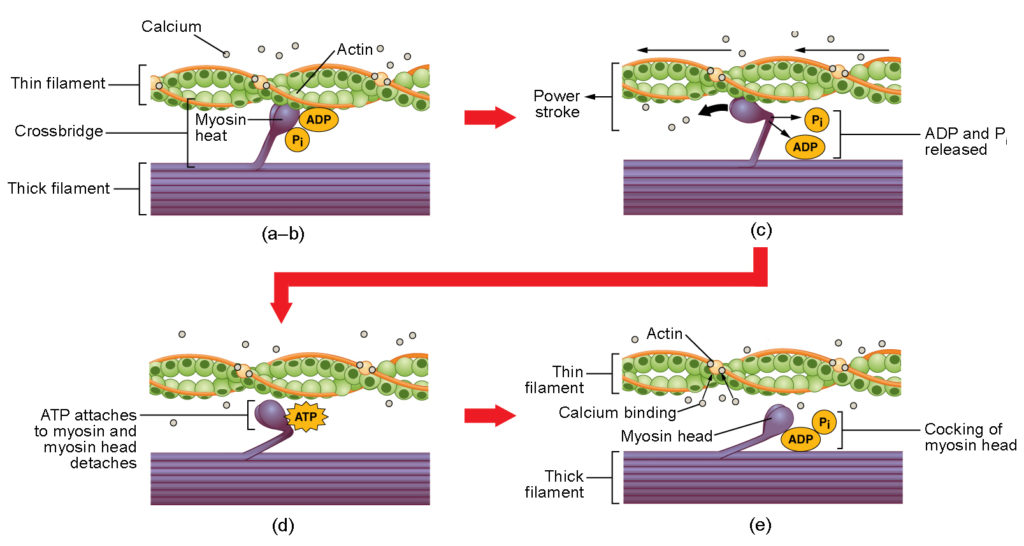
Figura 4. Contracción del músculo esquelético. (a) El sitio activo de la actina queda expuesto cuando el calcio se une a la troponina. (b) La cabeza de la miosina es atraída por la actina, y la miosina se une a la actina en su sitio de unión a la actina, formando el puente cruzado. (c) Durante la carrera de potencia, se libera el fosfato generado en el ciclo de contracción anterior. Esto hace que la cabeza de la miosina gire hacia el centro del sarcómero, tras lo cual se liberan el ADP y el grupo fosfato unidos. (d) Una nueva molécula de ATP se une a la cabeza de miosina, provocando el desprendimiento del puente cruzado. (e) La cabeza de miosina hidroliza el ATP a ADP y fosfato, lo que devuelve a la miosina a la posición ladeada.
La formación del puente cruzado se produce cuando la cabeza de miosina se une a la actina mientras el difosfato de adenosina (ADP) y el fosfato inorgánico (Pi) siguen unidos a la miosina (Figura 4a,b). El Pi se libera entonces, haciendo que la miosina forme una unión más fuerte con la actina, tras lo cual la cabeza de la miosina se mueve hacia la línea M, arrastrando a la actina con ella. Al tirar de la actina, los filamentos se mueven aproximadamente 10 nm hacia la línea M. Este movimiento se denomina carrera de potencia, ya que en este paso se produce el movimiento del filamento delgado (Figura 4c). En ausencia de ATP, la cabeza de miosina no se desprende de la actina.
Una parte de la cabeza de miosina se une al sitio de unión en la actina, pero la cabeza tiene otro sitio de unión para el ATP. La unión del ATP hace que la cabeza de miosina se separe de la actina (Figura 4d). Después de esto, el ATP se convierte en ADP y Pi por la actividad ATPasa intrínseca de la miosina. La energía liberada durante la hidrólisis de ATP cambia el ángulo de la cabeza de miosina a una posición ladeada (Figura 4e). La cabeza de la miosina está ahora en posición para el movimiento posterior.
Cuando la cabeza de la miosina está ladeada, la miosina está en una configuración de alta energía. Esta energía se gasta a medida que la cabeza de miosina se mueve a través de la carrera de potencia, y al final de la carrera de potencia, la cabeza de miosina está en una posición de baja energía. Después de la carrera de fuerza, el ADP se libera; sin embargo, el puente cruzado formado sigue en su lugar, y la actina y la miosina están unidas. Mientras el ATP esté disponible, se une fácilmente a la miosina, el ciclo de puentes cruzados puede repetirse y la contracción muscular puede continuar.
Nótese que cada filamento grueso de aproximadamente 300 moléculas de miosina tiene múltiples cabezas de miosina, y muchos puentes cruzados se forman y rompen continuamente durante la contracción muscular. Multiplique esto por todos los sarcómeros de una miofibrilla, por todas las miofibrillas de una fibra muscular y por todas las fibras musculares de un músculo esquelético, y podrá entender por qué se necesita tanta energía (ATP) para mantener los músculos esqueléticos en funcionamiento. De hecho, es la pérdida de ATP lo que provoca el rigor mortis que se observa poco después de la muerte. Al no ser posible la producción de ATP, no hay ATP disponible para que las cabezas de miosina se desprendan de los sitios de unión a la actina, por lo que los puentes cruzados permanecen en su lugar, causando la rigidez en los músculos esqueléticos.
Fuentes de ATP
El ATP suministra la energía para que se produzca la contracción muscular. Además de su papel directo en el ciclo de puentes cruzados, el ATP también proporciona la energía para las bombas de Ca++ de transporte activo en el SR. La contracción muscular no se produce sin cantidades suficientes de ATP. La cantidad de ATP almacenada en el músculo es muy baja, sólo suficiente para alimentar las contracciones de unos pocos segundos. Por lo tanto, al descomponerse, el ATP debe regenerarse y reemplazarse rápidamente para permitir una contracción sostenida. Existen tres mecanismos por los que se puede regenerar el ATP: el metabolismo del fosfato de creatina, la glucólisis anaeróbica, la fermentación y la respiración aeróbica.
El fosfato de creatina es una molécula que puede almacenar energía en sus enlaces de fosfato. En un músculo en reposo, el exceso de ATP transfiere su energía a la creatina, produciendo ADP y fosfato de creatina. Esto actúa como una reserva de energía que puede utilizarse para crear rápidamente más ATP. Cuando el músculo comienza a contraerse y necesita energía, el fosfato de creatina transfiere su fosfato de nuevo al ADP para formar ATP y creatina. Esta reacción es catalizada por la enzima creatina quinasa y se produce muy rápidamente; así, el ATP derivado del fosfato de creatina potencia los primeros segundos de la contracción muscular. Sin embargo, el fosfato de creatina sólo puede proporcionar energía durante unos 15 segundos, momento en el que hay que utilizar otra fuente de energía (Figura 5).

Figura 5. Metabolismo muscular. Parte del ATP se almacena en un músculo en reposo. Al iniciarse la contracción, se agota en segundos. Se genera más ATP a partir del fosfato de creatina durante unos 15 segundos.
Cuando el ATP producido por el fosfato de creatina se agota, los músculos recurren a la glucólisis como fuente de ATP. La glucólisis es un proceso anaeróbico (no dependiente del oxígeno) que descompone la glucosa (azúcar) para producir ATP; sin embargo, la glucólisis no puede generar ATP tan rápidamente como el fosfato de creatina. Por lo tanto, el cambio a la glucólisis resulta en una tasa más lenta de disponibilidad de ATP para el músculo. El azúcar utilizado en la glucólisis puede provenir de la glucosa en sangre o de la metabolización del glucógeno almacenado en el músculo. La descomposición de una molécula de glucosa produce dos ATP y dos moléculas de ácido pirúvico, que pueden utilizarse en la respiración aeróbica o, cuando los niveles de oxígeno son bajos, convertirse en ácido láctico (Figura 6).

Figura 6. Glucólisis y respiración aeróbica. Cada molécula de glucosa produce dos ATP y dos moléculas de ácido pirúvico, que pueden utilizarse en la respiración aeróbica o convertirse en ácido láctico. Si no hay oxígeno disponible, el ácido pirúvico se convierte en ácido láctico, lo que puede contribuir a la fatiga muscular. Esto ocurre durante el ejercicio extenuante cuando se necesitan grandes cantidades de energía pero el oxígeno no puede llegar suficientemente al músculo.
Si hay oxígeno disponible, el ácido pirúvico se utiliza en la respiración aeróbica. Sin embargo, si no hay oxígeno disponible, el ácido pirúvico se convierte en ácido láctico, lo que puede contribuir a la fatiga muscular. Esta conversión permite el reciclaje de la enzima NAD+ a partir del NADH, que es necesario para que la glucólisis continúe. Esto ocurre durante el ejercicio extenuante, cuando se necesitan grandes cantidades de energía pero el oxígeno no puede llegar suficientemente al músculo. La glucólisis en sí misma no puede mantenerse durante mucho tiempo (aproximadamente 1 minuto de actividad muscular), pero es útil para facilitar ráfagas cortas de rendimiento de alta intensidad. Esto se debe a que la glucólisis no utiliza la glucosa de manera muy eficiente, produciendo una ganancia neta de dos ATPs por molécula de glucosa, y el producto final de ácido láctico, que puede contribuir a la fatiga muscular a medida que se acumula.
La respiración aeróbica es la descomposición de la glucosa u otros nutrientes en presencia de oxígeno (O2) para producir dióxido de carbono, agua y ATP. Aproximadamente el 95 por ciento del ATP necesario para los músculos en reposo o moderadamente activos lo proporciona la respiración aeróbica, que tiene lugar en las mitocondrias. Los insumos para la respiración aeróbica incluyen la glucosa que circula en el torrente sanguíneo, el ácido pirúvico y los ácidos grasos. La respiración aeróbica es mucho más eficiente que la glucólisis anaeróbica, ya que produce aproximadamente 36 ATPs por molécula de glucosa frente a los cuatro de la glucólisis. Sin embargo, la respiración aeróbica no puede mantenerse sin un suministro constante de O2 al músculo esquelético y es mucho más lenta (Figura 7). Para compensar, los músculos almacenan una pequeña cantidad de exceso de oxígeno en unas proteínas denominadas mioglobina, lo que permite unas contracciones musculares más eficientes y una menor fatiga. El entrenamiento aeróbico también aumenta la eficiencia del sistema circulatorio, de modo que se puede suministrar O2 a los músculos durante períodos más largos.

Figura 7. Respiración celular. La respiración aeróbica es la descomposición de la glucosa en presencia de oxígeno (O2) para producir dióxido de carbono, agua y ATP. Aproximadamente el 95 por ciento del ATP necesario para los músculos en reposo o moderadamente activos lo proporciona la respiración aeróbica, que tiene lugar en las mitocondrias.
La fatiga muscular se produce cuando un músculo ya no puede contraerse en respuesta a las señales del sistema nervioso. Las causas exactas de la fatiga muscular no se conocen del todo, aunque se han correlacionado ciertos factores con la disminución de la contracción muscular que se produce durante la fatiga. El ATP es necesario para la contracción muscular normal, y cuando las reservas de ATP se reducen, la función muscular puede disminuir. Esto puede ser un factor más importante en los esfuerzos musculares breves e intensos que en los esfuerzos sostenidos de menor intensidad. La acumulación de ácido láctico puede reducir el pH intracelular, afectando a la actividad enzimática y proteica. Los desequilibrios en los niveles de Na+ y K+ como resultado de la despolarización de la membrana pueden interrumpir el flujo de Ca++ fuera del RE. Los periodos prolongados de ejercicio sostenido pueden dañar el RE y el sarcolema, lo que da lugar a un deterioro de la regulación del Ca++.
La actividad muscular intensa da lugar a una deuda de oxígeno, que es la cantidad de oxígeno necesaria para compensar el ATP producido sin oxígeno durante la contracción muscular. El oxígeno es necesario para restablecer los niveles de ATP y fosfato de creatina, convertir el ácido láctico en ácido pirúvico y, en el hígado, convertir el ácido láctico en glucosa o glucógeno. Otros sistemas utilizados durante el ejercicio también requieren oxígeno, y todos estos procesos combinados dan lugar al aumento de la frecuencia respiratoria que se produce después del ejercicio. Hasta que se haya cubierto la deuda de oxígeno, la ingesta de oxígeno es elevada, incluso después de que el ejercicio haya cesado.
La relajación de un músculo esquelético
La relajación de las fibras musculares esqueléticas y, en última instancia, del músculo esquelético, comienza con la neurona motora, que deja de liberar su señal química, la ACh, en la sinapsis de la NMJ. La fibra muscular se repolariza, lo que cierra las puertas en el SR donde se liberaba Ca++. Las bombas de ATP sacarán el Ca++ del sarcoplasma y lo devolverán al RE. Esto resulta en el «reshielding» de los sitios de unión a la actina en los filamentos delgados. Sin la capacidad de formar puentes cruzados entre los filamentos finos y gruesos, la fibra muscular pierde su tensión y se relaja.
Fuerza muscular
El número de fibras musculares esqueléticas en un músculo dado está determinado genéticamente y no cambia. La fuerza muscular está directamente relacionada con la cantidad de miofibrillas y sarcómeros dentro de cada fibra. Los factores, como las hormonas y el estrés (y los esteroides anabólicos artificiales), que actúan sobre el músculo pueden aumentar la producción de sarcómeros y miofibrillas dentro de las fibras musculares, un cambio llamado hipertrofia, que da lugar al aumento de la masa y el volumen en un músculo esquelético. Del mismo modo, la disminución del uso de un músculo esquelético da lugar a la atrofia, donde el número de sarcómeros y miofibrillas desaparece (pero no el número de fibras musculares). Es habitual que un miembro escayolado muestre músculos atrofiados cuando se retira la escayola, y ciertas enfermedades, como la poliomielitis, muestran músculos atrofiados.
Trastornos del sistema muscular
La distrofia muscular de Duchenne (DMD) es un debilitamiento progresivo de los músculos esqueléticos. Es una de las varias enfermedades denominadas colectivamente «distrofia muscular». La DMD está causada por la falta de la proteína distrofina, que ayuda a los delgados filamentos de las miofibrillas a unirse al sarcolema. Sin suficiente distrofina, las contracciones musculares hacen que el sarcolema se desgarre, causando una afluencia de Ca++, lo que lleva al daño celular y a la degradación de las fibras musculares. Con el tiempo, a medida que el daño muscular se acumula, la masa muscular se pierde, y se desarrollan mayores deficiencias funcionales.
La DMD es un trastorno hereditario causado por un cromosoma X anormal. Afecta principalmente a los varones y suele diagnosticarse en la primera infancia. La DMD suele aparecer primero como una dificultad para el equilibrio y el movimiento, y luego progresa hasta la incapacidad para caminar. Continúa progresando hacia arriba en el cuerpo desde las extremidades inferiores hasta la parte superior del cuerpo, donde afecta a los músculos responsables de la respiración y la circulación. En última instancia, causa la muerte debido a la insuficiencia respiratoria, y los afectados no suelen vivir más allá de sus 20 años.
Debido a que la DMD es causada por una mutación en el gen que codifica la distrofina, se pensó que la introducción de mioblastos sanos en los pacientes podría ser un tratamiento eficaz. Los mioblastos son las células embrionarias responsables del desarrollo muscular, e idealmente, llevarían genes sanos que podrían producir la distrofina necesaria para la contracción muscular normal. Este enfoque ha sido en gran parte infructuoso en humanos. Un enfoque reciente ha implicado el intento de aumentar la producción del músculo de utrofina, una proteína similar a la distrofina que puede ser capaz de asumir el papel de la distrofina y prevenir el daño celular que se produzca.
Preguntas de autocomprobación
Haga la prueba de abajo para comprobar su comprensión de la Contracción y Relajación de las Fibras Musculares:
