La forma larga de la tabla periódica, comúnmente utilizada, está diseñada para enfatizar las configuraciones de electrones. Dado que son los electrones más externos (de valencia) los que participan principalmente en las interacciones químicas entre los átomos, el último electrón que se añade a un átomo en el proceso de construcción es mucho más interesante para un químico que el primero. Este último electrón se denomina electrón distintivo porque distingue a un átomo del inmediatamente anterior en la tabla periódica. El tipo de subesfera (s, p, d, f) en la que se coloca el electrón distintivo está muy relacionado con el comportamiento químico de un elemento y da lugar a la clasificación que muestra el código de colores de la tabla periódica que se ve aquí. Los elementos representativos son aquellos en los que el electrón distintivo entra en el subesqueleto ans o p. La mayoría de los elementos cuya química y valencia hemos discutido hasta ahora entran en esta categoría. Muchas de las propiedades químicas de los elementos representativos pueden explicarse a partir de los diagramas de Lewis. Es decir, las valencias de los elementos representativos pueden predecirse a partir del número de electrones de valencia que tienen, o del número de electrones que habría que añadir para alcanzar la misma configuración electrónica que un átomo de un gas noble. Para los elementos representativos, el número de electrones de valencia es el mismo que el número del grupo periódico, y el número necesario para alcanzar la siguiente configuración de un gas noble es 8 menos el número del grupo. Esto concuerda con las reglas de valencia derivadas de la tabla periódica, y da como resultado fórmulas para los cloruros de la primera docena de elementos que muestran la variación periódica de la valencia.
| Elemento | Peso atómico | Compuestos de hidrógeno | Compuestos de oxígeno | Compuestos de cloro |
|---|---|---|---|---|
| Hidrógeno | 1.01 | H2 | H2O, H2O2 | HCl |
| Helio | 4.00 | Nada formado | Nada formado | Nada formado |
| Litio | 6.94 | LiH | Li2O, Li2O2 | LiCl |
| Berilio | 9.01 | BeH2 | BeO | BeCl2 |
| Borón | 10.81 | B2H6 | B2O3 | BCl3 |
| Carbono | 12.01 | CH4, C2H6, C3H8 | CO2, CO, C2O3 | CCl4, C2Cl6 |
| Nitrógeno | 14.01 | NH3, N2H4, HN3 | N2O, NO, NO2, N2O5 | NCl3 |
| Oxígeno | 16.00 | H2O, H2O2 | O2, O3 | <Cl2O, ClO2, Cl2O7 |
| Fluorina | 19.00 | HF | OF2, O2F2 | ClF, ClF3, ClF5 |
| Neón | 20.18 | No se forma | No se forma | No se forma |
| Sodio | 22.99 | NaH | Na2O, Na2O2 | NaCl |
| Magnesio | 24.31 | MgH2 | MgO | MgCl2 |
Las tres primeras filas horizontales o periodos de la tabla periódica moderna están formadas enteramente por elementos representativos. En el primer período los electrones distintivos para el H y el He están en la subcélula 1s. En el segundo período, el Li y el Be tienen electrones distintivos en el subesqueleto 2s, y se añaden electrones al subesqueleto 2p en los átomos del B al Ne. En el tercer período la subcélula 3s se está llenando para el Na y el Mg, y por tanto para el Al, el Si, el P, el S, el Cl y el Ar. Como regla general, en el caso de los elementos representativos, el electrón distintivo estará en una subcapa ns o np. El valor de n, el número cuántico principal del electrón distintivo, puede determinarse rápidamente contando hacia abajo desde la parte superior de la tabla periódica. Por ejemplo, el yodo es un elemento representativo del quinto período. Por lo tanto, el electrón distintivo debe ocupar la subcapa 5s o 5p. Como el yo está en el lado derecho de la tabla, 5p es la elección correcta.
Cuando el número cuántico principal es tres o más, también son posibles las subcubiertas de tipo d. Los elementos de transición o metales de transición son aquellos elementos cuyo electrón distintivo se encuentra en un orbital d. Los primeros ejemplos de metales de transición (Sc, Ti, V, Cr, Mn, Fe, Co, Ni, Cu, Zn) se encuentran en el cuarto periodo aunque el electrón distintivo en cada caso es un electrón 3d y pertenece a la tercera envoltura. Este hiato se debe, como ya hemos visto, a que el 4s es de menor energía que el 3d. Así, el orbital 4s comienza a llenarse, iniciando el cuarto período antes de que pueda ocuparse alguno de los orbitales 3d.
La figura \N(\PageIndex{1}) compara las distribuciones de probabilidad de un electrón 4s y uno 3d en un átomo V. Aunque la nube de electrones 4s se encuentra más lejos del núcleo en promedio que la nube 3d, una pequeña porción de la densidad de electrones 4s se encuentra muy cerca del núcleo, donde apenas está protegida de la carga nuclear total de +23. Es la fuerza de atracción muy fuerte de esta pequeña fracción de la densidad total de electrones 4s la que reduce la energía del electrón 4s por debajo de la del 3d.
_and_4s_(color)_Electron_Clouds.jpg?revision=1)
El hecho de que la nube de electrones 4s sea más extensa que la 3d tiene una importante influencia en la química de los elementos de transición. Cuando un átomo como el V (Figura \(\PageIndex{1}\) ) interactúa con otro átomo, son los electrones 4s que se extienden más lejos del núcleo los que primero entran en contacto con el otro átomo. Así, los electrones 4s son a menudo más significativos que los 3d a la hora de determinar la valencia y las fórmulas de los compuestos. Los electrones 3d están «enterrados» bajo la superficie de los átomos de los metales de transición. Añadir un electrón 3d más tiene un efecto considerablemente menor sobre sus propiedades químicas que añadir un electrón 3s o 3p más en el caso de los elementos representativos. De ahí que haya una transición lenta pero constante en las propiedades de un elemento de transición a otro. Obsérvese, por ejemplo, que salvo el Sc, todos los metales de transición forman cloruros, MCl2, en los que el metal tiene una valencia 2; ejemplos de ello son TiCl2, VCl2, CrCl2, etc. Esto se puede ver en la tabla que se encuentra en la parte superior de esta página. La valencia 2 se corresponde con los dos electrones de valencia 4s.
Cada uno de los metales de transición presenta también otras valencias en las que intervienen también uno o varios de los electrones 3d. Por ejemplo, en algunos compuestos el V (vanadio) tiene una valencia 2 (VO, VCl2) en otros tiene una valencia 3 (V2O3, VCl3), en otros tiene una valencia 4 (VO2, VCl4), y en al menos un caso (V2O5) tiene una valencia 5. La química de los metales de transición es más complicada y es posible una mayor variedad de fórmulas para los compuestos de metales de transición debido a esta valencia variable. En algunos casos, los electrones de las subcubiertas d actúan como electrones de valencia, mientras que en otros casos no lo hacen. Aunque las nubes de electrones 3d no se extienden más allá del núcleo que las 3s y 3p (y por lo tanto no constituyen otra envoltura como los electrones 4s), están completamente protegidos de la carga nuclear y por lo tanto a menudo actúan como electrones de valencia. Este comportamiento de Jekyll y Hyde de los electrones 3d hace la vida más complicada (y a menudo mucho más interesante) para los químicos que estudian los elementos de transición.
| Z | Elemento | Configuración |
|---|---|---|
| 1 | H | 1s 1 |
| 2 | He | 1s 2 |
| 3 | Li | 2s 1 |
| 4 | Be | 2s 2 |
| 5 | B | 2s 2p1 |
| 6 | C | 2s 2 2p2 |
| 7 | N | 2s 2 2p3 |
| 8 | 0 | 2s 2 2p4 |
| 9 | F | 2s 2 2p5 |
| 10 | Ne | 2s 2 2p6 |
| 11 | Na | 3s 1 |
| 12 | Mg | 3s 2 |
| 13 | Al | 3s 2 3p1 |
| 14 | Si | 3s 2 3p2 |
| 15 | P | 3s 2 3p3 |
| 16 | S | 3s 2 3p4 |
| 17 | Cl | 3s 2 3p5 |
| 18 | Ar | 3s 2 3p6 |
| 19 | K | 4s 1 |
| 20 | Ca | 4s 2 |
| 21 | Sc | 3d 1 4s 2 |
| 22 | Ti | 3d 2 4s 2 |
| 23 | V | 3d 3 4s 2 |
| 24 | Cr | 3d 5 4s 1 |
| 25 | Mn | 3d 5 4s 2 |
| 26 | Fe | 3d 6 4s 2 |
| 27 | Co | 3d 7 4s 2 |
| 28 | Ni | 3d 8 4s 2 |
| 29 | Cu | 3d 10 4s 1 |
| 30 | Zn | 3d 10 4s 2 |
| 31 | Ga | 3d 10 4s 2 4p 1 |
| 32 | Ge | 3d 10 4s 2 4p 2 |
| 33 | As | 3d 10 4s 2 4p 3 |
| 34 | Se | 3d 10 4s 2 4p 4 |
| 35 | Br | 3d 10 4s 2 4p 5 |
| 36 | Kr | 3d 10 4s 2 4p 6 |
| 37 | Rb | 5s 1 |
| 38 | Sr | 5s 2 |
| 39 | Y | 4d 1 5s 2 |
| 40 | Zr | 4d 2 5s 2 |
| 41 | Nb | 4d 4 5s 1 |
| 42 | Mo | 4d 5 5s 1 |
| 43 | Tc | 4d 5 5s 2 |
| 44 | Ru | 4d 7 5s 1 |
| 45 | Rh | 4d 8 5s 1 |
| 46 | Pd | 4d 10 |
| 47 | Ag | 4d 10 5s 1 |
| 48 | Cd | 4d 10 5s 2 |
| 49 | In | 4d 10 5s 2 5p 1 |
| 50 | Sn | 4d 10 5s 2 5p 2 |
| 51 | Sb | 4d 10 5s 2 5p 3 |
| 52 | Te | 4d 10 5s 2 5p 4 |
| 53 | I | 4d 10 5s 2 5p 5 |
| 54 | Xe | 4d 10 5s 2 5p 6 |
| 55 | Cs | 6s 1 |
| 56 | Ba | 6s 2 |
| 57 | La | 5d 1 6s 2 |
| 58 | Ce | 4f 1 5d 1 6s 2 |
| 59 | Pr | 4f 3 6s 2 |
| 60 | Nd | 4f 4 6s 2 |
| 61 | Pm | 4f 5 6s 2 |
| 62 | Sm | 4f 6 6s 2 |
| 63 | Eu | 4f 7 6s 2 |
| 64 | Gd | 4f 7 5d 1 6s 2 |
| 65 | Tb | 4f 9 6s 2 |
| 66 | Dy | 4f 10 6s 2 |
| 67 | Ho | 4f 11 6s 2 |
| 68 | Er | 4f 12 6s 2 |
| 69 | Tm | 4f 13 6s 2 |
| 70 | Yb | 4f 14 6s 2 |
| 71 | Lu | 4f 14 5d 1 6s 2 |
| 72 | Hf | 4f 14 5d 2 6s 2 |
| 73 | Ta | 4f 14 5d 3 6s 2 |
| 74 | W | 4f 14 5d 4 6s 2 |
| 75 | Re | 4f 14 5d 5 6s 2 |
| 76 | 0s | 4f 14 5d 6 6s 2 |
| 77 | Ir | 4f 14 5d 7 6s 2 |
| 78 | Pt | 4f 14 5d 9 6s 1 |
| 79 | Au | 4f 14 5d 10 6s 1 |
| 80 | Hg | 4f 14 5d 10 6s 2 |
| 81 | Tl | 4f 14 5d 10 6s 2 6p1 |
| 82 | Pb | 4f 14 5d 10 6s 2 6p2 |
| 83 | Bi | 4f 14 5d 10 6s 2 6p 3 |
| 84 | Po | 4f 14 5d 10 6s 2 6p 4 |
| 85 | At | 4f 14 5d 10 6s 2 6p 5 |
| 86 | Rn | 4f 14 5d 10 6s 2 6p 6 |
| 87 | Fr | 7s 1 |
| 88 | Ra | 7s 2 |
| 89 | Ac | 6d 1 7s 2 |
| 90 | Th | 6d 2 7s 2 |
| 91 | Pa | 5f 2 6d 1 7s 2 |
| 92 | U | 5f 3 6d 1 7s 2 |
| 93 | Np | 5f 4 6d 1 7s 2 |
| 94 | Pu | 5f 6 7s 2 |
| 95 | Am | 5f 7 7s 2 |
| 96 | Cm | 5f 7 6d 1 s 2 |
| 97 | Bk | 5f 9 s 2 |
| 98 | Cf | 5f 10 s 2 |
| 99 | Es | 5f 11 s 2 |
| 100 | Fm | 5f 12 s 2 |
| 101 | Md | 5f 13 s 2 |
| 102 | No | 5f 14 s 2 |
| 103 | Lr | 5f 14 6d 1 s 2 |
| 104 | Rf | 5f 14 6d 2 s 2 |
La tercera gran categoría de elementos surge cuando el electrón distintivo ocupa un subesfera f. El primer ejemplo se da en el caso de los lantanoides (elementos con números atómicos entre 57 y 71).Los lantanoides tienen la configuración electrónica general
4d104f i5s25p65d0 o 16s2
donde i es un número entre 0 y 14. Por lo tanto, en el proceso de construcción de los lantanoides, los electrones se añaden a una subcapa (4f) cuyo número cuántico principal es dos menos que el del orbital más externo (6s). La adición de otro electrón a un caparazón interno enterrado tan profundamente como el 4f tiene poco o ningún efecto sobre las propiedades químicas de estos elementos. Todos ellos son bastante similares al lantano (La) y podrían ocupar exactamente el mismo espacio en la tabla periódica que el La. Los elementos lantanoides son tan similares entre sí que se requieren técnicas especiales para separarlos. Por ello, hasta la década de 1870 no se prepararon muestras aproximadamente puras de la mayoría de ellos. Tras el elemento actinio (Ac) se encuentra una serie de átomos en los que se rellena el subesqueleto 5f. Los actinoides son algo menos parecidos al Ac que los lantanoides al La, ya que se producen algunas excepciones al orden habitual de los orbitales de relleno en el caso del Th, el Pa y el U (Tabla \(\PageIndex{1}\) ).
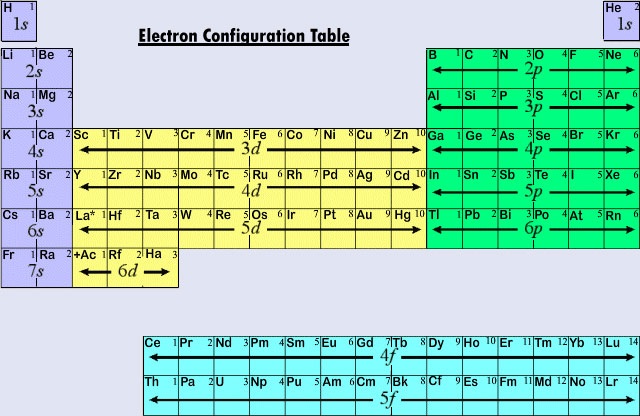
Debido a que los lantanoides y la mayoría de los actinoides se comportan químicamente como si debieran encajar en el grupo IIIB de la tabla periódica (donde se encuentran la Lu y la Lr), ambos grupos se separan del resto de la tabla y se colocan juntos en un bloque inferior. En conjunto, los lantanoides y actinoides se denominan elementos de transición interna porque las subcáscaras f que se llenan se encuentran muy profundas dentro de la estructura electrónica restante de sus átomos.
La figura \(\PageIndex{2}) resume el tipo de subcáscara en la que se encuentra el electrón distintivo para los átomos de los elementos en varias regiones de la tabla periódica. Esta información resumida hace que sea relativamente sencillo utilizar la tabla periódica para obtener configuraciones de electrones, como muestra el siguiente ejemplo.
Ejemplo \(\PageIndex{1}\): Configuración electrónica
Obtenga la configuración electrónica para (a) Nb; (b) Pr.
Solución
a) El Nb, elemento número 41, se encuentra en el quinto período y en una región de la tabla periódica donde se rellena una subcáscara d (la segunda serie de transición). Moviéndonos hacia atrás (hacia números atómicos más bajos) a través de la tabla periódica, el gas noble más cercano es el Kr, por lo que utilizamos el núcleo Kr:
Nb _____
El siguiente elemento después del 36K es el 37Rb en el que se está llenando el subesqueleto 5s. Moviéndonos hacia la derecha un espacio más, llegamos al 38Sr que tiene un par 5s2. Hasta ahora tenemos Nb _____ 5s2 para la configuración Nb. Ahora nos movemos más a la derecha en la región del subesqueleto 4d de la tabla periódica y contamos tres espacios (Y, Zr, Nb) para llegar al Nb. La configuración total de los electrones es, pues, Nb 4d35s2 (Obsérvese que el número cuántico principal del subesqueleto d es 4, uno menos que el número del período. Además, si se observa la tabla de configuraciones electrónicas, hay que notar que el Nb es una excepción a las reglas típicas de llenado de orbitales) b) Se sigue un procedimiento similar para el Pr, elemento número 59. Retrocediendo en la tabla, el gas noble más cercano es el Xe, por lo que utilizamos el núcleo del Xe. Contando de nuevo hacia delante, el Cs y el Ba corresponden al 6s2. A continuación, La, Ce y Pr corresponden a tres electrones más en la subcélula 4f. La configuración es, pues, Pr…4f36s2
Hay que destacar un punto más sobre la relación entre la configuración electrónica y la tabla periódica. Los átomos de los elementos de la misma columna vertical de la tabla tienen configuraciones electrónicas similares. Por ejemplo, consideremos los elementos alcalinotérreos (grupo IIA). Usando nuestras reglas para derivar configuraciones electrónicas (Ejemplo 1) tenemos
| Elemento | Configuración electrónica | Diagrama de Lewis |
|---|---|---|
| Be | 2s2 | Be: |
| Mg | 3s2 | Mg: |
| Ca | 4s2 | Ca: |
| Sr | 5s2 | Sr: |
| Ba | 6s2 | Ba: |
| Ra | 7s2 | Ra: |
Por tanto, las similitudes de comportamiento químico y valencia señaladas anteriormente para estos elementos se correlacionan con las similitudes de sus nubes electrónicas más externas. Estas similitudes explican el éxito de las predicciones de Mendeléyev sobre las propiedades de los elementos no descubiertos.
Contribuidores y atribuciones
-
Ed Vitz (Kutztown University), John W. Moore (UW-Madison), Justin Shorb (Hope College), Xavier Prat-Resina (University of Minnesota Rochester), Tim Wendorff y Adam Hahn.
