Sin embargo, dependiendo de las propiedades ácido-base de los iones que la componen, una sal puede disolverse en agua para producir una solución neutra, una solución básica o una solución ácida.
Cuando una sal como \(NaCl\) se disuelve en agua, produce \(Na^+_(aq)}) e \(Cl^-_(aq)}) iones. Utilizando un enfoque de Lewis, el ion \(Na^+\) puede considerarse un ácido porque es un aceptor de pares de electrones, aunque su baja carga y su radio relativamente grande lo convierten en un ácido muy débil. El ion \(Cl^-\) es la base conjugada del ácido fuerte \(HCl\), por lo que esencialmente no tiene carácter básico. En consecuencia, la disolución de \(NaCl\) en agua no tiene ningún efecto sobre el \(pH\) de una solución, y la solución permanece neutra.
Ahora comparemos este comportamiento con el de las soluciones acuosas de cianuro de potasio y acetato de sodio. De nuevo, los cationes (\(K^+\) y \(Na^+\)) no tienen esencialmente carácter ácido, pero los aniones (\(CN^-\) y \(CH_3CO_2^-\)) son bases débiles que pueden reaccionar con el agua porque son las bases conjugadas de los ácidos débiles \(HCN\) y el ácido acético, respectivamente.
\
\
Ninguna de las dos reacciones procede muy a la derecha como se escribe porque se favorece la formación del par ácido-base más débil. Tanto el \(HCN\) como el ácido acético son ácidos más fuertes que el agua, y el hidróxido es una base más fuerte que el acetato o el cianuro, por lo que en ambos casos, el equilibrio se encuentra a la izquierda. Sin embargo, cada una de estas reacciones genera suficientes iones de hidróxido para producir una solución básica. Por ejemplo, el \ (pH\) de una solución 0,1 M de acetato de sodio o cianuro de potasio a 25°C es 8,8 o 11,1, respectivamente. A partir de la Tabla \(\PageIndex{1}) y la Figura \(\PageIndex{1}), podemos ver que \(CN^-\) es una base más fuerte (\(pK_b = 4,79\)) que el acetato (\(pK_b = 9.24\)), lo que es consistente con \(KCN\) produciendo una solución más básica que el acetato de sodio a la misma concentración.
En contraste, el ácido conjugado de una base débil debe ser un ácido débil (Ecuación \(\ref{16.2}\). Por ejemplo, el cloruro de amonio y el cloruro de piridinio son sales producidas al reaccionar el amoníaco y la piridina, respectivamente, con \(HCl\). Como ya sabes, el ion cloruro es una base tan débil que no reacciona con el agua. Por el contrario, los cationes de las dos sales son ácidos débiles que reaccionan con el agua de la siguiente manera:
\
\8653>
La ecuación \(\ref{16.2) indica que \N(H_3O^+\N) es un ácido más fuerte que \N(NH_4^+\N) o \N(C_5H_5NH^+\N), y a la inversa, el amoníaco y la piridina son bases más fuertes que el agua. Por lo tanto, el equilibrio estará muy a la izquierda en ambos casos, favoreciendo al par ácido-base más débil. Sin embargo, la concentración de \(H_3O^+\) producida por las reacciones es lo suficientemente grande como para disminuir el \(pH\) de la solución de forma significativa: el \(pH\) de una solución 0,10 M de cloruro de amonio o de cloruro de piridinio a 25°C es de 5,13 o 3,12, respectivamente. Esto es consistente con la información mostrada en la figura 16.2, lo que indica que el ion piridinio es más ácido que el ion amonio.
¿Qué sucede con las soluciones acuosas de una sal como el acetato de amonio, donde tanto el catión como el anión pueden reaccionar por separado con el agua para producir un ácido y una base, respectivamente? Según la figura 16.10, el ion amonio bajará el \(pH\), mientras que según la ecuación \(\ref{16.3}\), el ion acetato subirá el \(pH\). Este caso particular es inusual, ya que el catión es un ácido tan fuerte como el anión es una base (pKa ≈ pKb). En consecuencia, los dos efectos se anulan y la solución permanece neutra. Con sales en las que el catión es un ácido más fuerte que el anión es una base, la solución final tiene un \(pH\) < 7,00. Por el contrario, si el catión es un ácido más débil que el anión es una base, la solución final tiene un \(pH\) > 7.00.
Las soluciones de sales simples de iones metálicos también pueden ser ácidas, aunque un ion metálico no puede donar un protón directamente al agua para producir \(H_3O^+\). En cambio, un ion metálico puede actuar como un ácido de Lewis e interactuar con el agua, una base de Lewis, coordinándose con un par solitario de electrones en el átomo de oxígeno para formar un ion metálico hidratado (parte (a) en la Figura \(\PageIndex{1})). Una molécula de agua coordinada con un ion metálico es más ácida que una molécula de agua libre por dos razones. En primer lugar, las interacciones electrostáticas repulsivas entre el ion metálico cargado positivamente y los átomos de hidrógeno parcialmente cargados positivamente de la molécula de agua coordinada facilitan que el agua coordinada pierda un protón.
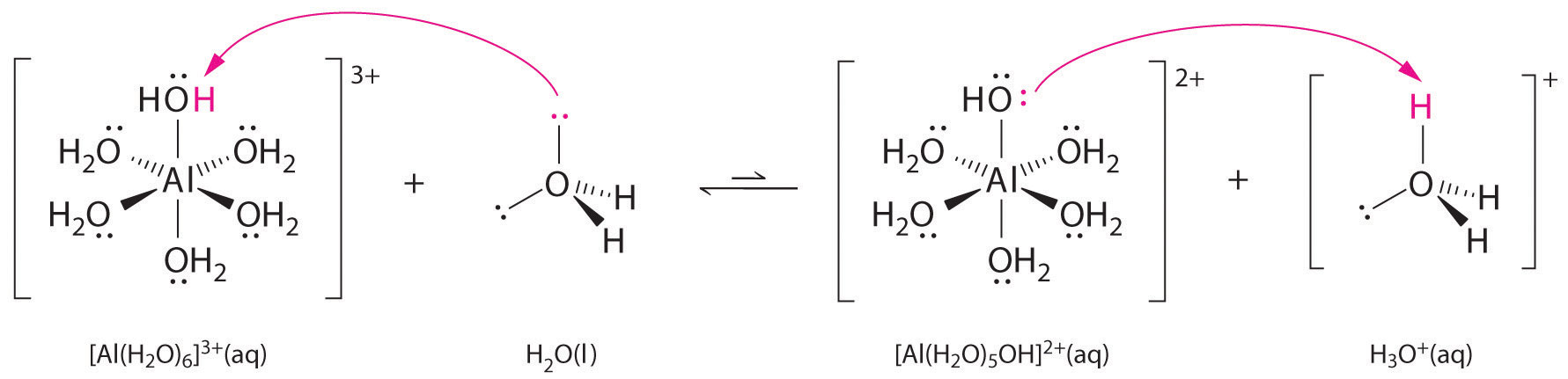
En segundo lugar, la carga positiva del ion \(Al^{3+}\) atrae la densidad de electrones de los átomos de oxígeno de las moléculas de agua, lo que disminuye la densidad de electrones en los enlaces \(\ce{O-H}\), como se muestra en la parte (b) de la Figura \(\PageIndex{1}\). Con menos densidad de electrones entre los átomos de O y los átomos de H, los enlaces de O-H son más débiles que en una molécula libre de H2O, lo que facilita la pérdida de un ion de H+.
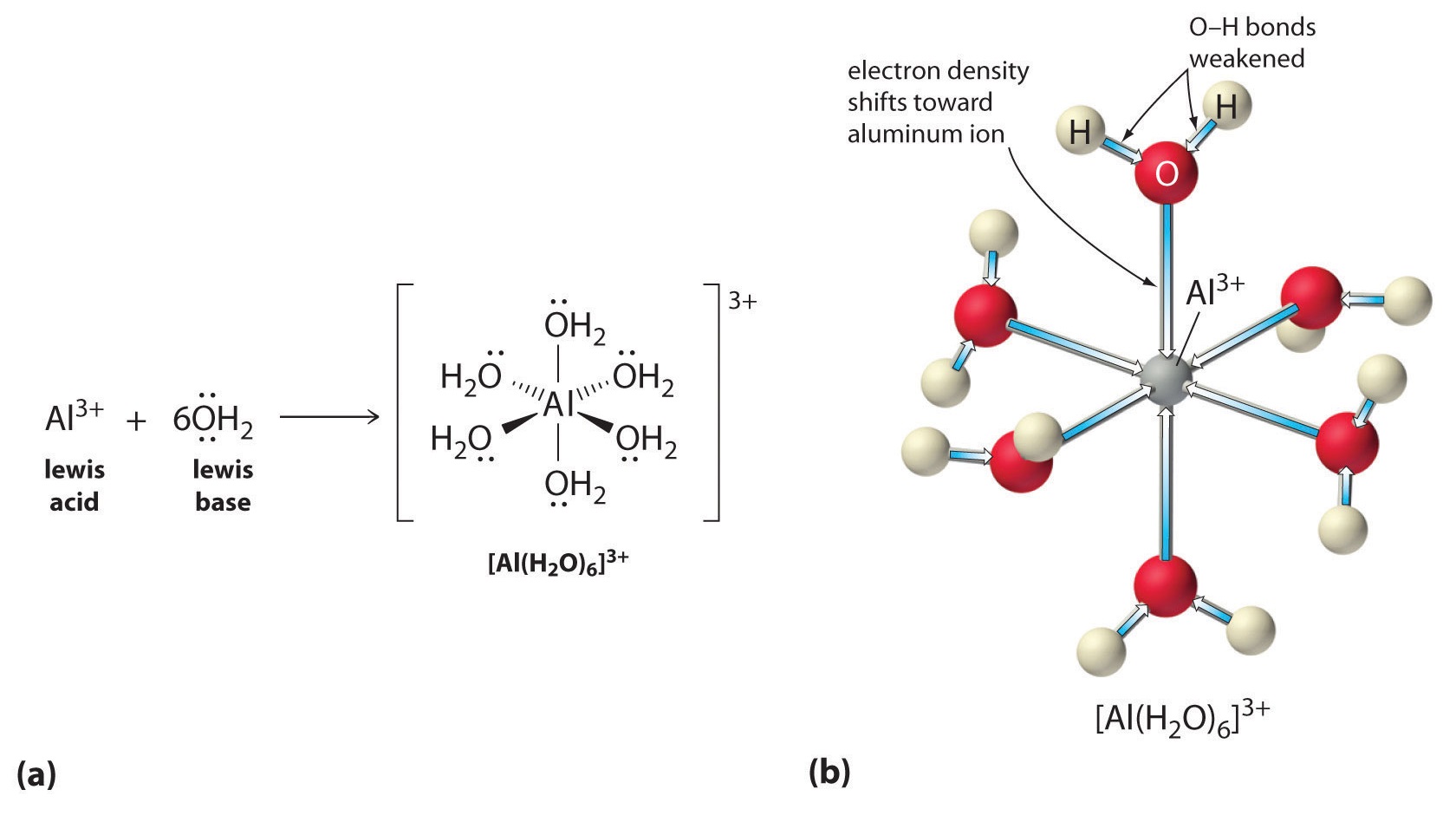
Figura (\PageIndex{1}): Efecto de un ion metálico en la acidez del agua (a) La reacción del ion metálico \(Al^{3+}\) con el agua para formar el ion metálico hidratado es un ejemplo de reacción ácido-base de Lewis. (b) La carga positiva del ion aluminio atrae la densidad de electrones de los átomos de oxígeno, lo que desplaza la densidad de electrones de los enlaces O-H. La disminución de la densidad de electrones debilita los enlaces O-H en las moléculas de agua y les facilita la pérdida de un protón.
La magnitud de este efecto depende de los dos factores siguientes (Figura \(\PageIndex{2}):
- La carga del ion metálico. Un ion divalente (\(M^{2+}\)) tiene aproximadamente el doble de efecto sobre la densidad de electrones en una molécula de agua coordinada que un ion monovalente (\(M^+\)) del mismo radio.
- El radio del ion metálico. Para los iones metálicos con la misma carga, cuanto más pequeño es el ion, más corta es la distancia internuclear al átomo de oxígeno de la molécula de agua y mayor es el efecto del metal en la distribución de la densidad de electrones en la molécula de agua.
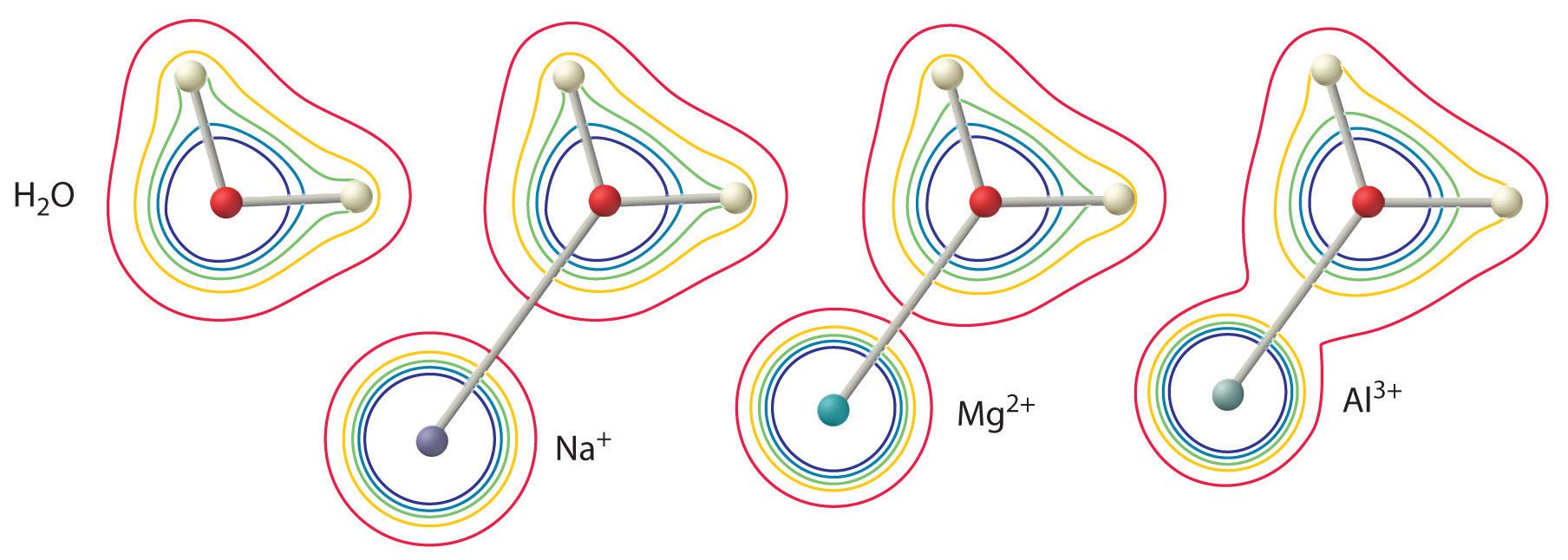
Figura (\PageIndex{2}\): El efecto de la carga y el radio de un ion metálico en la acidez de una molécula de agua coordinada. Los contornos muestran la densidad de electrones en los átomos de O y los átomos de H, tanto en una molécula de agua libre (izquierda) como en moléculas de agua coordinadas con iones \(Na^+), \(Mg^{2+}\ y \(Al^{3+}\). Estos mapas de contorno demuestran que el ion metálico más pequeño y con mayor carga (\(Al^{3+}\)) provoca la mayor disminución de la densidad electrónica de los enlaces O-H de la molécula de agua. Debido a este efecto, la acidez de los iones metálicos hidratados aumenta a medida que la carga del ion metálico aumenta y su radio disminuye.
Por lo tanto, las soluciones acuosas de iones metálicos pequeños y altamente cargados, como \(Al^{3+}\️) y \️(Fe^{3+}\️), son ácidas:
\️(aq)} \rightleftharpoons ^{2+}_{(aq)}+H^+_{(aq)} \label{16.36}]
El ión \(^{3+}\ tiene un \(pK_a) de 5,0, por lo que es un ácido casi tan fuerte como el ácido acético. Debido a los dos factores descritos anteriormente, el parámetro más importante para predecir el efecto de un ion metálico en la acidez de las moléculas de agua coordinadas es la relación carga-radio del ion metálico. Varios pares de iones metálicos que se encuentran en una línea diagonal en la tabla periódica, como \ (Li^+\) y \ (Mg^{2+}\) o \ (Ca^{2+}\) y \ (Y^{3+}\), tienen tamaños y cargas diferentes, pero relaciones carga-radio similares. Como resultado, estos pares de iones metálicos tienen efectos similares en la acidez de las moléculas de agua coordinadas, y a menudo muestran también otras similitudes significativas en la química.
Las soluciones de iones metálicos pequeños y altamente cargados en el agua son ácidas.
Reacciones como las discutidas en esta sección, en las que una sal reacciona con el agua para dar una solución ácida o básica, a menudo se llaman reacciones de hidrólisis. Usar un nombre separado para este tipo de reacciones es desafortunado porque sugiere que son de alguna manera diferentes. De hecho, las reacciones de hidrólisis son simplemente reacciones ácido-base en las que el ácido es un catión o la base es un anión; obedecen a los mismos principios y reglas que todas las demás reacciones ácido-base.
Una reacción de hidrólisis es una reacción ácido-base.
Ejemplo \(\PageIndex{1})
Predecir si las soluciones acuosas de estos compuestos son ácidas, básicas o neutras.
- (KNO_3)
- (CrBr_3 cdot H_2O)
- (Na_2SO_4)
Dado: compuesto
Se pide: acidez o basicidad de la solución acuosa
Estrategia:
- Evaluar las propiedades ácido-base del catión y del anión. Si el catión es un ácido de Lewis débil, no afectará al pH de la solución. Si el catión es el ácido conjugado de una base débil o un catión metálico relativamente cargado, sin embargo, reaccionará con el agua para producir una solución ácida.
- Si el anión es la base conjugada de un ácido fuerte, no afectará al \(pH\) de la solución. Si, por el contrario, el anión es la base conjugada de un ácido débil, la solución será básica.
Solución:
a
- El catión \(K^+\) tiene una carga positiva pequeña (+1) y un radio relativamente grande (porque está en la cuarta fila de la tabla periódica), por lo que es un ácido de Lewis muy débil.
- El anión \(NO_3-\) es la base conjugada de un ácido fuerte, por lo que no tiene esencialmente ningún carácter básico (Tabla 16.1). Por tanto, ni el catión ni el anión reaccionarán con el agua para producir \(H^+\) o \(OH^-\), y la solución será neutra.
b.
- El ion \(Cr^{3+}\ es un catión metálico relativamente cargado que debería comportarse de forma similar al ion \(Al^{3+}\ y formar el complejo \(^{3+}\, que se comportará como un ácido débil: \^^3+}_(aq)} \ce{ <=>>} Cr(H_2O)_5(OH)]^{2+}_{(aq)} + H^+_(aq)} \nonumber]
- El anión \(Br^-\) es una base muy débil (es la base conjugada del ácido fuerte \(HBr\)), por lo que no afecta a la \ (pH\) de la solución. Por lo tanto, la solución será ácida.
c.
- El ion \(Na^+\), al igual que el \(K^+\), es un ácido muy débil, por lo que no debería afectar a la acidez de la solución.
- En cambio, el \(SO_4^{2-\}) es la base conjugada del \(HSO_4^-\), que es un ácido débil. Por lo tanto, el ión \(SO_4^{2-}\Nreaccionará con el agua como se muestra en la figura 16.6 para dar una solución ligeramente básica.
Ejercicio \(\PageIndex{1})
Predecir si las soluciones acuosas de los siguientes son ácidas, básicas o neutras.
- (KI)
- (Mg(ClO_4)_2)
- (NaHS)
Responde:
- neutral
- ácido
- básico (debido a la reacción de \(HS^-\) con el agua para formar \(H_2S\) y \(OH^-\))
Resumen
Una sal puede disolverse en agua para producir una solución neutra, una solución básica o ácida, dependiendo de si contiene la base conjugada de un ácido débil como anión (\(A^-\)), el ácido conjugado de una base débil como catión (\(BH^+\)), o ambos. Las sales que contienen pequeños iones metálicos muy cargados producen soluciones ácidas en el agua. La reacción de una sal con el agua para producir una solución ácida o básica se llama reacción de hidrólisis.
