A: AMINOÁCIDOS
BIOQUÍMICA – DR. JAKUBOWSKI
Última actualización: 27/02/16
Metas/Objetivos de aprendizaje para el capítulo 2A: Después de la clase y de esta lectura, los estudiantes serán capaces de
- declarar la carga de las cadenas laterales de los aminoácidos utilizando la ecuación de Henderson Hasselbach y la carga aproximada por inspección a cualquier pH
- dibujar mecanismos e identificar productos para la reacción de las cadenas laterales nucleófilas Lys y Cys con agentes de modificación química comunes y extender esta comprensión a las reacciones de His.
- Dibujar mecanismos para las reacciones de intercambio de disulfuro para los sulfhidrilos utilizándolos y los números de oxidación para explicar las reacciones redox de la cisteína/cistina.
A7. Química de la cistina
Dos cadenas laterales de cisteína pueden interactuar covalentemente en una proteína para producir un disulfuro. Al igual que el HOOH (peróxido de hidrógeno) está más oxidado que el HOH (el O del H2O2 tiene un número de oxidación de 1- mientras que el O del H2O tiene un número de oxidación de 2-), el RSSR es la forma oxidada (número de oxidación S 1-) y el RSH es la forma reducida (número de oxidación S 2-) de los tioles. Sus números de oxidación son análogos ya que tanto el O como el S están en el grupo 6 de la tabla periódica y ambos son más electronegativos que el C.
Un rápido repaso a las reacciones redox y a los números de oxidación.
Figura: REACCIONES DE DISULFURO – CISTINA
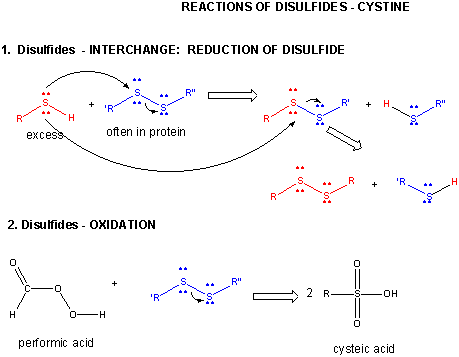
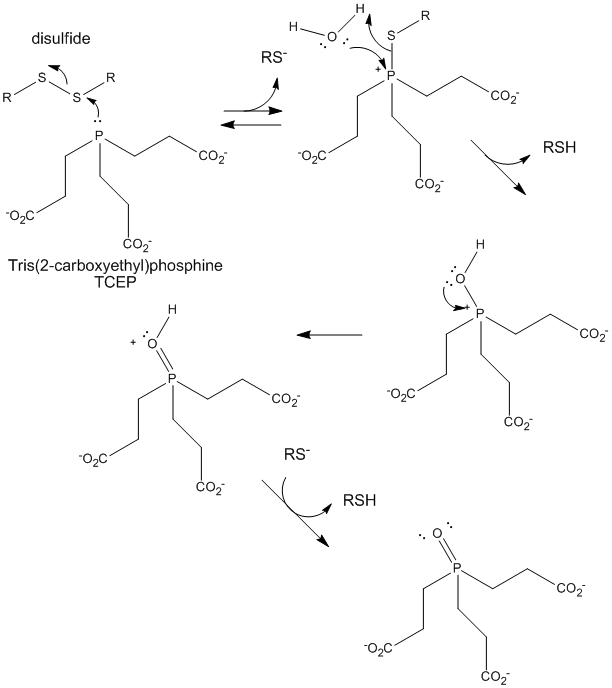
Cuando una proteína se pliega, dos cadenas laterales de Cys podrían acercarse entre sí, y formar un enlace disulfuro intracadena. Del mismo modo, dos cadenas laterales de Cys en proteínas separadas pueden acercarse entre sí y formar un disulfuro intercadena. Tales disulfuros deben ser escindidos y las cadenas separadas antes de analizar la secuencia de la proteína. El disulfuro en la proteína puede escindirse mediante agentes reductores como el beta-mercaptoetanol, el ditiotreitol, la tris (2-carboxietil) fosfina (TCEP) o agentes oxidantes que oxidan aún más el disulfuro para separar los ácidos cisteicos.
Figura: Agentes oxidantes de disulfuros – b-mercaptoetanol, ditiotreitol y fosfinas
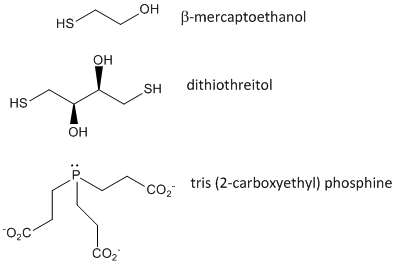
Figura: Reducción de disulfuros por TCEP
El interior de las células se mantiene en un entorno reducido por la presencia de muchos agentes «reductores», como el tripéptido g-glu-cys-gly (glutatión). De ahí que las proteínas intracelulares no suelan contener disulfuros, que sí son abundantes en las proteínas extracelulares (como las que se encuentran en la sangre) o en ciertos orgánulos como el retículo endoplásmico y el espacio intermembrana mitocondrial donde pueden introducirse disulfurosc.
Figura:
Reducción de enlaces disulfuro en proteínas
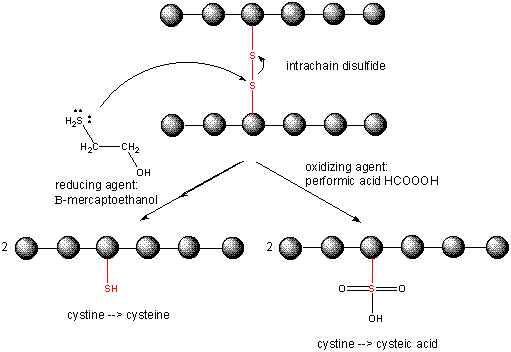
Química redox de la cisteína
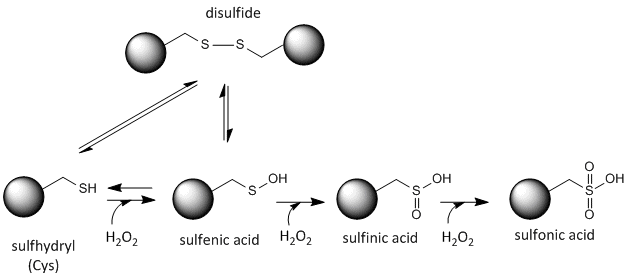
El azufre de la cisteína es redox-activo y, por tanto, puede existir en una amplia variedad de estados, dependiendo del entorno redox local y de la presencia de agentes oxidantes y reductores. Un potente agente oxidante que puede producirse en las células es el peróxido de hidrógeno, que puede provocar modificaciones químicas más drásticas e irreversibles en las cadenas laterales de la Cys. Si una Cys reactiva es importante para la función de la proteína, entonces la función de la proteína puede ser modulada (a veces de forma reversible, a veces de forma irreversible) con varios agentes oxidantes, como se muestra en la figura siguiente.
Figura:Estado redox de la cisteína
Navegación
Volver alCapítulo 2A: Secciones de aminoácidos
Volver alTabla de contenidos de Bioquímica en línea
Versión archivada delCapítulo 2A: Aminoácidos
