Cuando un gas en flujo constante pasa a través de una constricción, por ejemplo, en un orificio o válvula, normalmente experimenta un cambio de temperatura. Esto se debe en parte a los cambios en la energía cinética, pero hay otra parte que contribuye la no idealidad del gas. Si los conductos aguas arriba y aguas abajo son lo suficientemente grandes para que la energía cinética sea despreciable en estas estaciones, las temperaturas aguas arriba y aguas abajo se miden lo suficientemente lejos de la perturbación creada por la constricción y el sistema es adiabático; el efecto medido se debe únicamente a la no idealidad. A partir de la primera ley de la termodinámica, este proceso es isentálpico y se puede definir útilmente un coeficiente Joule-Thomson como:
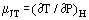
como una medida del cambio de temperatura que resulta de una caída de presión a través de la constricción.
Para la mayoría de los gases reales en torno a las condiciones ambientales, μ es positivo, es decir, la temperatura cae al pasar por la constricción. Para el hidrógeno y el helio, es negativo y la temperatura aumenta. A temperaturas más altas, para la mayoría de los gases, μ cae e incluso puede llegar a ser negativo, μ también puede llegar a ser negativo mediante la aplicación de presión, incluso a temperatura ambiente, pero normalmente son necesarias presiones superiores a 200 bar para conseguirlo.
