La recolección de insectos es una afición interesante para muchos, pero también es muy útil en la investigación científica. En este post se explicará cómo coleccionar y conservar insectos, y se mostrará cómo deben ser clavados.
La recolección de insectos puede realizarse en cualquier momento, aunque están presentes principalmente durante la primavera, hasta finales del otoño. El verano es probablemente la mejor época, ya que los insectos son más abundantes. Los días cálidos y soleados son los que más insectos presentan, sin embargo, sería prudente comprobarlo a lo largo de diferentes épocas y condiciones meteorológicas, ya que diferentes insectos emergen en diferentes momentos. Por la noche, las luces de la calle y de los porches son un buen lugar para buscar. Es probable que la hojarasca y las plantas alberguen insectos, y también hay muchos insectos nocturnos que se mantienen alejados de las luces.
Equipo de recolección:
- Red para insectos – Pueden comprarse o hacerse. Deben estar hechas de red, que se cose a una tela de muselina o lona que envuelve el alambre. A partir de ahí, el insecto puede ser transferido a un tarro, ya sea metiendo el tarro en la red, o sujetando el insecto por el tórax.
-

Mi tarro de matar. PC: Colton Weaver Jarro para matar – Lo mejor es tener 2-3 tarros de muchas formas y tamaños. Lo ideal es que estén tapados con corcho, aunque esto puede depender. Deben tener una etiqueta visible de «VENENO». Se añade yeso o algodón al tarro para retener el agente letal. Borror, Delong y Triplehorn recomiendan el cianuro, aunque también se puede utilizar acetato de etilo, que es mucho más seguro. También se puede utilizar tetracloruro de carbono o cloroformo.
- Cajas de cartón con tejido
- Sobres, o papel para hacerlos – Útiles para el almacenamiento temporal. Estos pueden ser fácilmente construidos en el campo y mantendrán sus especímenes relativamente seguros.
- Ferales llenos de líquido conservante
- Forceps
- Lente de mano
- Aspirador – Estos capturan pequeños insectos en viales usando su aliento. Normalmente tienen una malla para evitar que se respire el insecto.
- Paraguas o sábana batiente – Se coloca una sábana o paraguas debajo de una planta, que luego se golpea o se agita para que los pequeños insectos caigan sobre la sábana.
- Tamiz – La hojarasca se puede tamizar lentamente sobre una tela blanca o un cartón, y luego se pueden aspirar los insectos encontrados.
- Trampas – Hay muchos tipos de trampas. Un embudo Berlese tiene un embudo con una pantalla, y una bombilla en la parte superior, con alcohol en la parte inferior. Los insectos son atraídos y caen en el tarro de la muerte. Una trampa de luz puede ser eficaz para algunos insectos, y puede ser tan simple como una luz por encima del agente de exterminio, o una trampa de paso donde los insectos se asientan y pueden ser recogidos a mano. Las trampas de caída pueden utilizarse con escarabajos de carroña u otros insectos no voladores, y son simplemente latas con cebo en el fondo. Los insectos caen dentro y no pueden escapar. Una trampa sencilla puede ser simplemente una solución de azúcar extendida sobre una superficie.
- Lámpara de cabeza
- Cuchillo de vaina
Manejo de la captura: Muchos insectos de cuerpo blando pueden colocarse directamente en alcohol isopropílico o etílico al 70-90%. Esto incluye larvas y ninfas de muchas especies, así como algunos insectos más pequeños. Los insectos de cuerpo duro deben colocarse en el frasco de matanza. El tiempo que se tarda en hacerlo depende tanto del insecto como del agente de exterminio, y puede oscilar entre unos minutos y unas horas. Cuando el insecto esté muerto, debe retirarse lo antes posible para evitar una decoloración adicional. Se pueden guardar en cajas de pastillas o en los sobres de papel descritos anteriormente.
Relajación: Si no puede inmovilizar y extender una muestra inmediatamente, probablemente se secará. Cuando está en este estado, es bastante frágil y se romperá si intenta arreglarlo. Para solucionarlo, puede utilizar una cámara de relajación, un líquido relajante o hervir el insecto en agua (aunque esto puede dañarlo).
Las cámaras de relajación son recipientes con arena o tela húmeda en su interior. Lo ideal es añadir ácido carbólico para evitar cualquier moho. Después de uno o dos días debería poder manipularse de nuevo el espécimen.
El líquido relajante puede hacerse con diferentes mezclas, y normalmente se deja al insecto en él durante varios minutos. Una mezcla, a menudo conocida como líquido de Barber, es la que se indica a continuación:
| 95% de alcohol etílico | 50 cm3 |
| Agua | 50cm3 |
| Acetato de etilo acetato | 20cm3 |
| Benceno | 7cm3 |
Otro método que se puede utilizar es la inyección de agua del grifo. Esto funciona en muchos lepidópteros. Con una aguja de calibre 20-25, inyecte agua en el tórax bajo el ala hasta que esté completamente lleno. Después de 5-20 minutos, el insecto debería estar relajado.
Conservación en líquido: Esto se puede utilizar en muchos insectos de cuerpo blando (como las moscas de mayo, las moscas de piedra, las moscas de cadera, etc.), que no se pueden fijar a menos que se sequen como se ha mencionado anteriormente. También es útil para especímenes muy pequeños que van a ser estudiados en portaobjetos de microscopio, y para larvas y ninfas de insectos. Los artrópodos que no son insectos deben conservarse también de esta manera.
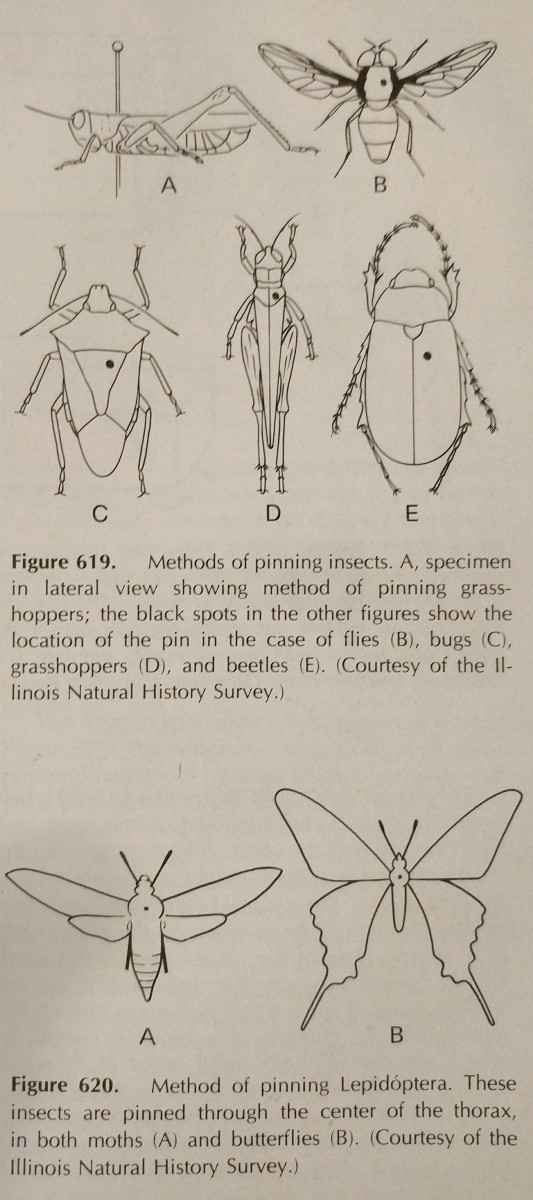
Pinchar: Esta es la forma más fácil de conservar un insecto de cuerpo duro. Los colores a menudo se desvanecen cuando el insecto se seca, sin embargo esto es difícil de evitar. Se deben utilizar alfileres especiales para insectos, que son más largos y no se oxidan. Están disponibles en los tamaños 00-7, aunque los más pequeños pueden ser menos aplicables. Se deben colocar alfileres en diferentes zonas, como se muestra en la imagen. Las patas deben estar extendidas, así como las alas. A menudo las abejas tienen la lengua extendida para facilitar la identificación.
Es mejor si todas las especies de una colección se clavan a distancias uniformes. Lo ideal son unos 25 mm por encima de la punta, y las distancias uniformes se pueden conseguir fácilmente utilizando un bloque de clavado, que es simplemente un bloque de madera con agujeros perforados a diferentes profundidades.
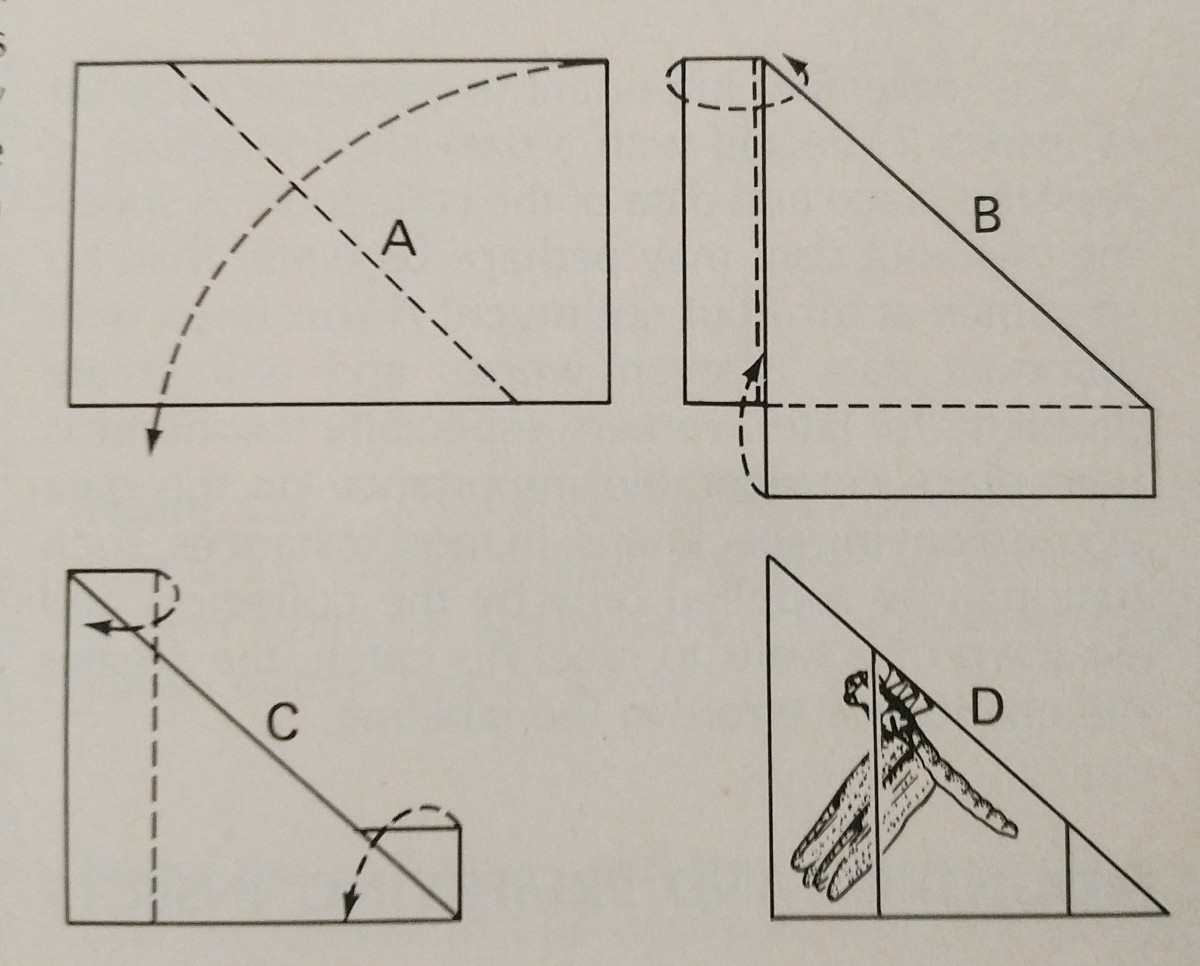
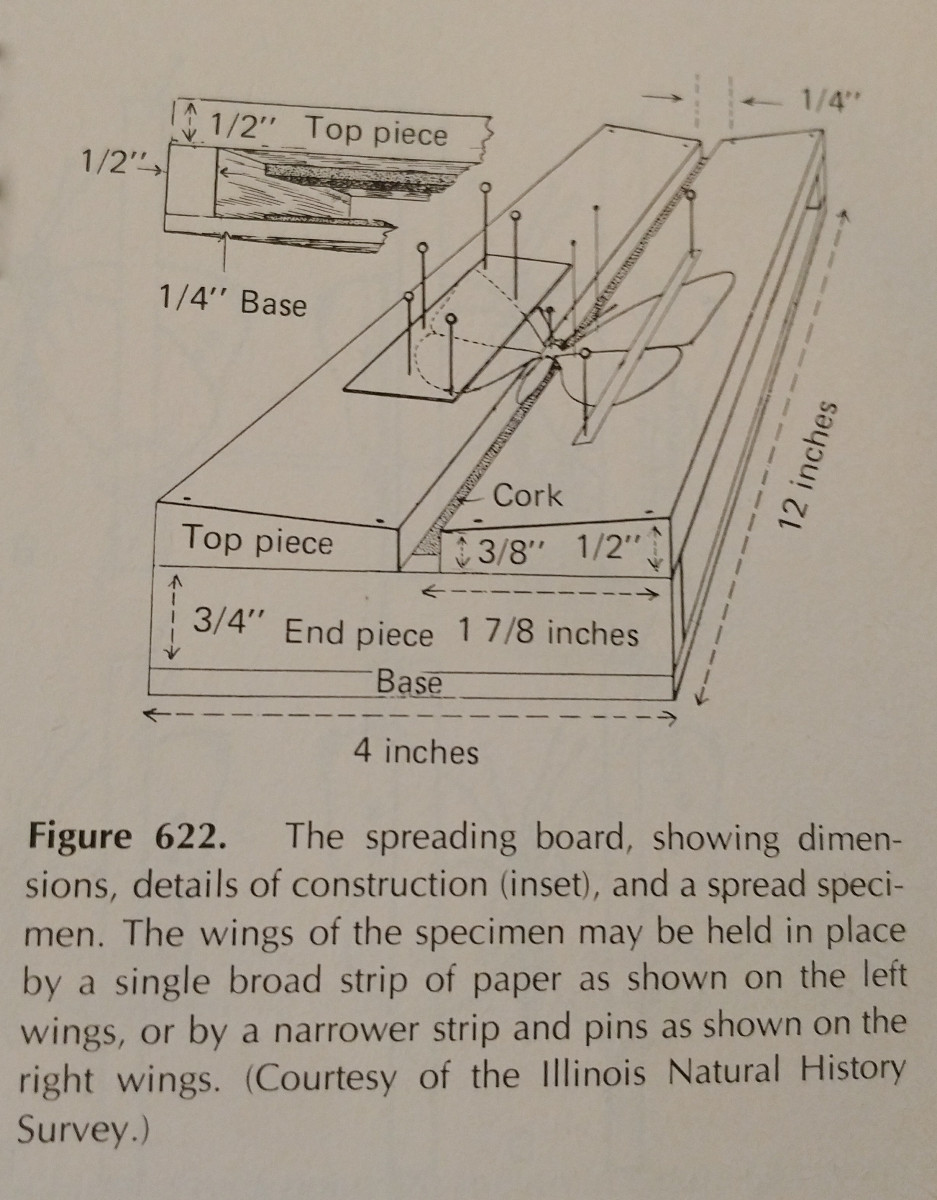
La propagación de un insecto tiene mucho que ver con la práctica. El uso de una tabla de esparcimiento facilita mucho la tarea,
y tener alfileres y tiras de papel adicionales es esencial. Los alfileres pueden utilizarse para desplazar las extremidades y las alas.
Típicamente, la presión debe aplicarse a la vena marginal delantera del ala, especialmente en los lepidópteros. El margen posterior de las alas de un lepidóptero debe estar en ángulo recto con su tórax, y las alas traseras hacia arriba para que no haya un hueco entre ellas y las alas delanteras, como en la imagen. Es  importante tener mucho cuidado y utilizar pinzas para manipular los insectos. Son muy frágiles, y a menudo las escamas y la antena pueden desprenderse fácilmente. Se pueden utilizar tiras de papel y alfileres para asegurar las alas, y luego se mantendrán en su posición después de que se sequen.
importante tener mucho cuidado y utilizar pinzas para manipular los insectos. Son muy frágiles, y a menudo las escamas y la antena pueden desprenderse fácilmente. Se pueden utilizar tiras de papel y alfileres para asegurar las alas, y luego se mantendrán en su posición después de que se sequen.
Los insectos pequeños necesitan algo de ingenio para ser montados, y se pueden pegar en puntas de tarjetas, alfileres diminutos o portaobjetos microscópicos. Basta con clavar la punta de la tarjeta, poner una pequeña cantidad de pegamento en ella y luego pegar el insecto.
Secado: Muchos insectos pegados con alfileres pueden secarse al aire en un lugar cálido y seco. Las polillas más grandes pueden necesitar una cámara de secado con uno o varios focos de luz en su interior, y algunos especímenes grandes pueden incluso necesitar que se les extraigan los órganos del abdomen. No hay un tiempo definitivo para que un espécimen se seque, sin embargo esto vendrá con la experiencia.
Los insectos de cuerpo blando pueden ser liofilizados o secados al vacío y luego fijados con alfileres, para crear un espécimen no frágil y no descolorido. Normalmente se arrugan, pero este paso hace que se sequen lo suficiente como para permanecer en un alfiler.
Típicamente se utiliza una solución de alcohol etílico. A continuación se enumeran algunas de las más comunes.
| Solución de Hood | |
| 70-Alcohol etílico al 80% | 95 cm3 |
| Glicerina | 5 cm3 |
| Solución de Kahle | |
| 95%. Alcohol etílico | 30 cm3 |
| Formaldehído | 12 cm3 |
| Ácido acético glacial | 4 cm3 |
| Agua | 60 cm3 |
| Solución alcohólica de Bouin | |
| Alcohol etílico al 80% | 150 cm3 |
| Formaldehído | 60 cm3 |
| Ácido acético glacial | 15 cm3 |
| Ácido pítrico | 1g |
Mientras estamos en el tema de las soluciones, El acetato de etilo a menudo puede ser ineficaz en las larvas, así que aquí están los agentes de matar que son suficientes:
| Mezcla de KAD | |
| 95% de alcohol etílico | 70-100 cm3 |
| Keroseno (reducir para larvas de cuerpo blando como los gusanos) | 10 cm3 |
| Ácido acético glacial | 20 cm3 |
| Dioxano | 10 cm3 |
| Mezcla de XA | |
| 95% Acetato de Etilo | 50 cm3 |
| Xileno | 50 cm3 |
Ambos métodos deberían durar entre 1/2 y 4 horas. Todos los agentes mortíferos conocidos eliminan el color, especialmente los verdes, los permitidos y los rojos.
Típicamente, los especímenes conservados deben inspeccionarse una o dos veces al año, por si se ha evaporado algún líquido. Si es así, debe sustituirse.
Montaje en portaobjetos de microscopio: Existen dos tipos de montajes para microscopios: los permanentes y los temporales. Utilizan diferentes medios de montaje, y los montajes temporales suelen devolver sus especímenes al conservador después del montaje, donde pueden conservarse indefinidamente. Los montajes permanentes se montan una vez y luego no se pueden quitar, sin embargo pueden durar bastante tiempo, incluso varios años.
Muchos insectos de cuerpo blando se pueden poner directamente en el medio de montaje, sin embargo algunos necesitan ser aclarados en un líquido especial primero. Las principales soluciones utilizadas para ello son el KOH y la solución de Nesbitt. Este proceso suele implicar el remojo del insecto durante varias horas o muchos días cuando se hace en frío, aunque puede hacerse más rápidamente utilizando calor y KOH.
Los especímenes pequeños pueden montarse en un portaobjetos normal, mientras que los más grandes pueden necesitar un portaobjetos en depresión o un soporte para el cubreobjetos.
Los medios utilizados para los montajes temporales en portaobjetos incluyen agua, alcohol, glicerina y gelatina de glicerina. El agua y el alcohol pueden durar sólo unos minutos antes de evaporarse, por lo que la glicerina se utiliza generalmente si los especímenes quieren ser estudiados durante un período de tiempo prolongado.
Con esto concluye esta entrada, y la sección de conservación de Borror, Delong y Triplehorn. La mayor parte del resto del trabajo en este SOS será la compilación de mis documentos, y diapositivas, así como asegurarse de que mis diagramas de flujo y el protocolo están todos en orden.
