CÍLE UČENÍ
- Popsat energetiku kovalentní a iontové vazby. vzniku a rozpadu
- Použijte průměrné energie kovalentních vazeb k odhadu entalpií reakcí
Síla vazby popisuje, jak silně je každý atom spojen s jiným atomem, a tedy kolik energie je třeba k přerušení vazby mezi dvěma atomy.
Je nutné si uvědomit, že k přerušení chemické vazby je třeba dodat energii (endotermický proces), zatímco při vytváření chemické vazby se energie uvolňuje (exotermický proces). V případě ![]() je kovalentní vazba velmi silná; k přerušení vazeb v jednom molu molekul vodíku a k oddělení atomů je třeba dodat velké množství energie, 436 kJ:
je kovalentní vazba velmi silná; k přerušení vazeb v jednom molu molekul vodíku a k oddělení atomů je třeba dodat velké množství energie, 436 kJ:
![]()
Naopak stejné množství energie se uvolní, když ze dvou molekul atomů H vznikne jeden mol ![]() :
:
![]()
Síla vazby: Kovalentní vazby
Stabilní molekuly existují, protože kovalentní vazby drží atomy pohromadě. Pevnost kovalentní vazby měříme energií potřebnou k jejímu přerušení, tj. energií nutnou k oddělení vázaných atomů. Oddělení jakékoli dvojice vázaných atomů vyžaduje energii. Čím silnější je vazba, tím větší je energie potřebná k jejímu přerušení.
Energie potřebná k přerušení určité kovalentní vazby v jednom molu plynných molekul se nazývá vazebná energie nebo energie disociace vazby. Energie vazby pro dvouatomovou molekulu je ![]() , je definována jako standardní změna entalpie pro endotermickou reakci:
, je definována jako standardní změna entalpie pro endotermickou reakci:
![]()
Například vazebná energie čisté kovalentní vazby H-H, ![]() , je 436 kJ na mol porušené vazby H-H:
, je 436 kJ na mol porušené vazby H-H:
![]()
Molekuly se třemi nebo více atomy mají dvě nebo více vazeb. Součet všech vazebných energií v takové molekule je roven standardní změně entalpie pro endotermickou reakci, při které se přeruší všechny vazby v molekule. Například součet energií čtyř vazeb C-H v ![]() , 1660 kJ, se rovná standardní změně entalpie reakce:
, 1660 kJ, se rovná standardní změně entalpie reakce:

Průměrná energie vazby C-H, ![]() , je 1660/4 = 415 kJ/mol, protože na jeden mol reakce připadají čtyři moly porušených vazeb C-H. Ačkoli jsou čtyři vazby C-H v původní molekule ekvivalentní, nevyžadují každá z nich stejnou energii k přerušení; jakmile je přerušena první vazba (což vyžaduje 439 kJ/mol), zbývající vazby se přerušují snadněji. Hodnota 415 kJ/mol je průměrná, nikoliv přesná hodnota potřebná k přerušení kterékoliv vazby.
, je 1660/4 = 415 kJ/mol, protože na jeden mol reakce připadají čtyři moly porušených vazeb C-H. Ačkoli jsou čtyři vazby C-H v původní molekule ekvivalentní, nevyžadují každá z nich stejnou energii k přerušení; jakmile je přerušena první vazba (což vyžaduje 439 kJ/mol), zbývající vazby se přerušují snadněji. Hodnota 415 kJ/mol je průměrná, nikoliv přesná hodnota potřebná k přerušení kterékoliv vazby.
Síla vazby mezi dvěma atomy roste s rostoucím počtem elektronových párů ve vazbě. Obecně platí, že s rostoucí pevností vazby klesá její délka. Zjistíme tedy, že trojné vazby jsou silnější a kratší než dvojné vazby mezi stejnými dvěma atomy; podobně dvojné vazby jsou silnější a kratší než jednoduché vazby mezi stejnými dvěma atomy. Průměrné vazebné energie pro některé běžné vazby jsou uvedeny v následující tabulce a srovnání vazebných délek a vazebných sil pro některé běžné vazby je uvedeno v následující tabulce. Když se jeden atom váže s různými atomy ve skupině, síla vazby obvykle klesá s tím, jak postupujeme po skupině dolů. Například ![]() je 439 kJ/mol,
je 439 kJ/mol, ![]() je 330 kJ/mol a
je 330 kJ/mol a ![]() je 275 kJ/mol.
je 275 kJ/mol.
| Vazbové energie (kJ/mol) | |||||||
|---|---|---|---|---|---|---|---|
| Vazba | Vazbová energie | Vazba | Vazbová energie | Vazba | Vazbová energie | ||
| 436 | 260 | 255 | |||||
| 415 | 330 | 235 | |||||
| 390 | 275 | 230 | |||||
| 464 | 240 | 215 | |||||
| 569 | 160 | 225 | |||||
| 395 | 418 | 359 | |||||
| 320 | 946 | 290 | |||||
| 340 | 200 | 215 | |||||
| 432 | 270 | 215 | |||||
| 370 | 210 | 230 | |||||
| 295 | 200 | 330 | |||||
| 345 | 245 | 270 | |||||
| 611 | 140 | 215 | |||||
| 837 | 498 | 215 | |||||
| \text{C-N} | 290 | 160 | 250 | ||||
| 615 | 370 | 215 | |||||
| 891 | 350 | 243 | |||||
| \text{C-O} | 350 | 205 | 220 | ||||
| 741 | 200 | 210 | |||||
| 1080 | 160 | 190 | |||||
| 439 | 540 | 180 | |||||
| 360 | 489 | 150 | |||||
| 265 | 285 | ||||||
| Průměrné délky vazeb a vazebné energie pro některé běžné vazby | ||
|---|---|---|
| Vazba | Délka vazby (Å) | Vazbová energie (kJ/mol) |
| 1,54 | 345 | |
| 1,34 | 611 | |
| 1,20 | 837 | |
| \text{C-N} | 1,43 | 290 |
| 1,38 | 615 | |
| 1,16 | 891 | |
| \text{C-O} | 1,43 | 350 |
| 1,23 | 741 | |
| 1,13 | 1080 | |
Vazbová energie je rozdíl mezi energetickým minimem (které nastává ve vzdálenosti vazby) a energií dvou oddělených atomů. Jedná se o množství energie uvolněné při vzniku vazby. Stejné množství energie je naopak zapotřebí k přerušení vazby. Pro molekulu ![]() uvedenou v tabulce výše platí, že ve vazebné vzdálenosti 74 pm má systém o 7,24 × 10-19 J nižší energii než dva oddělené atomy vodíku. To se může zdát jako malé číslo. Jak se však podrobněji dozvíme později, o vazebných energiích se často hovoří v přepočtu na jednotlivé molekuly. Například k přerušení jedné vazby H-H je třeba 7,24 × 10-19 J, ale k přerušení 1 molu vazby H-H je třeba 4,36 × 105 J. Srovnání délek a energií některých vazeb je uvedeno v tabulkách výše. Mnoho těchto vazeb můžeme najít v různých molekulách a tato tabulka uvádí průměrné hodnoty. Například k přerušení první vazby C-H v
uvedenou v tabulce výše platí, že ve vazebné vzdálenosti 74 pm má systém o 7,24 × 10-19 J nižší energii než dva oddělené atomy vodíku. To se může zdát jako malé číslo. Jak se však podrobněji dozvíme později, o vazebných energiích se často hovoří v přepočtu na jednotlivé molekuly. Například k přerušení jedné vazby H-H je třeba 7,24 × 10-19 J, ale k přerušení 1 molu vazby H-H je třeba 4,36 × 105 J. Srovnání délek a energií některých vazeb je uvedeno v tabulkách výše. Mnoho těchto vazeb můžeme najít v různých molekulách a tato tabulka uvádí průměrné hodnoty. Například k přerušení první vazby C-H v ![]() je zapotřebí 439,3 kJ/mol, zatímco k přerušení první vazby C-H v
je zapotřebí 439,3 kJ/mol, zatímco k přerušení první vazby C-H v ![]() (běžné ředidlo) je zapotřebí 375 kJ/mol.5 kJ/mol.
(běžné ředidlo) je zapotřebí 375 kJ/mol.5 kJ/mol.
Jak je vidět z výše uvedených tabulek, průměrná pevnost jednoduché vazby uhlík-uhlík je 347 kJ/mol, zatímco ve dvojné vazbě uhlík-uhlík ![]() se pevnost vazby zvýší o 267 kJ/mol. Přidání další vazby
se pevnost vazby zvýší o 267 kJ/mol. Přidání další vazby ![]() způsobí další zvýšení o 225 kJ/mol. Podobný průběh můžeme pozorovat při porovnání dalších vazeb
způsobí další zvýšení o 225 kJ/mol. Podobný průběh můžeme pozorovat při porovnání dalších vazeb ![]() a
a ![]() . Každá jednotlivá vazba
. Každá jednotlivá vazba ![]() je tedy obecně slabší než odpovídající vazba
je tedy obecně slabší než odpovídající vazba ![]() mezi stejnými dvěma atomy. Ve vazbě
mezi stejnými dvěma atomy. Ve vazbě ![]() dochází k většímu překryvu orbitalů než ve vazbě
dochází k většímu překryvu orbitalů než ve vazbě ![]() .
.
Vazbové energie můžeme použít k výpočtu přibližných změn entalpií u reakcí, kde nejsou k dispozici entalpie vzniku. Výpočty tohoto typu nám také řeknou, zda je reakce exotermická nebo endotermická. Exotermická reakce (ΔH je záporné, vzniká teplo) nastává, když jsou vazby v produktech silnější než vazby v reaktantech. Endotermická reakce (ΔH kladné, teplo absorbované) nastává, když jsou vazby v produktech slabší než vazby v reaktantech.
Změna entalpie, ΔH, pro chemickou reakci je přibližně rovna součtu energie potřebné k přerušení všech vazeb v reaktantech (energie „dovnitř“, kladné znaménko) plus energie uvolněné při vzniku všech vazeb v produktech (energie „ven“, záporné znaménko). Matematicky to lze vyjádřit takto:
![]()
V tomto výrazu symbol ![]() znamená „součet“ a D představuje vazebnou energii v kilojoulech na mol, což je vždy kladné číslo. Vazbová energie se získá z tabulky a bude záviset na tom, zda je daná vazba jednoduchá, dvojná nebo trojná. Při výpočtu entalpie tímto způsobem je tedy důležité, abychom zohlednili vazbu ve všech reaktantech a produktech. Protože hodnoty D jsou obvykle průměrné hodnoty pro jeden typ vazby v mnoha různých molekulách, poskytuje tento výpočet hrubý odhad, nikoliv přesnou hodnotu entalpie reakce.
znamená „součet“ a D představuje vazebnou energii v kilojoulech na mol, což je vždy kladné číslo. Vazbová energie se získá z tabulky a bude záviset na tom, zda je daná vazba jednoduchá, dvojná nebo trojná. Při výpočtu entalpie tímto způsobem je tedy důležité, abychom zohlednili vazbu ve všech reaktantech a produktech. Protože hodnoty D jsou obvykle průměrné hodnoty pro jeden typ vazby v mnoha různých molekulách, poskytuje tento výpočet hrubý odhad, nikoliv přesnou hodnotu entalpie reakce.
Uvažujte o následující reakci:
![]()
nebo
![]()
Pro vytvoření dvou molů ![]() musí být porušen jeden mol vazeb H-H a jeden mol vazeb Cl-Cl. Energie potřebná k přerušení těchto vazeb je součtem vazebné energie vazby H-H (436 kJ/mol) a vazby Cl-Cl (243 kJ/mol). Během reakce se vytvoří dva moly vazeb H-Cl (vazebná energie = 432 kJ/mol), čímž se uvolní 2 × 432 kJ; neboli 864 kJ. Protože vazby v produktech jsou silnější než vazby v reaktantech, reakce uvolní více energie, než spotřebuje:
musí být porušen jeden mol vazeb H-H a jeden mol vazeb Cl-Cl. Energie potřebná k přerušení těchto vazeb je součtem vazebné energie vazby H-H (436 kJ/mol) a vazby Cl-Cl (243 kJ/mol). Během reakce se vytvoří dva moly vazeb H-Cl (vazebná energie = 432 kJ/mol), čímž se uvolní 2 × 432 kJ; neboli 864 kJ. Protože vazby v produktech jsou silnější než vazby v reaktantech, reakce uvolní více energie, než spotřebuje:
Tato přebytečná energie se uvolňuje jako teplo, takže reakce je exotermická. Příloha G uvádí hodnotu standardní molární entalpie vzniku ![]() ,
, ![]() , -92,307 kJ/mol. Dvojnásobek této hodnoty je -184,6 kJ, což dobře souhlasí s odpovědí získanou dříve pro vznik dvou molů HCl.
, -92,307 kJ/mol. Dvojnásobek této hodnoty je -184,6 kJ, což dobře souhlasí s odpovědí získanou dříve pro vznik dvou molů HCl.
PŘÍKLAD
Použití vazebných energií k výpočtu přibližných změn entalpie
Methanol, ![]() , může být vynikajícím alternativním palivem. Vysokoteplotní reakcí páry a uhlíku vzniká směs plynů oxidu uhelnatého,
, může být vynikajícím alternativním palivem. Vysokoteplotní reakcí páry a uhlíku vzniká směs plynů oxidu uhelnatého, ![]() a vodíku,
a vodíku, ![]() , ze kterého lze vyrobit metanol. Na základě vazebných energií ve výše uvedených tabulkách vypočítejte přibližnou změnu entalpie, ΔH, pro tuto reakci:
, ze kterého lze vyrobit metanol. Na základě vazebných energií ve výše uvedených tabulkách vypočítejte přibližnou změnu entalpie, ΔH, pro tuto reakci:
![]()
Roztok
Nejprve musíme zapsat Lewisovy struktury reaktantů a produktů:

Z toho vidíme, že ΔH pro tuto reakci zahrnuje energii potřebnou k přerušení trojné vazby C-O a dvou jednoduchých vazeb H-H, jakož i energii vzniklou vytvořením tří jednoduchých vazeb C-H, jednoduché vazby C-O a jednoduché vazby O-H. Z toho je patrné, že ΔH pro tuto reakci zahrnuje energii potřebnou k přerušení trojné vazby C-O a dvou jednoduchých vazeb H-H. To můžeme vyjádřit takto:
Podle hodnot vazebné energie v tabulce, získáme:
Tuto hodnotu můžeme porovnat s hodnotou vypočtenou na základě ![]() údajů z přílohy G:
údajů z přílohy G:
Všimněte si, že mezi hodnotami vypočtenými pomocí dvou různých metod je poměrně značný rozdíl. K tomu dochází proto, že hodnoty D jsou průměrem různých vazebných sil, a proto často poskytují pouze hrubou shodu s jinými údaji.
Zkontrolujte si své znalosti
Etylalkohol, ![]() , byl jednou z prvních organických chemických látek záměrně syntetizovaných člověkem. Má mnoho využití v průmyslu a je to alkohol obsažený v alkoholických nápojích. Lze jej získat kvašením cukru nebo syntetizovat hydratací ethylenu v následující reakci:
, byl jednou z prvních organických chemických látek záměrně syntetizovaných člověkem. Má mnoho využití v průmyslu a je to alkohol obsažený v alkoholických nápojích. Lze jej získat kvašením cukru nebo syntetizovat hydratací ethylenu v následující reakci:

Pomocí vazebných energií v tabulce vypočítejte přibližnou změnu entalpie, ΔH, pro tuto reakci.
-35 kJ
Síla iontové vazby a mřížková energie
Iontová sloučenina je stabilní díky elektrostatické přitažlivosti mezi jejími kladnými a zápornými ionty. Mřížková energie sloučeniny je mírou síly této přitažlivosti. Mřížková energie (ΔHlattice) iontové sloučeniny je definována jako energie potřebná k rozdělení jednoho molu pevné látky na její plynné ionty. Pro iontovou pevnou látku MX je mřížková energie změnou entalpie procesu:
![]()
Všimněte si, že používáme konvenci, kdy je iontová pevná látka rozdělena na ionty, takže naše mřížkové energie budou endotermické (kladné hodnoty). Některé texty používají ekvivalentní, ale opačnou konvenci a definují mřížkovou energii jako energii uvolněnou při spojení oddělených iontů do mřížky a uvádějí záporné (exotermické) hodnoty. Pokud tedy hledáte mřížkové energie v jiném odkazu, určitě si ověřte, která definice je použita. V obou případech platí, že větší hodnota mřížkové energie znamená stabilnější iontovou sloučeninu. Pro chlorid sodný je ![]() . K oddělení jednoho molu pevné látky
. K oddělení jednoho molu pevné látky ![]() na plynné
na plynné ![]() a
a ![]() ionty. Když po jednom molu plynných
ionty. Když po jednom molu plynných ![]() a
a ![]() iontů vytvoří pevné
iontů vytvoří pevné ![]() , uvolní se 769 kJ tepla.
, uvolní se 769 kJ tepla.
Energie mřížky ![]() iontového krystalu lze vyjádřit následující rovnicí (odvozenou z Coulombova zákona, kterým se řídí síly mezi elektrickými náboji):
iontového krystalu lze vyjádřit následující rovnicí (odvozenou z Coulombova zákona, kterým se řídí síly mezi elektrickými náboji):
![]()
v níž C je konstanta, která závisí na typu krystalové struktury; Z+ a Z- jsou náboje iontů; a Ro je interiontová vzdálenost (součet poloměrů kladných a záporných iontů). Mřížková energie iontového krystalu tedy rychle roste s tím, jak rostou náboje iontů a zmenšují se rozměry iontů. Pokud jsou všechny ostatní parametry konstantní, zdvojnásobením náboje kationtu i aniontu se mřížková energie zečtyřnásobí. Například mřížková energie ![]() (Z+ a Z- = 1) je 1023 kJ/mol, zatímco energie
(Z+ a Z- = 1) je 1023 kJ/mol, zatímco energie ![]() (Z+ a Z- = 2) je 3900 kJ/mol (Ro je téměř stejná – asi 200 pm pro obě sloučeniny).
(Z+ a Z- = 2) je 3900 kJ/mol (Ro je téměř stejná – asi 200 pm pro obě sloučeniny).
Různé meziatomové vzdálenosti způsobují různé mřížkové energie. Například můžeme porovnat mřížkovou energii ![]() (2957 kJ/mol) s energií
(2957 kJ/mol) s energií ![]() (2327 kJ/mol), abychom pozorovali vliv menší iontové velikosti F- ve srovnání s I- na mřížkovou energii.
(2327 kJ/mol), abychom pozorovali vliv menší iontové velikosti F- ve srovnání s I- na mřížkovou energii.
PŘÍKLAD
Srovnání mřížkové energie
Drahý drahokam rubín je oxid hlinitý, ![]() , obsahující stopy
, obsahující stopy ![]() . Sloučenina
. Sloučenina ![]() se používá při výrobě některých polovodičových zařízení. Která má větší mřížkovou energii,
se používá při výrobě některých polovodičových zařízení. Která má větší mřížkovou energii, ![]() nebo
nebo ![]() ?
?
Řešení
V těchto dvou iontových sloučeninách jsou náboje Z+ a Z- stejné, takže rozdíl v mřížkové energii bude záviset na Ro. ![]() je menší než
je menší než ![]() iont. Proto by
iont. Proto by ![]() měl kratší interiontovou vzdálenost než
měl kratší interiontovou vzdálenost než ![]() a
a ![]() by měl větší mřížkovou energii.
by měl větší mřížkovou energii.
Ověřte si své znalosti
Koxid zinečnatý, ![]() , je velmi účinným ochranným prostředkem proti slunečnímu záření. Jak by se projevila mřížková energie
, je velmi účinným ochranným prostředkem proti slunečnímu záření. Jak by se projevila mřížková energie ![]() ve srovnání s energií
ve srovnání s energií ![]() ?
?
KLÍČOVÉ ÚDAJE
Síla kovalentní vazby se měří její disociační energií, tj. množstvím energie potřebným k přerušení dané vazby v jednom molu molekul. Vícenásobné vazby jsou silnější než jednoduché vazby mezi stejnými atomy. Entalpii reakce lze odhadnout na základě energie potřebné k přerušení vazeb a energie uvolněné při vzniku nových vazeb. U iontových vazeb je mřížková energie energie potřebná k rozdělení jednoho molu sloučeniny na ionty v plynné fázi. Mřížková energie se zvyšuje u iontů s vyššími náboji a kratšími vzdálenostmi mezi ionty.
- Mřížková energie pro dvouatomovou molekulu:
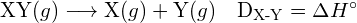
- Změna entalpie:

- Mřížková energie pro pevnou látku MX:
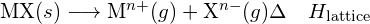
- Mřížková energie pro iontový krystal:
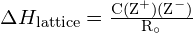
KONEC KAPITOLY CVIČENÍ
- Která z následujících dvojic vazeb je nejsilnější? (a)
 nebo
nebo 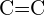 b) \text{C-N} nebo
b) \text{C-N} nebo 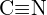 c)
c) 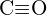 nebo
nebo 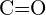 d)
d) 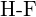 nebo
nebo 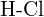 e)
e) 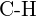 nebo
nebo 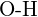 f) \text{C-N} nebo \text{C-O} nebo \text{C-O}.
f) \text{C-N} nebo \text{C-O} nebo \text{C-O}. - Pomocí vazebných energií v tabulce určete přibližnou změnu entalpie pro každou z následujících reakcí: (a)
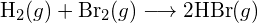 b)
b) 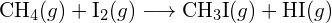 (c)
(c) 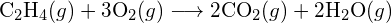 (a) -114 kJ; (b) 30 kJ; (c) -1055 kJ
(a) -114 kJ; (b) 30 kJ; (c) -1055 kJ - Podle vazebných energií v tabulce určete přibližnou změnu entalpie pro každou z následujících reakcí: (a)
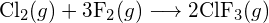 b)
b) 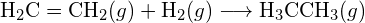 c)
c) 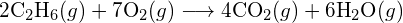
- Nakreslete křivku, která popisuje energii systému s různě vzdálenými atomy H a Cl. Poté najděte minimální energii této křivky dvěma způsoby. a) Pomocí vazebné energie nalezené v tabulkách vypočítejte energii pro jeden
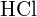 vazby (Nápověda: Kolik vazeb je v jednom molu?)(b) Použijte entalpii reakce a vazebné energie pro H2 a Cl2 k řešení energie jednoho molu
vazby (Nápověda: Kolik vazeb je v jednom molu?)(b) Použijte entalpii reakce a vazebné energie pro H2 a Cl2 k řešení energie jednoho molu 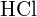 vazby.
vazby.
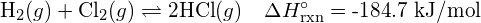
Vysvětlete, proč se vazby vyskytují ve specifických průměrných vazebných vzdálenostech, místo aby se atomy k sobě přibližovaly nekonečně blízko.
Specifická průměrná vazebná vzdálenost je vzdálenost s nejnižší energií. Při vzdálenostech menších, než je vazebná vzdálenost, se kladné náboje na obou jádrech vzájemně odpuzují a celková energie se zvyšuje. - Když molekula může tvořit dvě různé struktury, struktura se silnějšími vazbami je obvykle stabilnější formou. Pomocí vazebných energií předpovězte správnou strukturu molekuly hydroxylaminu:
 Větší vazebná energie je na obrázku vlevo. Je to stabilnější forma.
Větší vazebná energie je na obrázku vlevo. Je to stabilnější forma. - Jakou vazebnou energii má
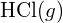 liší od standardní entalpie vzniku
liší od standardní entalpie vzniku 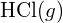 ?
? - Na základě údajů o standardní entalpii vzniku v příloze G ukažte, jak se projeví standardní entalpie vzniku
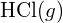 lze použít k určení vazebné energie.
lze použít k určení vazebné energie.
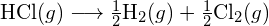
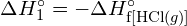
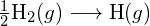
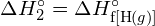
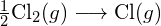
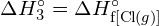
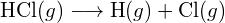
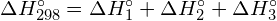
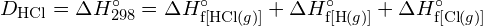
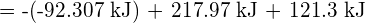
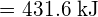
- Vypočítejte vazebnou energii dvojné vazby uhlíku a síry v
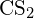 s použitím údajů o standardní entalpii vzniku v příloze G.
s použitím údajů o standardní entalpii vzniku v příloze G. - Na základě údajů o standardní entalpii vzniku v příloze G určete, která vazba je silnější: vazba S-F v
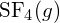 nebo v
nebo v 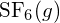 ?
Vazba S-F v
?
Vazba S-F v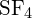 je silnější.
je silnější. - Podle údajů o standardní entalpii vzniku v příloze G určete, která vazba je silnější: vazba P-Cl v
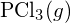 nebo v
nebo v 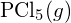 ?
? - Doplňte následující Lewisovu strukturu doplněním vazeb (nikoli atomů) a poté uveďte nejdelší vazbu:

 Jednoduché vazby C-C jsou nejdelší.
Jednoduché vazby C-C jsou nejdelší. - Pomocí vazebné energie vypočítejte přibližnou hodnotu ΔH pro následující reakci. Která forma
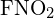 je stabilnější?
je stabilnější?
- Pomocí principů atomové struktury odpovězte na každou z následujících otázek:1 (a) Poloměr atomu Ca je 197 pm; poloměr
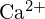 iontu je 99 pm. Vysvětlete tento rozdíl. (b) Mřížková energie
iontu je 99 pm. Vysvětlete tento rozdíl. (b) Mřížková energie 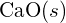 je -3460 kJ/mol; mřížková energie \text{K}_2\text{O} je -3460 kJ/mol; mřížková energie \text{K}_2\text{O}. je -2240 kJ/mol. Vysvětlete rozdíl. (c) Vzhledem k těmto hodnotám ionizace vysvětlete rozdíl mezi Ca a K s ohledem na jejich první a druhou ionizační energii.
je -3460 kJ/mol; mřížková energie \text{K}_2\text{O} je -3460 kJ/mol; mřížková energie \text{K}_2\text{O}. je -2240 kJ/mol. Vysvětlete rozdíl. (c) Vzhledem k těmto hodnotám ionizace vysvětlete rozdíl mezi Ca a K s ohledem na jejich první a druhou ionizační energii.
Prvek První ionizační energie (kJ/mol) Druhá ionizační energie (kJ/mol) K 419 3050 Ca 590 1140 (d) První ionizační energie Mg je 738 kJ/mol a energie Al je 578 kJ/mol. Vysvětlete tento rozdíl.
(a) Při odebrání dvou elektronů z valenční slupky ztrácí Ca poloměr nejvzdálenější energetické hladiny a vrací se na nižší hladinu n = 3, která má mnohem menší poloměr. b) Náboj +2 na vápníku přitahuje kyslík mnohem blíže ve srovnání s K, čímž se zvyšuje mřížková energie oproti méně nabitému iontu.
(c) Odstranění elektronu 4s u Ca vyžaduje více energie než odstranění elektronu 4s u K kvůli silnější přitažlivosti jádra a dodatečné energii potřebné k přerušení párování elektronů. Druhá ionizační energie pro K vyžaduje, aby byl elektron odstraněn z nižší energetické hladiny, kde je přitažlivost jádra pro elektron mnohem silnější. Kromě toho je zapotřebí energie k odpárování dvou elektronů v plném orbitalu. Pro Ca vyžaduje druhý ionizační potenciál odstranění pouze osamělého elektronu v exponované vnější energetické hladině.
(d) U Al je odstraněný elektron relativně nechráněný a nespárovaný v p orbitalu. Vyšší energie u Mg odráží především nespárovanost elektronu 2s.
- U které z následujících látek je k přeměně jednoho molu pevné látky na samostatné ionty zapotřebí nejméně energie? (a)
 (b)
(b) 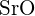 c)
c) 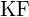 (d)
(d) 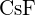 e)
e) 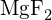 (d)
(d) - Reakce kovu,
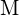 s halogenem,
s halogenem, 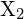 , probíhá exotermickou reakcí podle této rovnice:
, probíhá exotermickou reakcí podle této rovnice: 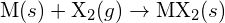 . U každé z následujících možností uveďte, která z nich způsobí, že reakce bude exotermičtější. Vysvětlete své odpovědi. (a) velký poloměr vs. malý poloměr pro
. U každé z následujících možností uveďte, která z nich způsobí, že reakce bude exotermičtější. Vysvětlete své odpovědi. (a) velký poloměr vs. malý poloměr pro 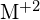 (b) vysoká ionizační energie vs. nízká ionizační energie pro
(b) vysoká ionizační energie vs. nízká ionizační energie pro 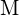 c) rostoucí vazebná energie pro halogen d) klesající elektronová afinita k halogenu e) rostoucí velikost aniontu tvořeného halogenem
c) rostoucí vazebná energie pro halogen d) klesající elektronová afinita k halogenu e) rostoucí velikost aniontu tvořeného halogenem - Mřížková energie
 je 1023 kJ/mol a vzdálenost Li-F je 201 pm.
je 1023 kJ/mol a vzdálenost Li-F je 201 pm.  krystalizuje ve stejné struktuře jako
krystalizuje ve stejné struktuře jako  , ale se vzdáleností Mg-O 205 pm. Která z následujících hodnot se nejvíce blíží mřížkové energii
, ale se vzdáleností Mg-O 205 pm. Která z následujících hodnot se nejvíce blíží mřížkové energii  : 256 kJ/mol, 512 kJ/mol, 1023 kJ/mol, 2046 kJ/mol nebo 4008 kJ/mol? Vysvětlete svou volbu.
4008 kJ/mol; oba ionty v
: 256 kJ/mol, 512 kJ/mol, 1023 kJ/mol, 2046 kJ/mol nebo 4008 kJ/mol? Vysvětlete svou volbu.
4008 kJ/mol; oba ionty v mají dvojnásobný náboj než ionty v
mají dvojnásobný náboj než ionty v  ; délka vazby je velmi podobná a obě mají stejnou strukturu; na základě rovnice pro mřížkovou energii se očekává čtyřnásobné zvýšení energie
; délka vazby je velmi podobná a obě mají stejnou strukturu; na základě rovnice pro mřížkovou energii se očekává čtyřnásobné zvýšení energie - Která sloučenina v každé z následujících dvojic má větší mřížkovou energii? Poznámka:
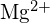 a
a 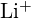 mají podobné poloměry;
mají podobné poloměry; 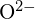 a
a 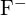 mají podobné poloměry. Vysvětlete svou volbu. (a)
mají podobné poloměry. Vysvětlete svou volbu. (a)  nebo
nebo 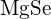 b)
b)  nebo
nebo  c)
c) 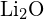 nebo
nebo 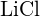 d)
d) 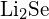 nebo
nebo 
- Která sloučenina v každé z následujících dvojic má větší mřížkovou energii? Poznámka:
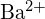 a
a 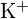 mají podobné poloměry;
mají podobné poloměry; 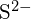 a
a 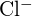 mají podobné poloměry. Vysvětlete svou volbu. (a) \text{K}_2\text{O} nebo
mají podobné poloměry. Vysvětlete svou volbu. (a) \text{K}_2\text{O} nebo 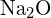 b)
b) 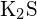 nebo
nebo  c)
c) 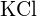 nebo
nebo  d)
d)  nebo
nebo 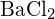 (a)
(a)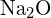 ;
; 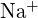 má menší poloměr než
má menší poloměr než 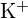 ; b)
; b)  ;
; 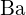 má větší náboj než
má větší náboj než  ; c)
; c)  ;
; 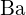 a
a 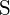 mají větší náboje; d)
mají větší náboje; d)  ;
; 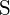 má větší náboj
má větší náboj - Která z následujících sloučenin vyžaduje nejvíce energie k přeměně jednoho molu pevné látky na samostatné ionty? (a)
 (b)
(b) 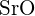 c)
c) 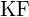 (d)
(d) 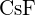 (e)
(e) 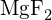
- Která z následujících sloučenin vyžaduje nejvíce energie k přeměně jednoho molu pevné látky na samostatné ionty? (a)
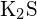 b) \text{K}_2\text{O} c)
b) \text{K}_2\text{O} c) 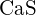 d)
d) 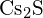 e)
e) 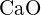 (e)
(e)
Poznámky
- 1 Tato otázka je převzata ze zkoušky Chemistry Advanced Placement Examination a je použita se souhlasem Educational Testing Service.
Slovníček
energie vazby (též, vazebná disociační energie) energie potřebná k přerušení kovalentní vazby v plynné látce mřížková energie (ΔHmřížková energie) energie potřebná k rozdělení jednoho molu iontové pevné látky na její složku plynné ionty
energie potřebná k oddělení jednoho molu iontové pevné látky na její složku plynné ionty
I
.
