Běžně používaná dlouhá forma periodické tabulky je navržena tak, aby zdůrazňovala elektronové konfigurace. Protože jsou to právě vnější (valenční) elektrony, které se primárně podílejí na chemických interakcích mezi atomy, je pro chemika mnohem zajímavější poslední elektron přidaný k atomu v procesu sestavování než první. Tento poslední elektron se nazývá rozlišovací elektron, protože odlišuje atom od atomu, který mu v periodické tabulce bezprostředně předchází. Typ podpouzdra (s, p, d, f), do kterého je rozlišovací elektron umístěn, velmi úzce souvisí s chemickým chováním prvku a vede ke klasifikaci znázorněné barevným kódováním v periodické tabulce, které vidíte zde. Reprezentativní prvky jsou ty, v nichž rozlišovací elektron vstupuje do ans nebo p podpouzdra. Do této kategorie spadá většina prvků, jejichž chemii a valenci jsme dosud probírali. Mnoho chemických vlastností reprezentativních prvků lze vysvětlit na základě Lewisových diagramů. To znamená, že valence reprezentativních prvků lze předpovědět na základě počtu valenčních elektronů, které mají, nebo z počtu elektronů, které by bylo třeba přidat, aby bylo dosaženo stejné elektronové konfigurace jako u atomu vzácného plynu. U reprezentativních prvků je počet valenčních elektronů stejný jako číslo periodické skupiny a počet potřebný k dosažení konfigurace dalšího vzácného plynu je 8 minus číslo skupiny. To souhlasí s valenčními pravidly odvozenými z periodické tabulky a vede ke vzorcům pro chloridy prvního tuctu prvků, které ukazují periodické změny valence.
| Prvek | Atomová hmotnost | Sloučeniny vodíku | Sloučeniny kyslíku | Sloučeniny chloru |
|---|---|---|---|---|
| Vodík | 1.01 | H2 | H2O, H2O2 | HCl |
| Helium | 4.00 | Nevzniká | Nevzniká | Nevzniká |
| Lithium | 6.94 | LiH | Li2O, Li2O2 | LiCl |
| Berylium | 9.01 | BeH2 | BeO | BeCl2 |
| Boron | 10.81 | B2H6 | B2O3 | BCl3 |
| Uhlík | 12.01 | CH4, C2H6, C3H8 | CO2, CO, C2O3 | CCl4, C2Cl6 |
| Dusík | 14.01 | NH3, N2H4, HN3 | N2O, NO, NO2, N2O5 | NCl3 |
| Kyslík | 16.00 | H2O, H2O2 | O2, O3 | <Cl2O, ClO2, Cl2O7 |
| Fluor | 19.00 | HF | OF2, O2F2 | ClF, ClF3, ClF5 |
| Neon | 20.18 | Nevzniká | Nevzniká | Nevzniká |
| Sodík | 22.99 | NaH | Na2O, Na2O2 | NaCl |
| Hořčík | 24.31 | MgH2 | MgO | MgCl2 |
První tři vodorovné řádky neboli periody v moderní periodické tabulce jsou tvořeny výhradně reprezentativními prvky. V první periodě se rozlišovací elektrony pro H a He nacházejí v 1s podslupce. Napříč druhou periodou mají Li a Be rozlišovací elektrony v 2s slupce a v atomech od B po Ne se přidávají elektrony do 2p slupky. Ve třetí periodě dochází k zaplnění 3s podpovrchu u Na a Mg, a tedy i Al, Si, P, S, Cl a Ar. Obecně platí, že v případě reprezentativních prvků bude rozlišující elektron v podpovrchu ns nebo np. Hodnotu n, hlavního kvantového čísla pro rozlišovací elektron, lze rychle určit odpočítáváním od vrcholu periodické tabulky. Například jód je reprezentativním prvkem páté periody. Rozlišující elektron tedy musí zaujímat buď 5s, nebo 5p podpouzdro. Protože se I nachází na pravé straně tabulky, je správnou volbou 5p.
Když je hlavní kvantové číslo tři nebo více, jsou možné i podpouzdra typu d. V případě, že je hlavní kvantové číslo tři nebo více, jsou možné i podpouzdra typu d. Přechodné prvky neboli přechodné kovy jsou takové prvky, jejichž rozlišovací elektron se nachází v orbitalu typu d. První příklady přechodných kovů (Sc, Ti, V, Cr, Mn, Fe, Co, Ni, Cu, Zn) se nacházejí ve čtvrté periodě, přestože rozlišovací elektron je v každém případě 3d elektron a patří do třetí slupky. Tento hiát vzniká, jak jsme již viděli, proto, že 4s má nižší energii než 3d. Orbital 4s se tedy začíná zaplňovat a začíná čtvrtá perioda dříve, než může být obsazen některý z orbitalů 3d.
Obrázek \(\PageIndex{1}\) porovnává rozložení pravděpodobnosti elektronu 4s a 3d v atomu V. Přestože oblak elektronů 4s leží v průměru dále od jádra než oblak 3d, malá část hustoty elektronů 4s se nachází velmi blízko jádra, kde je stěží chráněna před celkovým jaderným nábojem +23. Právě velmi silná přitažlivá síla této malé části celkové hustoty elektronů 4s snižuje energii elektronu 4s pod energii 3d.
_and_4s_(color)_Electron_Clouds.jpg?revision=1)
Skutečnost, že 4s elektronové mračno je rozsáhlejší než 3d, má důležitý vliv na chemii přechodných prvků. Když atom, jako je V (obrázek \(\PageIndex{1}\) ), interaguje s jiným atomem, jsou to právě 4s elektrony, které se nacházejí nejdále od jádra a které se jako první dotýkají druhého atomu. Proto jsou elektrony 4s často významnější než elektrony 3d při určování valence a vzorců sloučenin. Elektrony 3d jsou „pohřbeny“ pod povrchem atomů přechodných kovů. Přidání jednoho dalšího 3d elektronu má na jejich chemické vlastnosti podstatně menší vliv než přidání jednoho dalšího 3s nebo 3p elektronu v případě reprezentativních prvků. Proto dochází k pomalému, ale stálému přechodu vlastností od jednoho přechodného prvku k druhému. Všimněte si například, že s výjimkou Sc tvoří všechny přechodné kovy chloridy, MCl2, kde má kov valenci 2; příklady jsou TiCl2, VCl2, CrCl2 atd. To je vidět v tabulce v horní části této stránky. Valence 2 odpovídá dvěma valenčním elektronům 4s.
Každý z přechodných kovů vykazuje také jiné valence, kde je také zapojen jeden nebo více elektronů 3d. Například v některých sloučeninách má V (vanad) valenci 2 (VO, VCl2), v jiných má valenci 3 (V2O3, VCl3), v dalších má valenci 4 (VO2, VCl4) a přinejmenším v jednom případě (V2O5) má valenci 5. V některých sloučeninách má V (vanad) valenci 3 (V2O3, VCl3). Chemie přechodných kovů je díky této proměnlivé valenci složitější a je možná širší škála vzorců pro sloučeniny přechodných kovů. V některých případech se elektrony v d-podslupce chovají jako valenční elektrony, zatímco v jiných případech nikoli. Přestože elektronová mračna 3d nesahají dále od jádra než 3s a 3p (a netvoří tedy další slupku jako elektrony 4s), jsou důkladně odstíněna od jaderného náboje, a proto často působí jako valenční elektrony. Toto jekyllské a hydeovské chování 3d elektronů komplikuje život (a často činí život mnohem zajímavějším) chemikům, kteří studují přechodné prvky.
| Z | Element | Konfigurace | |
|---|---|---|---|
| 1 | H | 1s 1 | |
| 2 | He | 1s 2 | |
| 3 | Li | 2s 1 | |
| 4 | Be | 2s 2 | |
| 5 | B | 2s 2 2p1 | |
| 6 | C | 2s 2 2p2 | |
| 7 | N | 2s 2 2p3 | |
| 8 | 0 | 2s 2 2p4 | |
| 9 | F | 2s 2 2p5 | |
| 10 | Ne | 2s 2 2p6 | |
| 11 | Na | 3s 1 | |
| 12 | Mg | 3s 2 | |
| 13 | Al | 3s 2 3p1 | |
| 14 | Si | 3s 2 3p2 | |
| 15 | P | 3s 2 3p3 | |
| 16 | S | 3s 2 3p4 | |
| 17 | Cl | 3s 2 3p5 | |
| 18 | Ar | 3s 2 3p6 | |
| 19 | K | 4s 1 | |
| 20 | Ca | 4s 2 | |
| 21 | Sc | 3d 1 4s 2 | |
| 22 | Ti | 3d 2 4s 2 | |
| 23 | V | 3d 3 4s 2 | |
| 24 | Cr | 3d 5 4s 1 | |
| 25 | Mn | 3d 5 4s 2 | |
| 26 | Fe | 3d 6 4s 2 | |
| 27 | Co | 3d 7 4s 2 | |
| 28 | Ni | 3d 8 4s 2 | |
| 29 | Cu | 3d 10 4s 1 | |
| 30 | Zn | 3d 10 4s 2 | |
| 31 | Ga | 3d 10 4s 2 4p 1 | |
| 32 | Ge | 3d 10 4s 2 4p 2 | |
| 33 | As | 3d 10 4s 2 4p 3 | |
| 34 | Se | 3d 10 4s 2 4p 4 | |
| 35 | Br | 3d 10 4s 2 4p 5 | |
| 36 | Kr | 3d 10 4s 2 4p 6 | |
| 37 | Rb | 5s 1 | |
| 38 | Sr | 5s 2 | |
| 39 | Y | 4d 1 5s 2 | |
| 40 | Zr | 4d 2 5s 2 | |
| 41 | Nb | 4d 4 5s 1 | |
| 42 | Mo | 4d 5 5s 1 | |
| 43 | Tc | 4d 5 5s 2 | |
| 44 | Ru | 4d 7 5s 1 | |
| 45 | Rh | 4d 8 5s 1 | |
| 46 | Pd | 4d 10 | |
| 47 | Ag | 4d 10 5s 1 | |
| 48 | Cd | 4d 10 5s 2 | |
| 49 | In | 4d 10 5s 2 5p 1 | |
| 50 | Sn | 4d 10 5s 2 5p 2 | |
| 51 | Sb | 4d 10 5s 2 5p 3 | |
| 52 | Te | 4d 10 5s 2 5p 4 | |
| 53 | I | 4d 10 5s 2 5p 5 | |
| 54 | Xe | 4d 10 5s 2 5p 6 | |
| 55 | Cs | 6s 1 | |
| 56 | Ba | 6s 2 | |
| 57 | La | 5d 1 6s 2 | |
| 58 | Ce | 4f 1 5d 1 6s 2 | |
| 59 | Pr | 4f 3 6s 2 | |
| 60 | Nd | 4f 4 6s 2 | |
| 61 | Pm | 4f 5 6s 2 | |
| 62 | Sm | 4f 6 6s 2 | |
| 63 | Eu | 4f 7 6s 2 | |
| 64 | Gd | 4f 7 5d 1 6s 2 | |
| 65 | Tb | 4f 9 6s 2 | |
| 66 | Dy | 4f 10 6s 2 | |
| 67 | Ho | 4f 11 6s 2 | |
| 68 | Er | 4f 12 6s 2 | |
| 69 | Tm | 4f 13 6s 2 | |
| 70 | Yb | 4f 14 6s 2 | |
| 71 | Lu | 4f 14 5d 1 6s 2 | |
| 72 | Hf | 4f 14 5d 2 6s 2 | |
| 73 | Ta | 4f 14 5d 3 6s 2 | |
| 74 | W | 4f 14 5d 4 6s 2 | |
| 75 | Re | 4f 14 5d 5 6s 2 | |
| 76 | 0s | 4f 14 5d 6 6s 2 | |
| 77 | Ir | 4f 14 5d 7 6s 2 | |
| 78 | Pt | 4f 14 5d 9 6s 1 | |
| 79 | Au | 4f 14 5d 10 6s 1 | |
| 80 | Hg | 4f 14 5d 10 6s 2 | |
| 81 | Tl | 4f 14 5d 10 6s 2 6p1 | |
| 82 | Pb | 4f 14 5d 10 6s 2 6p2 | |
| 83 | Bi | 4f 14 5d 10 6s 2 6p 3 | |
| 84 | Po | 4f 14 5d 10 6s 2 6p 4 | |
| 85 | At | 4f 14 5d 10 6s 2 6p 5 | |
| 86 | Rn | 4f 14 5d 10 6s 2 6p 6 | |
| 87 | Fr | 7s 1 | |
| 88 | Ra | 7s 2 | |
| 89 | Ac | 6d 1 7s 2 | |
| 90 | Th | 6d 2 7s 2 | |
| 91 | Pa | 5f 2 6d 1 7s 2 | |
| 92 | U | 5f 3 6d 1 7s 2 | |
| 93 | Np | 5f 4 6d 1 7s 2 | |
| 94 | Pu | 5f 6 7s 2 | |
| 95 | Am | 5f 7 7s 2 | |
| 96 | Cm | 5f 7 6d 1 s 2 | |
| 97 | Bk | 5f 9 s 2 | |
| 98 | Cf | 5f 10 s 2 | |
| 99 | Es | 5f 11 s 2 | |
| 100 | Fm | 5f 12 s 2 | |
| 101 | Md | 5f 13 s 2 | |
| 102 | Ne | 5f 14 s 2 | |
| 103 | Lr | 5f 14 6d 1 s 2 | |
| 104 | Rf | 5f 14 6d 2 s 2 |
Třetí hlavní kategorie prvků vzniká v případě, že rozlišovací elektron zaujímá podpouzdro f. V případě, že rozlišovací elektron zaujímá podpouzdro f, vzniká třetí hlavní kategorie prvků. První příklad se vyskytuje v případě lanthanoidů (prvků s atomovými čísly v rozmezí 57 až 71). lanthanoidy mají obecnou elektronovou konfiguraci
4d104f i5s25p65d0 nebo 16s2
kde i je číslo v rozmezí 0-14. V procesu budování lanthanoidů se tedy elektrony přidávají do podskupiny (4f), jejíž hlavní kvantové číslo je o dvě menší než číslo nejvzdálenějšího orbitalu (6s). Přidání dalšího elektronu do vnitřní slupky pohřbené stejně hluboko jako 4f má na chemické vlastnosti těchto prvků malý nebo žádný vliv. Všechny jsou dosti podobné lanthanu (La) a mohly by se vejít na úplně stejné místo v periodické tabulce jako La. Lanthanoidní prvky jsou si natolik podobné, že k jejich oddělení je zapotřebí speciálních technik. V důsledku toho byly i přibližně čisté vzorky většiny z nich připraveny až v 70. letech 19. století. Po prvku aktinium (Ac) následuje řada atomů, u nichž je výplní 5f podpouzdro. Aktinoidy jsou Ac poněkud méně podobné než lanthanoidy La, protože v případě Th, Pa a U se vyskytují určité výjimky z obvyklého pořadí zaplňování orbitalů (tabulka \(\PageIndex{1}\) ).
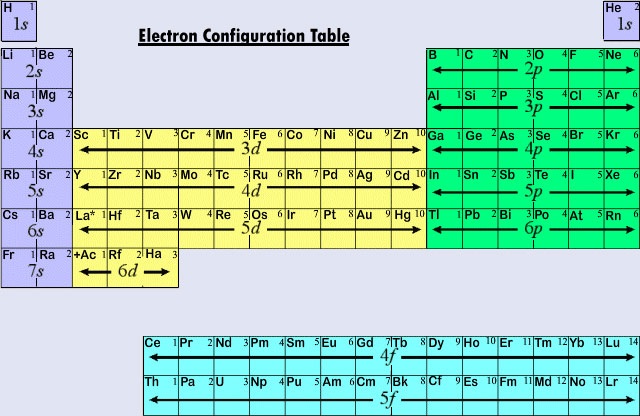
Protože se lanthanoidy a většina aktinoidů chovají chemicky, jako by měly patřit do skupiny IIIB periodické tabulky (kde se nacházejí Lu a Lr), jsou obě skupiny odděleny od zbytku tabulky a umístěny společně do bloku níže. Dohromady se lanthanoidům a aktinoidům říká vnitřní přechodné prvky, protože vyplňované podpouzdra f leží tak hluboko ve zbývající elektronické struktuře jejich atomů.
Obrázek \(\PageIndex{2}\) shrnuje typ podpouzdra, ve kterém se nachází rozlišovací elektron pro atomy prvků v různých oblastech periodické tabulky. Tato souhrnná informace umožňuje poměrně snadno použít periodickou tabulku k získání elektronových konfigurací, jak ukazuje následující příklad.
Příklad \(\PageIndex{1}\):
Zjistěte elektronovou konfiguraci pro (a) Nb; (b) Pr.
Řešení
a) Nb, prvek číslo 41, se nachází v páté periodě a v oblasti periodické tabulky, kde je vyplněna podpouzdra d (druhá přechodová řada). Postupujeme-li periodickou tabulkou směrem dozadu (k nižším atomovým číslům), nejbližším vzácným plynem je Kr, a proto použijeme jádro Kr:
Nb _____
Dalším prvkem po 36K je 37Rb, v němž se vyplňuje 5s podslupka. Posuneme-li se ještě o jedno místo doprava, dojdeme k 38Sr, který má 5s2 pár. Zatím máme Nb _____ 5s2 pro konfiguraci Nb. Nyní se přesuneme dále doprava do oblasti 4d podpovrchové vrstvy periodické tabulky a počítáme přes tři místa (Y, Zr, Nb), abychom se dostali k Nb. Celková elektronová konfigurace je tedy Nb 4d35s2 (Všimněte si, že hlavní kvantové číslo podpouzdra d je 4 – o jedno méně než číslo periody. Také pokud se podíváte na tabulku elektronových konfigurací, je třeba si všimnout, že Nb je výjimkou z typických pravidel pro zaplňování orbitalů) b) Podobně se postupuje i u Pr, prvku číslo 59. Postupujeme-li tabulkou zpět, nejbližším vzácným plynem je Xe, a proto použijeme jádro Xe. Počítáme-li opět dopředu, Cs a Ba odpovídají 6s2. Poté La, Ce a Pr odpovídají dalším třem elektronům v 4f polokouli. Konfigurace je tedy Pr…4f36s2
Ještě je třeba zdůraznit jeden bod týkající se vztahu mezi elektronovou konfigurací a periodickou tabulkou. Atomy prvků ve stejném svislém sloupci tabulky mají podobné elektronové konfigurace. Vezměme si například prvky alkalických zemin (skupina IIA). Pomocí našich pravidel pro odvození elektronových konfigurací (příklad 1) máme
| Prvek | Elektronová konfigurace | Lewisův diagram |
|---|---|---|
| Be | 2s2 | Be: |
| Mg | 3s2 | Mg: |
| Ca | 4s2 | Ca: |
| Sr | 5s2 | Sr: |
| Ba | 6s2 | Ba: |
| Ra | 7s2 | Ra: |
Takže podobnosti chemického chování a valence, které jsme u těchto prvků zaznamenali dříve, korelují s podobnostmi jejich vnějších elektronových mračen. Tyto podobnosti vysvětlují úspěch Mendělejevových předpovědí vlastností neobjevených prvků.
Přispěvatelé a atributy
-
Ed Vitz (Kutztown University), John W. Moore (UW-Madison), Justin Shorb (Hope College), Xavier Prat-Resina (University of Minnesota Rochester), Tim Wendorff a Adam Hahn.
.
