ÚVOD
Základní a klinický výzkum provedený v posledních letech prokázal přímý, obousměrný vztah mezi chronickým onemocněním ledvin a kardiovaskulárním onemocněním.1,2 V každodenní klinické praxi se k odhadu funkce ledvin běžně používají sérové koncentrace kreatininu a rychlost glomerulární filtrace odhadovaná pomocí Cockcroft-Gaultova vzorce3 nebo rovnice Modification of Diet in Renal Disease (MDRD)4 . Plazmatické koncentrace kreatininu však mohou být ovlivněny řadou faktorů, jako je věk pacienta, pohlaví, svalová hmota, fyzická aktivita, dieta a léky.5
Cystatin C je proteinový inhibitor cysteinové proteázy, který je stabilně syntetizován všemi jádrovými buňkami. Díky své nízké molekulové hmotnosti a vysokému izoelektrickému bodu může být vyloučen téměř výhradně glomerulární filtrací. Koncentrace cystatinu C nejsou ovlivněny věkem, pohlavím ani příjmem bílkovin a jsou citlivé na malé změny v glomerulární filtraci. Vzhledem k těmto vlastnostem je plazmatická koncentrace cystatinu C považována za jeden z nejlepších markerů stavu glomerulární filtrace.6-9 V poslední době několik studií uvádí souvislost mezi zvýšenými hodnotami cystatinu C a rozvojem kardiovaskulárních komplikací u pacientů s ischemickou chorobou srdeční. V současné době není známo, zda je tento vztah způsoben tím, že cystatin C je lepším markerem renální funkce než sérový kreatinin, nebo zda kromě glomerulární filtrace existují faktory, které ovlivňují koncentraci tohoto proteinu a mají dodatečný vztah ke kardiovaskulárnímu riziku.10
Cílem této studie bylo posoudit prognostickou hodnotu plazmatické koncentrace cystatinu C u pacientů hospitalizovaných pro akutní koronární syndrom (AKS) s vysokým rizikem a zjistit vztah mezi cystatinem C a dalšími markery renální funkce a zánětu.
METODY
Jedná se o prospektivní observační studii provedenou v období od května 2006 do července 2007. Do studie bylo zařazeno celkem 203 pacientů starších 18 let a konsekutivně hospitalizovaných na kardiologické jednotce intenzivní péče (JIP) našeho centra s diagnózou vysoce rizikového AKS.
Diagnostická kritéria pro vysoce rizikový AKS zahrnovala alespoň 2 z následujících faktorů: bolest s ischemickými rysy, elektrokardiografické změny odpovídající ischemii a/nebo zvýšené markery nekrózy myokardu. Poskytnutá léčba a další testy provedené během hospitalizace pacienta vycházely z klinického rozhodnutí ošetřujícího lékaře. U většiny pacientů byla použita invazivní strategie zahrnující urgentní koronarografii (u infarktu myokardu s elevací úseku ST nebo blokádou levého raménka) nebo časnou plánovanou koronarografii během prvních 24 až 72 hodin po přijetí do nemocnice.
Klinické charakteristiky
Následující údaje byly zaznamenány z klinických záznamů pacientů: demografické informace, přítomnost klasických kardiovaskulárních rizikových faktorů (diabetes mellitus, systémová hypertenze, dyslipidemie a kouření) a anamnéza známého cévního onemocnění (ischemická choroba srdeční, cerebrovaskulární onemocnění, periferní arteriální onemocnění a předchozí revaskularizační léčba myokardu). Další analyzované klinické proměnné zahrnovaly typ AKS, Killipovu třídu v době hospitalizace, hodnoty systolického a diastolického tlaku, pulzní tlak (odhadovaný jako rozdíl mezi systolickým a diastolickým arteriálním tlakem) a srdeční frekvenci.
Všichni pacienti podstoupili echokardiografické vyšetření, při kterém byla ejekční frakce levé komory odhadnuta Simpsonovou metodou pomocí čtyřkomorového přístupu; u pacientů se sinusovým rytmem byl vypočten průměr 3 stanovení a u pacientů s fibrilací síní průměr 5 stanovení.
U 95 % pacientů byla provedena koronarografie a závažnost koronárních lézí byla hodnocena pomocí skóre založeného na počtu postižených epikardiálních koronárních tepen.
Analytické údaje
Výchozí hodnoty hemoglobinu, hematokritu, leukocytů, glukózy a kreatininu byly zaznamenány v prvních laboratorních analýzách provedených v našem centru v době hospitalizace. Koncentrace celkového cholesterolu, cholesterolu v lipoproteinech o vysoké hustotě (HDL-C), cholesterolu v lipoproteinech o nízké hustotě (LDL-C), glukózy, vysoce citlivého C-reaktivního proteinu a cystatinu C byly zaznamenány v prvních 24 hodinách spolu s maximální hladinou troponinu I (TpI).
Cystatin C byl měřen pomocí automatické homogenní imunoanalýzy s použitím nefelometru Dade-Behring BN ProSpec. Činidlo pro analýzu se skládalo z polystyrenových částic potažených protilátkami proti proteinu, které po smíchání se vzorky obsahujícími cystatin C aglutinují a rozptylují světlo o intenzitě úměrné koncentraci analytu.
Referenční interval pro koncentraci cystatinu C v séru dospělých při použité nefelometrické metodě je 0,51 až 0,95 mg/l. Koncentrace vysoce citlivého C-reaktivního proteinu byla rovněž stanovena imunoanalýzou. Rychlost glomerulární filtrace byla odhadnuta pomocí rovnice MDRD.
Analyzované příhody
Analyzované kardiovaskulární komplikace zahrnovaly úmrtí v nemocnici, úmrtí ze všech příčin během sledování, rozvoj nového infarktu myokardu, definovaného jako bolest na hrudi nebo ekvivalentní anginózní bolest se změnami na EKG, nebo zvýšené markery nekrózy tumoru během prvních 24 hodin po hospitalizaci (pacienti se zvýšenými markery po koronárních intervenčních výkonech byli vyloučeni) a rozvoj srdečního selhání během hospitalizace nebo sledování.
Klinické sledování
Mediální doba sledování byla 186 (SD, 110; medián, 156) dní, během nichž byly zaznamenány všechny klinické příhody pacientů. Sledování probíhalo prostřednictvím telefonického kontaktu, v ambulancích a nahlížením do zdravotnické dokumentace pacientů v nemocnici.
Statistická analýza
Všechny informace byly prospektivně zaznamenávány do databáze vytvořené pomocí programu Microsoft Office Access 2003 SP2. Statistické analýzy byly provedeny pomocí programu SPSS (Statistical Package for the Social Sciences), verze 12.0. Kategoriální nebo dichotomické proměnné jsou vyjádřeny jako absolutní hodnoty a procenta a byly porovnány pomocí Pearsonova χ2 testu. Spojité proměnné s normálním rozdělením jsou popsány jako průměr (SD) a pro srovnání mezi skupinami byl použit Studentův t test. Proměnné, které nevykazovaly Gaussovo rozdělení, byly porovnávány pomocí Mannova-Whitneyho U testu.
Spearmanův korelační koeficient byl použit k vyhodnocení korelace koncentrace cystatinu C s vysoce citlivým C-reaktivním proteinem a rychlostí glomerulární filtrace. Logistická regresní analýza byla použita k posouzení nezávislé role klinických a laboratorních faktorů s ohledem na cystatin C pro predikci rozvoje kardiovaskulárních komplikací během hospitalizace, včetně významných proměnných v univariační analýze. Jsou uvedeny upravené poměry šancí a 95% intervaly spolehlivosti (CI). Byly sestrojeny Kaplanovy-Meierovy křivky přežití během sledování a porovnány pomocí long-rank testu.
Pro provedení deskriptivní analýzy studované populace byly některé kvantitativní proměnné rozděleny do intervalů: rychlost glomerulární filtrace (>90, 90-60, 55 % a 0,95 a
Hodnota P menší než .05 byla považována za statisticky významnou.
VÝSLEDKY
Od května 2006 do července 2007 bylo do studie zařazeno 203 pacientů hospitalizovaných s diagnózou AKS s vysokým rizikem. Průměrný věk byl 66,6 (13,16) let. Z celkového počtu pacientů mělo 62,1 % (n=126) AKS bez elevací úseku ST a 37,9 % (n=77) AKS s elevacemi úseku ST. Základní charakteristiky studijní populace jsou popsány v tabulce 1.
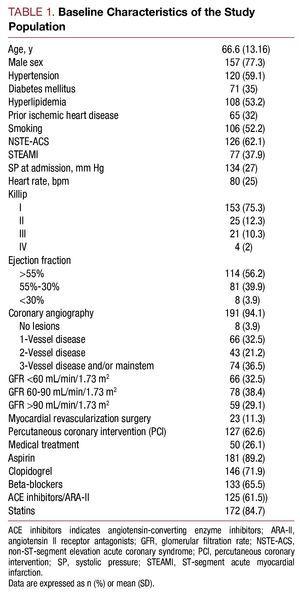
Medián koncentrace cystatinu C byl 1,01 (rozmezí 0,83-1,35) mg/l, plazmatický kreatinin při první provedené analýze byl 1 (0.9-1,3) mg/l, glomerulární filtrace byla 72,4 (49,12-93,73) ml/min/1,73 m2 a vysoce citlivý C-reaktivní protein byl 1,37 (0,46-5,02) mg/l. Glomerulární filtrace v době hospitalizace byla 2 u 32,5 % pacientů a sérový cystatin C byl >0,95 mg/l u 113 (55,7 %) pacientů.
Pacienti s vyššími hodnotami cystatinu C měli horší klinický profil, byli starší, měli vysokou prevalenci hypertenze, horší Killipovu třídu v době hospitalizace, závažnější koronární onemocnění při koronarografii a vyšší hodnoty plazmatického kreatininu a C-reaktivního proteinu (tabulka 2).
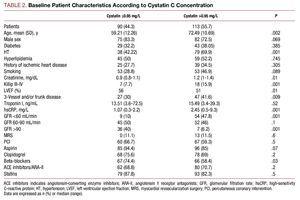
Mezi oběma skupinami s cystatinem C nebyly významné rozdíly, pokud jde o provedenou koronární intervenci; konečný angiografický výsledek přinesl podobnou úspěšnost a žádné významné komplikace (3,27 % u pacientů s cystatinem C ≤0,95 a 4,09 % v druhé skupině). Analýza farmakologické léčby ukázala podstatně vyšší užívání betablokátorů a aspirinu ve skupině s cystatinem C ≤0,95 (tab. 2).
Hodnoty cystatinu C v séru vykazovaly vyšší korelaci s odhadovanou glomerulární filtrací (r=-0,655; P=,001) (obrázek 1) než s mikroalbuminurií (r=0,302, P=,01) a nižší korelaci s C-reaktivním proteinem (r=0,29; P=,01).
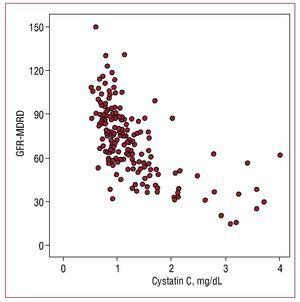
Figure 1. Korelace mezi hodnotami cystatinu C a glomerulární filtrací odhadnutou pomocí vzorce MDRD (GFR-MDRD).
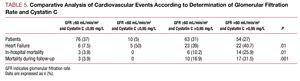
Ve skupině pacientů s hodnotami cystatinu C >0,95 vykazovalo 6,5 % normální glomerulární filtraci a 46 % glomerulární filtraci mezi 60 a 90 ml/min/1,73 m2. Kromě toho 10 % pacientů, kteří měli poruchu funkce ledvin s filtrací 2, mělo hodnoty cystatinu C
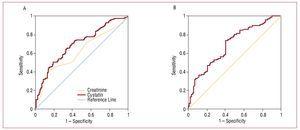
Obrázek 2. U pacientů s poruchou funkce ledvin s filtrací 2 byly hodnoty cystatinu C

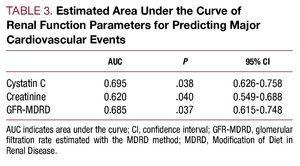
. A, ROC cystatinu C a kreatininu ve vztahu k rozvoji kardiovaskulárních komplikací (srdeční selhání, infarkt a kardiovaskulární smrt). B, ROC křivka glomerulární filtrace odhadnuté pomocí MDRD ve vztahu k rozvoji kardiovaskulárních komplikací (srdeční selhání, infarkt a kardiovaskulární smrt).
Hospitalizace trvala v průměru 9 (6-19) dní. Od přijetí do ukončení sledování studie se u 56 (27,58 %) pacientů z celkového vzorku vyvinulo srdeční selhání, nejvíce ve skupině se zvýšenými hodnotami cystatinu C (45 pacientů). Nemocniční mortalita byla významně vyšší ve skupině se zvýšenými hodnotami cystatinu C (17,6 % vs 3,3 %; P=,001) a tyto rozdíly přetrvávaly i během sledování (obr. 3, tab. 4).
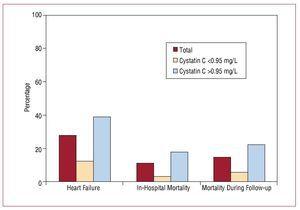
Figure 3. Asociace mezi cystatinem C 0,95 mg/l a vznikem kardiovaskulárních příhod v nemocnici.

V univariační analýze nebyla pozorována žádná asociace mezi kardiovaskulárními komplikacemi a typem AKS, hyperlipidemií nebo vrcholovou koncentrací TpI, ale byla zjištěna asociace se zbývajícími kardiovaskulárními rizikovými faktory: počtem postižených cév, ejekční frakcí, markery renálních funkcí, cystatinem C a vysoce citlivým C-reaktivním proteinem. Při analýze výsledků od pacientů s glomerulární filtrací >60 ml/min/1,73 m2 jsme zjistili, že pacienti s cystatinem C >0. Při analýze výsledků od pacientů s glomerulární filtrací >0.95 mg/l vykazovali významně vyšší výskyt kardiovaskulárních komplikací než pacienti s glomerulární filtrací >60 a cystatinem C 60 a cystatinem C
Odhadované přežití bez příhod (tj. bez srdečního selhání, infarktu myokardu nebo úmrtí) po průměrné době sledování 186 dní bylo významně vyšší ve skupině pacientů s hodnotami cystatinu ≤0.95 mg/l: 75 % oproti 44 % (P=,02) (obrázek 4).

Figure 4. Kaplan-Meierovy křivky pro odhad pravděpodobnosti přežití bez závažných kardiovaskulárních příhod podle hodnoty cystatinu C.
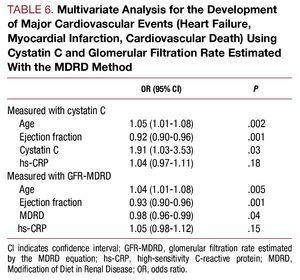
Multivariační analýza identifikovala věk, ejekční frakci a koncentraci cystatinu C jako nezávislé prediktivní faktory kardiovaskulárních komplikací během hospitalizace (tabulka 6).
DISKUSE
Výsledky této studie ukazují, že zvýšené hodnoty cystatinu C předpovídají vznik srdečního selhání v nemocnici, infarktu myokardu a kardiovaskulární smrti u pacientů s vysoce rizikovým AKS nezávisle na ostatních klasických rizikových faktorech. Kromě toho může mít hodnota plazmatického cystatinu C větší schopnost stratifikovat pacienty s vysokým rizikem kardiovaskulárních komplikací během hospitalizace než jiné metody hodnocení renálních funkcí. Zjistili jsme, že zvýšená hodnota cystatinu C byla spojena s horší kardiovaskulární prognózou i ve skupině pacientů s normální glomerulární filtrací. Pokud je nám známo, jedná se o první zprávu o této asociaci, která by podle našeho názoru mohla mít význam pro stratifikaci rizika u této populace pacientů.
V posledních letech byla v několika článcích popsána úzká souvislost mezi renální dysfunkcí a kardiovaskulárními komplikacemi během sledování pacientů s akutní a chronickou ischemickou chorobou srdeční a také s jinými klinickými projevy kardiovaskulárních onemocnění, zejména se srdečním selháním.1,10-12 Snížení glomerulární filtrace pod 60 ml/min je spojeno s významným zvýšením rizika úmrtí, infarktu myokardu a cévní mozkové příhody, a to jak u pacientů s předchozím kardiovaskulárním onemocněním, tak bez něj.13 Konkrétně byl tento vztah popsán u pacientů s AKS s elevací úseku ST a bez ní.10,13-15 Ve studii VALIANT16 (pacienti s komorovou dysfunkcí a srdečním selháním po infarktu myokardu s elevací úseku ST) bylo zhoršení renálních funkcí (hodnoceno pomocí glomerulární filtrace) spojeno se zvýšením mortality a kardiovaskulárních komplikací během sledování. Podobné výsledky byly zaznamenány u populací pacientů zahrnutých do studií SAVE (postinfarktová komorová dysfunkce), HOPE (pacienti s vysokým kardiovaskulárním rizikem, většina s chronickou ischemickou chorobou srdeční) a PEACE (pacienti s chronickou ischemickou chorobou srdeční). V těchto studiích byl vztah mezi renální dysfunkcí a prognózou pozorován u snížené glomerulární filtrace i u vylučování albuminu močí.16-19
Jak bylo uvedeno výše, byl popsán přímý dvoucestný vztah mezi renální dysfunkcí a kardiovaskulárním onemocněním. Chronické selhání ledvin podporuje rozvoj hypertenze a dyslipidemie a podporuje aktivaci systému renin-angiotenzinaldosteron. Tyto faktory spolu se zvýšením zánětlivých mediátorů zřejmě přispívají k vyšší produkci volných radikálů, které zasahují do aterosklerotického procesu a kardiovaskulárního poškození. Kromě toho změny minerálního metabolismu (zvýšení promotorů a snížení inhibitorů kalcifikace) podporují ukládání vápníku v koronárních cévách.20,21 A konečně, u pacientů s renální dysfunkcí bylo popsáno méně intenzivní využívání terapeutických intervencí s uznávaným klinickým a prognostickým přínosem. Konkrétně u pacientů s AKS může k horší prognóze popsané u této populace pacientů přispívat méně agresivní léčba a delší prodlevy při provádění intervenčních koronárních výkonů, jakož i nižší užívání IIb/IIIa, blokátorů osy reninangiotenzin-aldosteron, betablokátorů, statinů a protidestičkových látek.22
V každodenní klinické praxi je hodnocení renálních funkcí obvykle založeno na stanovení sérového kreatininu a odhadu rychlosti glomerulární filtrace pomocí vzorců Cockcroft-Gault nebo MDRD. Obě tyto metody mají několik omezení, z nichž mnohá vyplývají z faktorů, které ovlivňují produkci kreatininu, jako je věk, ženské pohlaví, rasové charakteristiky, dieta a průběh chronických onemocnění.
Tyto rovnice byly nedávno hodnoceny u pacientů se srdečním selháním a porovnávány s NT-proBNP, prognostickým markerem. Bylo zjištěno, že prognostické informace poskytované NT-proBNP jsou lepší než informace o funkci ledvin odhadované podle vzorce MDRD.23
Cystatin C má molekulární a metabolické vlastnosti, díky nimž jsou plazmatické koncentrace tohoto proteinu dobrým biologickým markerem pro odhad funkce ledvin; malé funkční změny jsou detekovány s vyšší citlivostí než konvenční parametry používané pro tento účel.24 To může odůvodňovat skutečnost, že ve skupině pacientů s koncentracemi cystatinu C v séru nad horní hranicí normy vykazovalo 15 % normální glomerulární filtraci; stanovení statinu C může být užitečné pro identifikaci pacientů s preklinickým stavem onemocnění ledvin.6
Výsledky získané v této studii jsou do jisté míry v souladu s uváděnými výsledky, které naznačují, že cystatin C je nezávislým prediktorem kardiovaskulárních komplikací u pacientů s ischemickou chorobou srdeční.25-27 Naše údaje navíc mohou tento koncept rozšířit i na pacienty s normální glomerulární filtrací. Jernberg et al26 analyzovali vztah mezi hodnotami plazmatického cystatinu C a prognózou u skupiny pacientů hospitalizovaných pro AKS bez elevace segmentu ST a zaznamenali významnou souvislost mezi hodnotami cystatinu C a mortalitou. Bylo také popsáno, že zvýšené koncentrace cystatinu C jsou spojeny se zvýšeným rizikem úmrtí, kardiovaskulárních komplikací a výskytem srdečního selhání u ambulantních pacientů s chronickou ischemickou chorobou srdeční.24 U starších osob bez manifestního onemocnění ledvin je cystatin C rizikovým markerem pro úmrtí, kardiovaskulární onemocnění a chronické onemocnění ledvin.6 V současné studii jsme zjistili, že pacienti se zvýšenými hodnotami cystatinu C měli horší rizikový profil; překvapivá však byla relativně nízká hladina C-reaktivního proteinu. Domníváme se, že to lze vysvětlit kinetikou tohoto proteinu, který má specifické, charakterizované spektrum, v němž jeho hodnota závisí na časovém okamžiku, kdy je vzorek odebrán (vrchol nastává za 49 hodin od vzniku příznaků a opožděnější vrchol je pozorován u akutního infarktu myokardu s elevací ST segmentu); v naší studii byly vzorky odebrány během prvních 24 hodin po hospitalizaci.28 Kardiovaskulární komplikace postihující pacienty v naší studii se liší od komplikací publikovaných v nedávných registrech29 , což může být způsobeno tím, že do studie byli zařazeni pacienti s velmi vysokým rizikem a vyšším výskytem komplikací. V nedávno publikovaném registru MASCARA bylo pouze 50 % zařazených pacientů původně přijato na JIP nebo kardiologickou JIP, zatímco všichni naši pacienti pocházeli z kardiologické JIP, což nepochybně znamená určité zkreslení výběru. Nicméně skupina pacientů se zvýšeným cystatinem C tvořila populaci s výrazně vyšším rizikovým profilem a počtem kardiovaskulárních komplikací než ostatní pacienti. Tato studie přispívá ke stanovení větší přesnosti těchto asociací tím, že přináší první zprávu o tom, že zvýšené hladiny cystatinu C v prvních hodinách hospitalizace pro vysoce rizikový AKS jsou nezávislým prediktorem kardiovaskulárních komplikací v nemocnici. Navíc souvislost mezi cystatinem C a rizikem kardiovaskulárních komplikací je vyšší než u jiných široce používaných parametrů pro hodnocení renální funkce a přetrvává i ve skupině pacientů s normální glomerulární filtrací. V současné době není přesně známo, zda schopnost předpovídat vyšší riziko komplikací vyplývá z toho, že cystatin C je lepším markerem renální funkce než jiné běžné parametry (sérový kreatinin a glomerulární filtrace), nebo zda kromě glomerulární filtrace existují i jiné faktory, které ovlivňují koncentraci cystatinu C a mohly by přímo souviset s kardiovaskulárním rizikem. V této linii byla popsána pozitivní korelace hodnot plazmatického C-reaktivního proteinu a fibrinogenu se zvýšenou koncentrací cystatinu C a přítomností kardiovaskulárního onemocnění.30 Ve studii PRIME (Prospective Epidemiological Study of Myocardial Infarction) byla u pacientů bez koronárního onemocnění zkoumána souvislost mezi cystatinem C a rozvojem akutního infarktu myokardu srdeční smrti a anginy pectoris. Po úpravě na běžné kardiovaskulární rizikové faktory byla plazmatická hladina cystatinu C významně spojena s rozvojem první koronární komplikace ischemického původu. Podle názoru autorů by snížená glomerulární filtrace neospravedlňovala vyšší hodnoty cystatinu C, které vykazovaly případy ve srovnání s kontrolami, a navrhli, že na počátku vztahu mezi cystatinem C a rizikem kardiovaskulárních onemocnění může být zánět.31,32 V souladu s těmito údaji naše výsledky ukázaly pozitivní korelaci mezi cystatinem C a vysoce citlivým C-reaktivním proteinem (r=0,2), který je rovněž nezávislým prediktorem kardiovaskulárních komplikací, a poskytují další důkazy pro zdůvodnění existence přímého vztahu mezi onemocněním ledvin, zánětem a kardiovaskulárním onemocněním.
Mezi hlavní omezení prezentované studie je třeba zdůraznit, že výsledky se týkají pouze pacientů s vysoce rizikovým AKS hospitalizovaných na kardiologické JIP, z nichž většina byla agresivně léčena časnou koronarografií. Na druhou stranu je třeba tyto charakteristiky zdůraznit, protože o této specifické populaci, u níž byl cystatin C měřen při přijetí do nemocnice, je málo informací. Téměř ve všech publikovaných studiích není uveden časový okamžik stanovení a přinejmenším u pacientů s AKS mohou být plazmatické koncentrace cystatinu C ovlivněny délkou doby od příhody a provedenými diagnostickými a terapeutickými intervencemi. Omezení v podobě krátkého sledování brání rozšíření našich pozorování na střednědobý nebo dlouhodobý horizont. Nicméně naše zjištění nabízejí možnost zlepšit stratifikaci rizika u pacientů hospitalizovaných pro vysoce rizikový AKS, což bude užitečné pro rozhodování o terapii i stanovení diagnózy.
ZÁVĚRY
Stanovení cystatinu C v době hospitalizace u pacientů s vysoce rizikovým AKS může být dobrým klinickým nástrojem pro stratifikaci kardiovaskulárního rizika. Stanovení tohoto proteinu by doplnilo informace poskytované jinými metodami hodnocení funkce ledvin a kromě diagnostického významu by mohlo být užitečné pro identifikaci skupiny s nejvyšším rizikem. Možná bude nutné věnovat zvláštní pozornost plnění doporučení obsažených v pokynech pro klinickou praxi u této populace. Kromě toho by cystatin C mohl přispět k důležitým informacím pro stratifikaci pacientů s AKS s vysokým rizikem a zachovanou funkcí ledvin. K přesnějšímu vymezení úlohy cystatinu C u AKS může být zapotřebí dalších studií s delším sledováním.
ABBREVIACE
ACS: akutní koronární syndrom
MDRD: Modification of Diet in Renal Disease
TpI: troponin I
.
