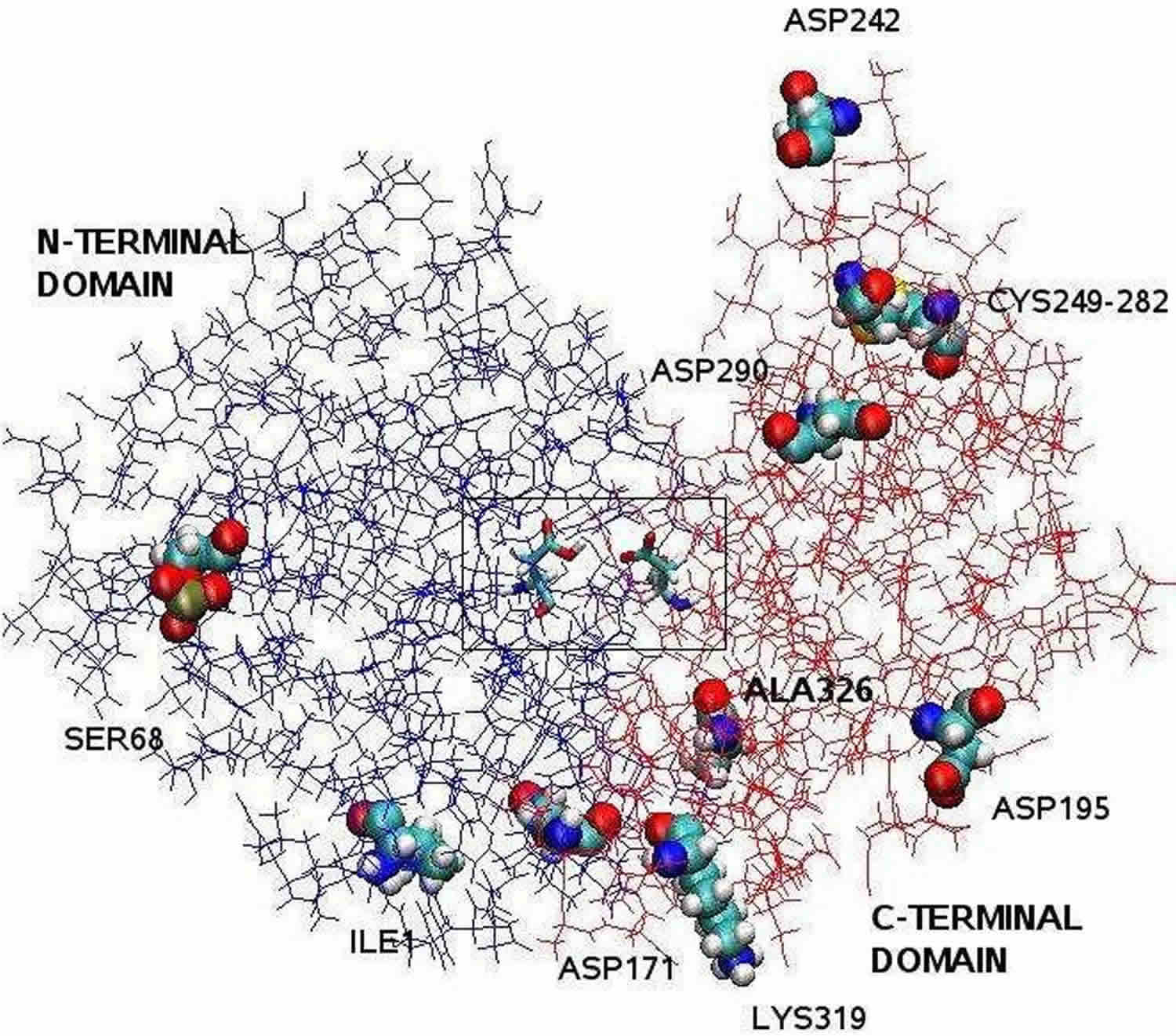
 Poznámka: Struktura pepsinu objasněná pomocí rentgenové krystalografie je bilobální s velkou štěrbinou aktivního místa mezi oběma laloky. Zbytky 1 až 175 tvoří N-terminální doménu, zatímco zbytky 176 až 326 tvoří C-terminální doménu. Dva aspartáty ve středu štěrbiny, Asp32 a Asp215, fungují jako katalytické zbytky. Katalytické místo, které se skládá z Asp32 a Asp215, se nachází ve středu štěrbiny. Nabité aminokyselinové zbytky nacházející se na povrchu proteinu jsou: Asp171, Asp195, Asp242, Asp290, Lys319, Ile1 (N-terminální), Ala326 (C-terminální). Fosforylovaný Ser68 je plně vystaven rozpouštědlu a disulfidický můstek mezi Cys 249 a Cys 282 se nachází na povrchu proteinu.
Poznámka: Struktura pepsinu objasněná pomocí rentgenové krystalografie je bilobální s velkou štěrbinou aktivního místa mezi oběma laloky. Zbytky 1 až 175 tvoří N-terminální doménu, zatímco zbytky 176 až 326 tvoří C-terminální doménu. Dva aspartáty ve středu štěrbiny, Asp32 a Asp215, fungují jako katalytické zbytky. Katalytické místo, které se skládá z Asp32 a Asp215, se nachází ve středu štěrbiny. Nabité aminokyselinové zbytky nacházející se na povrchu proteinu jsou: Asp171, Asp195, Asp242, Asp290, Lys319, Ile1 (N-terminální), Ala326 (C-terminální). Fosforylovaný Ser68 je plně vystaven rozpouštědlu a disulfidický můstek mezi Cys 249 a Cys 282 se nachází na povrchu proteinu.
Pepsin jako asparaginová proteáza má velmi nízké pH optimum. Kondjoyan, Daudin a Santé-Lhoutellier 9) při studiu stravitelnosti myofibrilárních proteinů zjistili maximální pepsinovou aktivitu při pH kolem 2. Pletschke, Naudé a Oelofsen 10) studovali hydrolýzu hemoglobinu prasečím a pštrosím pepsinem a rovněž zjistili optimum pH 2,0 pro pepsinovou aktivitu. Po aktivaci pH <4,5 jsou enzymy pepsinu snadno denaturovány při pH nad 7,0, což představuje vlastnosti, které určují vlastnosti pepsinu 11).
Na rozdíl od vlivu pH je vliv iontové síly na aktivitu enzymů diskutován méně často. Předchozí práce Dalea a Whitea 12) ukázaly, že zvýšení iontové síly zřetelně snižuje reakční rychlost imobilizované pankreatické ribonukleasy, zatímco Butré, Wierenga a Gruppen 13) studovali enzymatickou hydrolýzu syrovátkového bílkovinného izolátu alkalasou a neutrasou a rovněž zjistili, že přítomnost 0,5 % iontové síly snižuje rychlost reakce.5M NaCl snížila rychlost hydrolýzy.
Jsou známy dva silné přírodní inhibitory pepsinu: pepstatin, pentapeptid ze Streptomyces, a unikátní proteinový inhibitor z Ascaris. Pepsin také podléhá zpětnovazební inhibici; produkt trávení bílkovin zpomaluje reakci tím, že inhibuje pepsin 14).
Kde se pepsin vyrábí?
Buňky šéfa vylučují pepsin ve formě neaktivního prekurzoru enzymu zvaného pepsinogen. Při kontaktu pepsinogenu s kyselinou chlorovodíkovou z parietálních buněk dochází k jeho rychlému rozkladu za vzniku pepsinu 15). Pepsin zahajuje trávení téměř všech typů bílkovin stravy na polypeptidy. Tento enzym je nejaktivnější v kyselém prostředí, které zajišťuje kyselina chlorovodíková v žaludeční šťávě.
Obrázek 2. Žaludeční buňky (žaludeční žlázy)
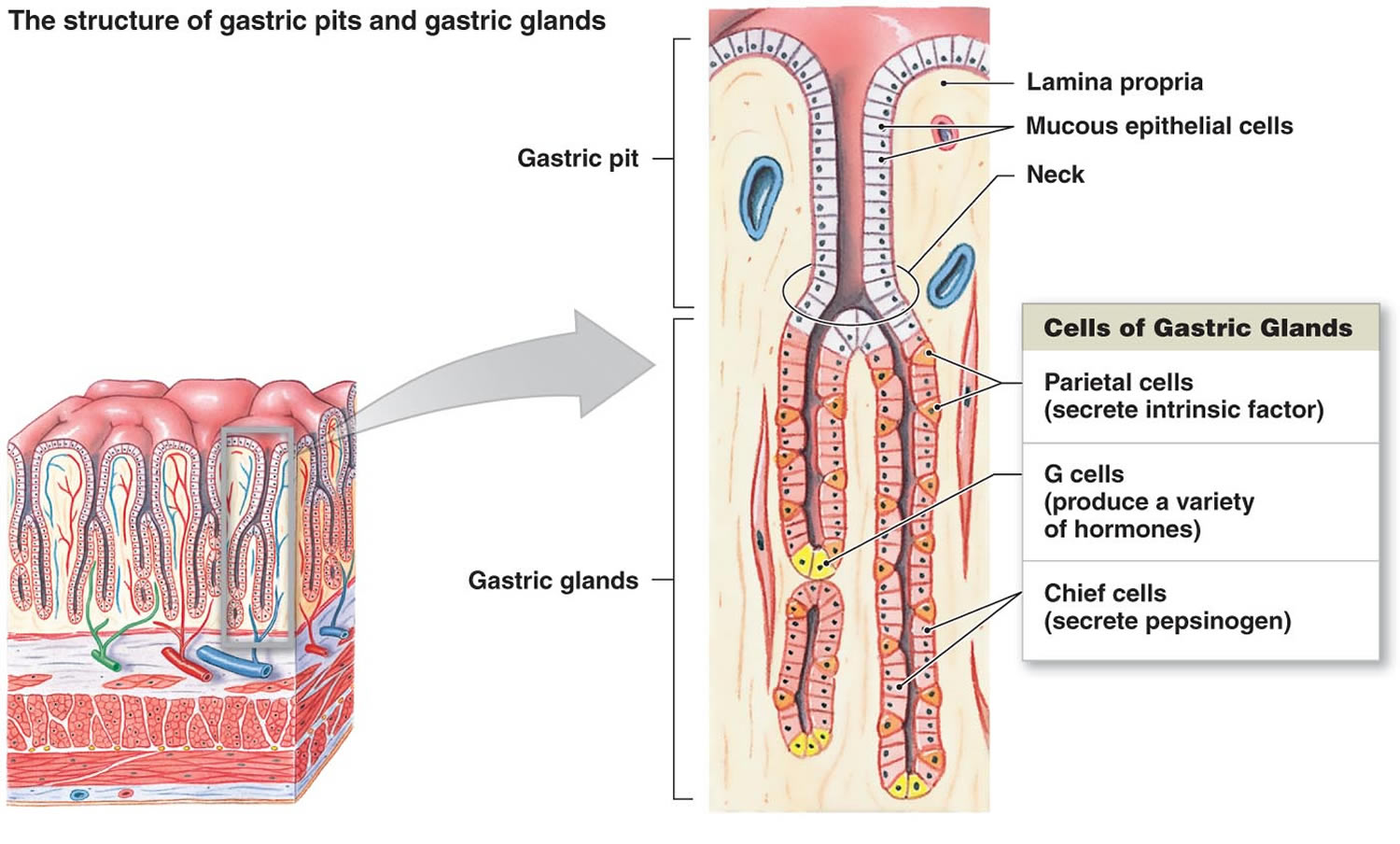 Poznámka: Výstelka žaludku. Žaludeční žlázy zahrnují slizniční buňky, parietální buňky a hlavní buňky. Sliznice žaludku je poseta žaludečními jamkami, které jsou otvory žaludečních žláz.
Poznámka: Výstelka žaludku. Žaludeční žlázy zahrnují slizniční buňky, parietální buňky a hlavní buňky. Sliznice žaludku je poseta žaludečními jamkami, které jsou otvory žaludečních žláz.
Co dělá pepsin?
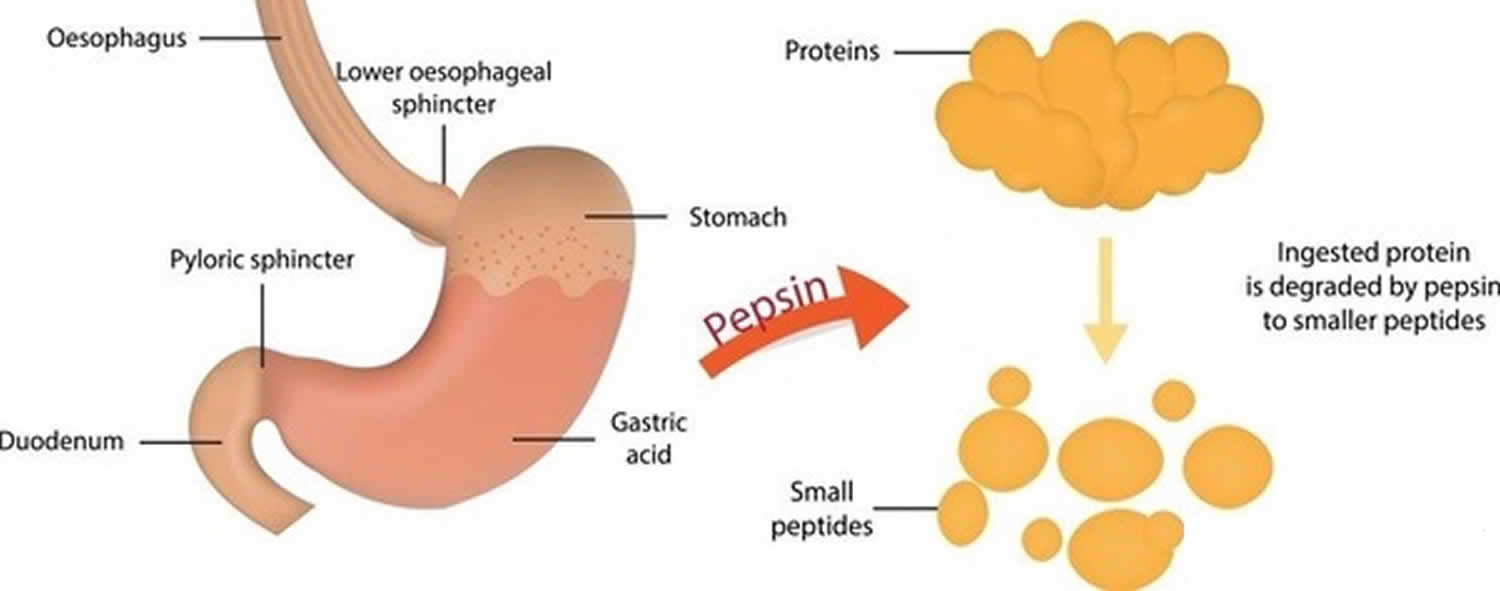
Pepsin vzniklý z pepsinogenu (neaktivní forma pepsinu) v přítomnosti kyseliny chlorovodíkové tráví téměř všechny druhy bílkovin v potravě na polypeptidy (menší bílkovinné sloučeniny). Pepsin tráví bílkoviny v silné žaludeční kyselině. Pepsin je optimalizován pro trávení potravy v kyselém prostředí žaludku a je první proteázou, se kterou se bílkoviny potravy v trávicím traktu setkávají. Pepsin je nejaktivnější v kyselém prostředí mezi 37 °C a 42 °C 16).
Specifičnost pepsinu (tj. pravděpodobnost štěpení peptidových vazeb pepsinem) je ovlivněna především aminokyselinovými zbytky v poloze P1 a P1′, přičemž roli mohou hrát i aminokyselinové zbytky na dalších podúrovních. Obecně pepsin preferuje štěpení po fenylalaninu, leucinu a methioninu, zatímco po histidinu, lysinu, prolinu a argininu štěpí jen zřídka 17). Aromatické zbytky tyrosin, tryptofan a fenylalanin jsou upřednostňovány v poloze P1′. Prolin je silně znevýhodněn v poloze P2, P2′ a P3′, zatímco histidin, lysin a arginin jsou znevýhodněny v poloze P3. Polohy P4 a P4′ mají malý vliv 18).
Obrázek 3. Funkce pepsinu
.
