Sbírání hmyzu je pro mnohé zajímavým koníčkem, ale je také velmi užitečné ve vědeckém výzkumu. Tento příspěvek vysvětlí, jak sbírat a uchovávat hmyz, a ukáže, jak by měl být připevněn.
Sbírat hmyz lze kdykoli, i když se vyskytuje hlavně v období od jara do pozdního podzimu. Léto je pravděpodobně nejvhodnější dobou, protože hmyz je nejhojnější. V teplých a slunečných dnech bude pravděpodobně přítomno nejvíce hmyzu, nicméně by bylo vhodné kontrolovat v průběhu různých období a povětrnostních podmínek, protože různý hmyz se objevuje v různou dobu. V noci jsou skvělým místem k hledání pouliční lampy a světla na verandách. V listí a rostlinách se pravděpodobně nachází hmyz a existuje také mnoho nočního hmyzu, který se drží dál od světel.
Sbírací pomůcky:
- Síťka na hmyz – lze ji zakoupit nebo vyrobit. Měly by být vyrobeny ze síťoviny, která je přišita k mušelínu nebo plátnu, které obepíná drát. Odtud lze hmyz přenést do sklenice, a to buď vložením sklenice do sítě, nebo přidržením hmyzu za hrudník.
-

Moje zabijácká sklenice. PC: Colton Weaver Zabíjecí sklenice – Nejlepší je mít 2-3 sklenice různých tvarů a velikostí. Ideální je, když jsou uzavřené zátkou, nicméně to může záviset. Měly by být viditelně označeny nápisem „POISON“. Do sklenice se přidává sádra nebo vata, aby se v ní udržel usmrcující prostředek. Borror, Delong a Triplehorn doporučují kyanid, lze však použít i ethylacetát, který je podstatně bezpečnější. Lze použít i tetrachlormethan nebo chloroform.
- Krabice na pilulky s kapesníkem
- Obálky nebo papír k jejich výrobě – Užitečné pro dočasné skladování. Lze je snadno vyrobit v terénu a udrží vaše vzorky v relativním bezpečí.
- Lahvičky naplněné konzervační kapalinou
- Konzervační kleště
- Ruční čočka
- Aspirátor – Zachycují drobný hmyz do lahviček pomocí dechu. Obvykle mají sítko, abyste hmyz nevdechli.
- Tlukoucí deštník nebo prostěradlo – Pod rostlinu se položí prostěradlo nebo deštník, který se pak tluče nebo protřepává, aby na prostěradlo spadl drobný hmyz.
- Rozsévač – Listový odpad lze pomalu prosévat na bílou látku nebo karton a pak nalezený hmyz odsát.
- Pasti – Existuje mnoho druhů pastí. Berleseho trychtýř má trychtýř se sítem a žárovkou nahoře, dole je alkohol. Hmyz je přilákán a pak padá do nádoby na zabíjení. Na některé druhy hmyzu může být účinná světelná past, která může být jednoduchá, jako je světlo nad usmrcovacím prostředkem, nebo past na chůzi, kde se hmyz usadí a může se sbírat ručně. Na mrchožrouty nebo jiný nelétavý hmyz lze použít padací pasti, což jsou jednoduše plechovky s návnadou na dně. Hmyz do nich spadne a nemůže uniknout. Jednoduchou pastí může být i pouhý cukerný roztok rozetřený na povrchu.
- Čelní svítilna
- Pouzdro nože
Zpracování úlovku: Mnoho druhů hmyzu s měkkým tělem lze umístit přímo do 70-90% isopropylalkoholu nebo etylalkoholu. Patří sem larvy a nymfy mnoha druhů, ale i některý menší hmyz. Hmyz s tvrdým tělem by měl být vložen do nádoby na zabíjení. Doba, po kterou to bude trvat, závisí na druhu hmyzu i na použitém usmrcovacím prostředku a může se pohybovat od několika minut až po několik hodin. Když je hmyz mrtvý, měl by být co nejdříve odstraněn, aby se zabránilo dalšímu zabarvení. Lze je uchovávat v krabičkách na tablety nebo ve výše popsaných papírových obálkách.
Odstraňování: Pokud nemůžete vzorek ihned připnout a rozprostřít, pravděpodobně zaschne. V tomto stavu je poměrně křehký a při pokusu o aranžování se zlomí. K nápravě můžete použít relaxační komůrku, relaxační tekutinu nebo hmyz uvařit ve vodě (to ho však může poškodit).
Relaxační komůrky jsou nádoby s vlhkým pískem nebo látkou uvnitř. Ideální je přidat kyselinu karbolovou, aby se zabránilo případnému plesnivění. Po jednom nebo dvou dnech byste měli být schopni s exemplářem opět manipulovat.
Relaxační tekutina může být vyrobena z různých směsí a obvykle v ní hmyz necháte několik minut. Jedna směs, často známá jako Barberova tekutina, je uvedena níže:
| 95% etylalkohol | 50 cm3 |
| Voda | 50cm3 |
| Etyl acetát | 20cm3 |
| Benzen | 7cm3 |
Další metodou, kterou lze použít, je vstřikování vody z vodovodu. Ta funguje na mnoho motýlů (Lepidoptera). Pomocí jehly o průměru 20-25 mm vstříkněte vodu do hrudního koše pod křídlem, dokud se zcela nezaplní. Po 5-20 minutách by měl být hmyz uvolněný.
Konzervace v tekutině: Tuto metodu lze použít u mnoha druhů hmyzu s měkkým tělem (např. majky, pestřenky, kadeřavky atd.), které nelze připnout, pokud nejsou vysušeny výše uvedeným způsobem. Je také užitečná pro velmi malé exempláře, které budou studovány na mikroskopických preparátech, a pro larvy a nymfy hmyzu. Tímto způsobem by se měli uchovávat i nehmyzí členovci.
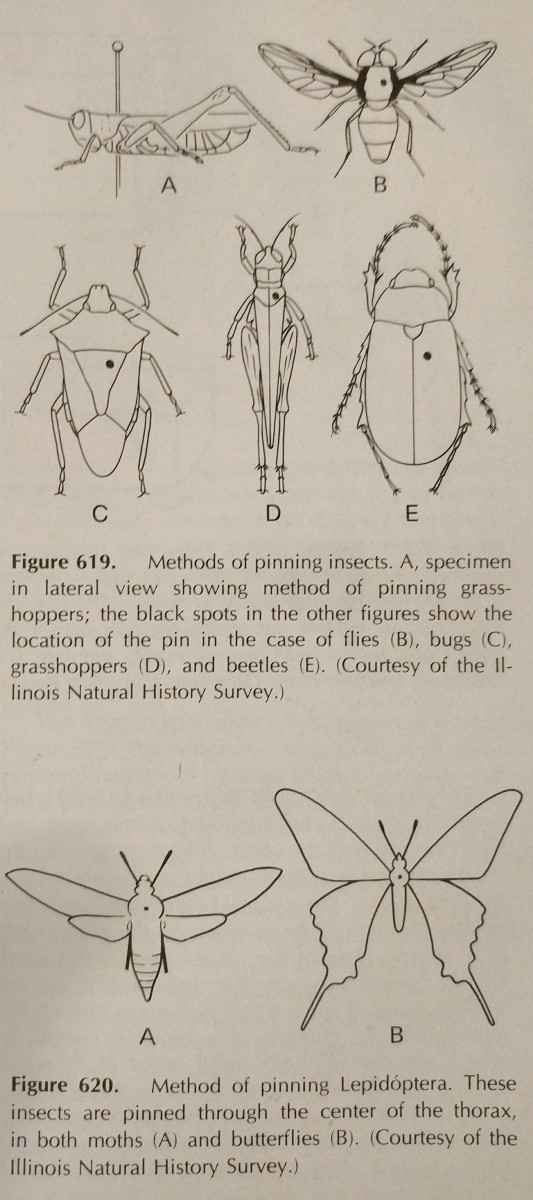
Zapichování: Toto je nejjednodušší způsob uchování hmyzu s tvrdým tělem. Barvy často vyblednou, když hmyz uschne, tomu se však dá jen těžko zabránit. Měly by se používat speciální špendlíky na hmyz, které jsou delší a nerezaví. Jsou k dispozici ve velikostech 00-7, avšak ty menší mohou být méně použitelné. Různé zakázky by měly být připínány na různých místech, což je znázorněno na obrázku. Nohy by měly být prodloužené, stejně jako křídla. Často mají včely pro snazší identifikaci vyplazený jazyk.
Nejlépe je, když jsou všechny druhy ve sbírce připnuty v jednotné vzdálenosti. Ideální je asi 25 mm nad bodem a stejných vzdáleností lze snadno dosáhnout použitím připínáčku, což je jednoduše dřevěný špalek s otvory vyvrtanými do různé hloubky.
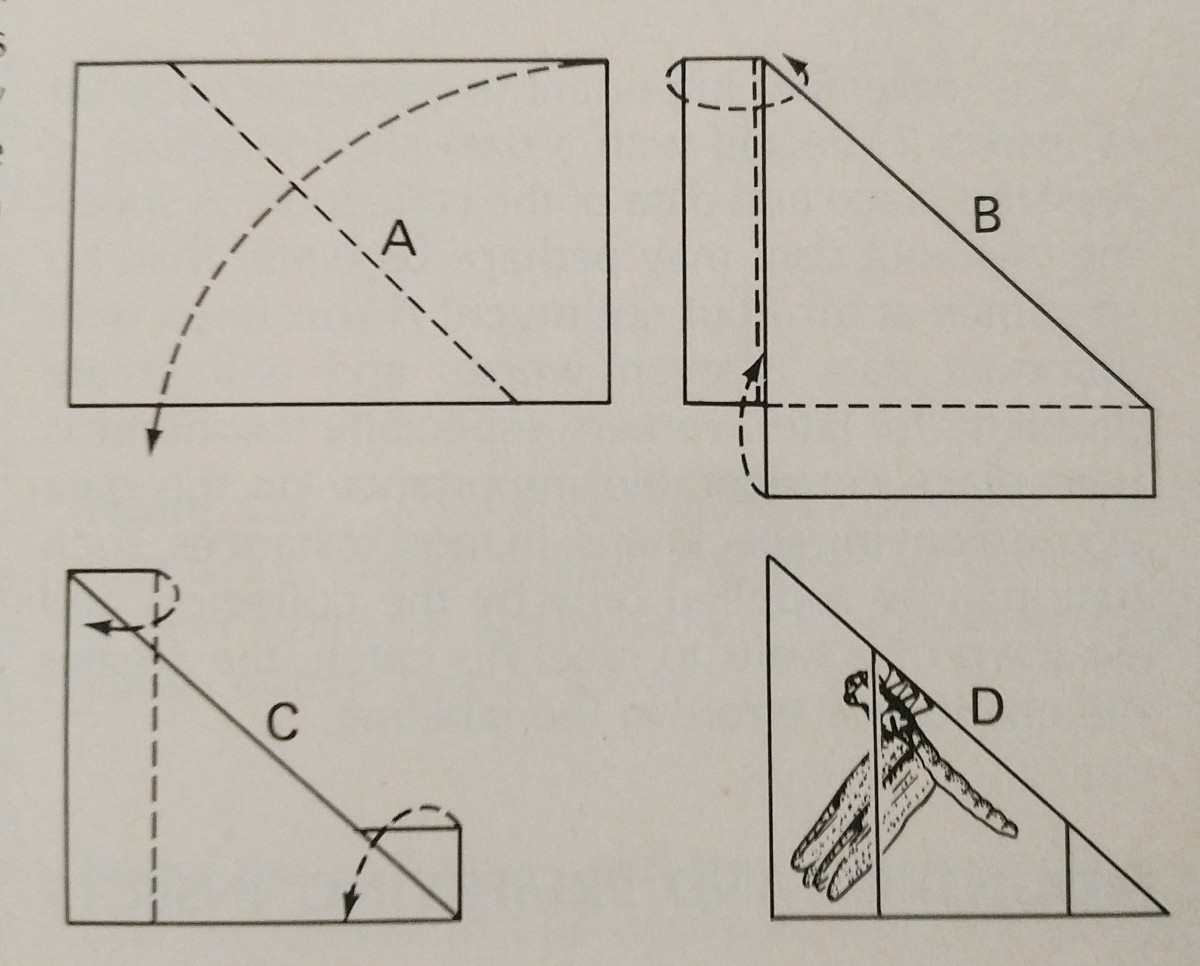
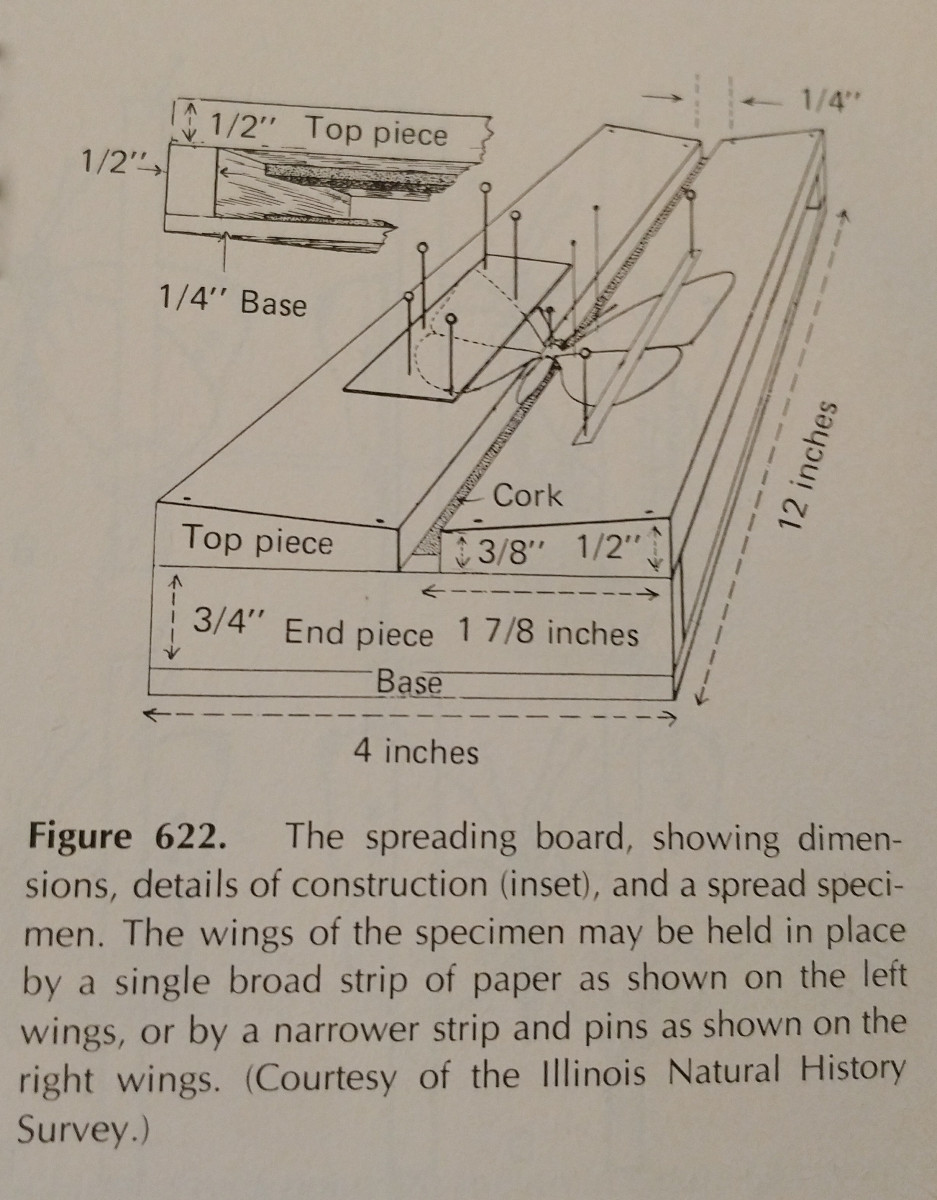
Rozšiřování hmyzu je do značné míry o praxi. Použití rozmetací desky tento úkol značně usnadňuje,
a je nezbytné mít náhradní špendlíky a papírové proužky. Špendlíky lze použít k pohybu po končetinách a křídlech.
Typicky by se mělo tlačit na přední okrajovou žilku křídla, zejména u Lepidoptera. Zadní okraj křídel Lepidoptera by měl svírat s hrudníkem pravý úhel a zadní křídla nahoru, aby mezi nimi a předními křídly nebyla mezera, jak je znázorněno na obrázku. Je  důležité být velmi opatrný a při manipulaci s hmyzem používat kleště. Jsou velmi křehcí a často může snadno dojít k odlomení šupin a tykadel. K upevnění křídel lze použít papírové proužky a špendlíky, které pak po zaschnutí zůstanou na svém místě.
důležité být velmi opatrný a při manipulaci s hmyzem používat kleště. Jsou velmi křehcí a často může snadno dojít k odlomení šupin a tykadel. K upevnění křídel lze použít papírové proužky a špendlíky, které pak po zaschnutí zůstanou na svém místě.
Malý hmyz potřebuje k upevnění trochu vynalézavosti a lze jej nalepit na špičky karet, drobné špendlíky nebo mikroskopická sklíčka. Jednoduše připíchnete špičku karty, nanesete na ni malé množství lepidla a pak hmyz přilepíte.
Sušení: Mnoho připíchnutého hmyzu lze sušit na vzduchu na teplém a suchém místě. Větší můry mohou potřebovat sušicí komoru s jednou nebo více žárovkami uvnitř a u některých velkých exemplářů může být dokonce nutné odstranit břišní orgány. Neexistuje žádná definitivní doba, za kterou se exemplář vysuší, nicméně to přijde až se zkušenostmi.
Měkký tělnatý hmyz může být vysušen mrazem nebo ve vakuu a poté přišpendlen, aby se vytvořil nekřehký, nezabarvený exemplář. Obvykle by se scvrkly, nicméně tento krok je vysuší natolik, že zůstanou na špendlíku.
Typicky se používá roztok ethylalkoholu. Některé běžné jsou uvedeny níže.
| Hoodův roztok | |
| 70-.80% ethylalkohol | 95 cm3 |
| Glycerin | 5 cm3 |
| Kahleův roztok | |
| 95%. Ethylalkohol | 30 cm3 |
| Formaldehyd | 12 cm3 |
| Kyselina ledová octová | 4 cm3 |
| Voda | 60 cm3 |
| Alkoholový Bouinův roztok | |
| 80% etylalkohol | 150 cm3 |
| Formaldehyd | 60 cm3 |
| Kyselina ledová octová | 15 cm3 |
| Kyselina citronová | 1g |
Když už jsme u těch roztoků, Ethylacetát může být na larvy často neúčinný, proto zde uvádíme přípravky na hubení, které jsou dostačující:
| SměsKAAD | |
| 95% ethylalkohol | 70-100 cm3 |
| Kerosen (snížit pro larvy s měkkým tělem, jako jsou larvy) | 10 cm3 |
| Kyselina ledová octová | 20 cm3 |
| Dioxan | 10 cm3 |
| XA směs | |
| 95% ethylacetát | 50 cm3 |
| Xylen | 50 cm3 |
Obě metody by měly trvat 1/2 – 4 hodiny. Všechna známá usmrcovací činidla odstraňují barvu, zejména zelenou, dovolují a červenou.
Typicky by se konzervované exempláře měly kontrolovat jednou až dvakrát ročně, zda se z nich neodpařila nějaká tekutina. Pokud ano, měla by být vyměněna.
Montáž na mikroskopická sklíčka: Existují dva typy mikroskopických podložek: trvalé a dočasné. Používají se různá montážní média a u dočasných montáží se vzorky po montáži obvykle vracejí do konzervačního prostředku, kde mohou být uchovávány po neomezenou dobu. Trvalé montáže se montují jednou a pak už je nelze vyjmout, mohou však vydržet poměrně dlouho, i několik let.
Mnoho hmyzu s měkkým tělem lze vložit přímo do montážního média, některé je však třeba nejprve očistit ve speciální tekutině. K tomu se používají především roztoky KOH a Nesbittův roztok. Tento proces často zahrnuje namáčení hmyzu po dobu několika hodin až mnoha dní, pokud se provádí za studena, ačkoli jej lze provést rychleji pomocí tepla a KOH.
Malé exempláře lze upevnit do běžného sklíčka, zatímco větší mohou potřebovat sklíčko s prohlubní nebo podpěru pro krycí sklo.
Mezi média používaná pro dočasné upevnění na sklíčka patří voda, alkohol, glycerin a glycerinové želé. Voda a alkohol mohou vydržet jen několik minut, než se odpaří, takže glycerin se obvykle používá, pokud chceme exempláře studovat delší dobu.
Tím končí tento příspěvek a část o konzervaci Borror, Delong a Triplehorn. Většina zbývající práce na tomto SOS bude spočívat v sestavení mých dokumentů a diapozitivů, stejně jako v ujištění, že mé vývojové diagramy a protokol jsou v pořádku.
