 Open Access Article
Open Access Article Tento článek s otevřeným přístupem je licencován pod licencí
Tento článek s otevřeným přístupem je licencován pod licencí
Creative Commons Attribution 3.0 Unported Licence
Guoqiang Liua, Yongsan Liab, Lei Yangd, Yen Weia, Xing Wangb, Zhiming Wangc a Lei Tao *a
*a
aKlíčová laboratoř bioorganické fosforové chemie & chemické biologie (Ministerstvo školství), katedra chemie, Tsinghua University, Peking 100084, P. R. Čína. E-mail: [email protected]
bStátní klíčová laboratoř inženýrství chemických zdrojů, Pekingská univerzita chemické technologie, Peking 100029, P. R. Čína
cVysoká škola farmaceutické vědy, Zhejiang Chinese Medical University, Hangzhou, Zhejiang 311400, P. R. Čína. China
dCancer Institute &Hospital, Peking Union Medical College & Chinese Academy of Medical Science, Beijing 100021, P. R. China
Poprvé publikováno 27. března 2017
Polyethylenglykolové (PEG) deriváty se široce používají v biologickém výzkumu. Nicméně oligomery PEG (s různou molekulovou hmotností) nebo monomery na bázi PEG (s různými skupinami na konci řetězce) mají ve skutečnosti různé chemické a fyzikální vlastnosti, což může vést k potenciální toxicitě. V této práci byla měřena cytotoxicita řady derivátů PEG (oligomerů a monomerů) za použití lidských buněk rakoviny děložního čípku (HeLa) a buněčné linie myších fibroblastů (L929) jako modelových buněk. Většina oligomerů PEG je bezpečná pro oba typy buněk s výjimkou triethylenglykolu (TEG), který je ve vysokých koncentracích toxický pro buňky L929. Na druhé straně monomery na bázi PEG, včetně poly(ethylenglykol) methyletherakrylátu (mPEGA) a poly(ethylenglykol) methylethermethakrylátu (mPEGMA), vykazovaly zjevnou cytotoxicitu. Následně byly tyto toxické deriváty PEG studovány s cílem odhalit různé mechanismy jejich toxicity. Tento současný výzkum vyhodnotil cytotoxicitu derivátů PEG a poukázal na potenciální nebezpečí „bezpečných“ biomateriálů, což může lidem nabídnout užitečné vodítko pro použití derivátů PEG v budoucím biomedicínském výzkumu.
Úvod
Polyethylenglykol (PEG) se široce uplatňuje v různých lékařských oborech díky svým vynikajícím vlastnostem, jako je uspokojivá bezpečnost, biokompatibilita, hydrofilita atd. PEG se například používá v některých projímadlech schválených Úřadem pro potraviny a léčiva díky své vynikající schopnosti zadržovat vlhkost a lubrikaci.1-3 Dalším příkladem je modifikace léčiv/proteinů pomocí PEG (PEGylace), která může účinně zlepšit jejich rozpustnost ve vodě a poločas cirkulace léčiv,4,5 což vede ke zvýšení bezpečnosti a účinků terapie. Ve skutečnosti se PEGylace stává jednou z nejatraktivnějších biotechnologií a dosahuje obrovských úspěchů v základním výzkumu i na trhu.6-11 V současné době se mnoho derivátů PEG používá jako vynikající výchozí materiály pro syntézu řady nových polymerních materiálů pro bioaplikace.12 Například lineární PEG byl modifikován jako difunkcionalizovaný PEG (DF-PEG), který by mohl být použit k rychlému vytvoření zajímavého samohojivého hydrogelu.13,14 Některé oligomery PEG byly použity k modifikaci povrchu anorganických nanočástic za účelem zlepšení rozpustnosti ve vodě a snížení toxicity těchto anorganických materiálů15.-17 Některé komerční monomery na bázi PEG, jako je poly(ethylenglykol) methylether akrylát (mPEGA) a poly(ethylenglykol) methylether methakrylát (mPEGMA), byly použity k přípravě rozvětvených polymerů pro následnou konjugaci proteinů, samoskladbu, podávání léčiv atd.18-27
Ačkoli je PEG obvykle považován za téměř netoxický, výzkumníci zaznamenali některé nebezpečné problémy PEG s nízkou molekulovou hmotností. Smyth a kol. uvedli chronickou orální toxicitu oligomeru PEG (Mn ∼ 200) u potkanů,28,29 nepříznivé výsledky byly pozorovány také u opic,30 což naznačuje možné bezpečnostní problémy těchto „bezpečných“ materiálů. Vzhledem k širokému využití derivátů PEG ve výzkumných oblastech je proto systematické studium cytotoxicity těchto PEG oligomerů a monomerů na bázi PEG nezbytné a důležité pro jejich další využití v biologických oborech (Schéma 1).
V této práci byla hodnocena cytotoxicita některých oligomerů PEG (s různou molekulovou hmotností) a komerčních monomerů na bázi PEG (s různými koncovými skupinami řetězců) k lidským buňkám karcinomu děložního hrdla (HeLa) a buněčné linii fibroblastů odvozených od myší (L929). Byla pozorována cytotoxicita oligomerů PEG závislá na molekulové hmotnosti a poprvé byly odhaleny různé mechanismy cytotoxicity oligomerů PEG a monomerů na bázi PEG. Tyto informace o cytotoxicitě derivátů PEG by mohly být cenným vodítkem pro výběr PEG jako výchozích materiálů a návrh purifikačních postupů pro přípravu biokompatibilních materiálů na bázi PEG pro další biomedicínské aplikace.
Materiály a metody
2.1 Chemikálie
Triethylenglykol (TEG, 97%, HEOWNS), PEG-400 (Mn ∼ 400, TCI), PEG-1000 (Mn ∼ 1000, Jiangsu Haitian Petrochemical Works), PEG-2000 (Mn ∼ 2000, SCRC), PEG-4000 (Mn ∼ 4000, SCRC), poly(ethylenglykol) methylether akrylát 480 (mPEGA-480, Mn ∼ 480, Sigma-Aldrich), poly(ethylenglykol) methylétermetakrylát 500 (mPEGMA-500, Mn ∼ 500, Sigma-Aldrich) a poly(ethylenglykol) methylétermetakrylát 950 (mPEGMA-950, Mn ∼ 950, Sigma-Aldrich) byly použity přímo bez dalšího čištění.
Lidské buňky karcinomu děložního hrdla (HeLa) a buněčná linie fibroblastů odvozených od myší (L929) byly získány z American type culture collection (ATCC). Dulbeccovo modifikované orlí médium (DMEM, Corning-Cellgro), fosfátový pufrovaný solný roztok (PBS, pH ∼ 7,2-7,4, 0,01 M, Solarbio), fetální hovězí sérum (FBS, Gibco), kultivační médium Roswell Park Memorial Institute 1640 (RPMI 1640, Gibco), roztok penicilinu a streptomycinu (Gibco), trypsin-EDTA (Gibco, 0.25 %), 4-(3-(2-methoxy-4-nitrofenyl)-2-(4-nitrofenyl)-2H-tetrazol-3-ium-5-yl)benzen-1,3-disulfonát (CCK-8, Beyotime), 2,7-dichlorodihydrofluorescein diacetát (DCFH-DA, Beyotime), oxidovaný glutathion (GSSG, Beyotime), nikotinamidadenindinukleotidfosfát (NADPH, Beyotime), 5,5′-dithiobis-(2-nitrobenzoová kyselina) (DTNB, Beyotime), fluorescein diacetát (FDA, Sigma) a propidium jodid (PI, 94 %, Sigma) byly použity jako zakoupené.
2.2 Buněčná kultura
Buněčná kultura byla udržována v inkubátoru o teplotě 37 °C s 5 % CO2, kultivační médium bylo měněno každý jeden nebo dva dny pro udržení exponenciálního růstu buněk. Buňky HeLa byly odvozeny z buněk rakoviny děložního čípku a byly kultivovány v médiu DMEM doplněném 10% fetálním hovězím sérem (FBS) a 1% penicilinem a streptomycinem. Buňky L929 byly odvozeny z myší a kultivovány v médiu RPMI 1640 doplněném 10% fetálním hovězím sérem (FBS) a 1% penicilinem a streptomycinem.
2.3 Analýza cytotoxicity
Výsledky byly prezentovány jako průměr ± směrodatná odchylka (SD) a hodnoty poloviční maximální inhibiční koncentrace 50% (IC50) derivátů PEG byly vypočteny pomocí programu SPSS 15.0.
Podle naší předchozí práce32,33 lze fluorescein diacetát (FDA) a propidium jodid (PI) použít jako rychlou a vhodnou metodu dvojitého barvení pro pozorování životaschopnosti buněk. Buňky L929 byly nasazeny do 24jamkové destičky v hustotě ∼5 × 104 buněk na ml. Po navázání byly buňky promyty PBS a kultivovány s různými koncentracemi derivátů PEG v kultivačním médiu po dobu 24 h. Poté bylo médium odstraněno, buňky byly promyty PBS. Následně byl přidán směsný roztok PBS-FDA-PI (FDA: 3 μg ml-1; PI: 3 μg ml-1) a 24jamková destička byla inkubována při 37 °C po dobu 15 minut. K pozorování živých a mrtvých buněk byl použit fluorescenční mikroskop (Leica Germany) pod excitačními filtry s pásmovou propustí 450-490 nm (I3) a 515-560 nm (N2.1) (100 W rtuťová lampa).
Krátce, buňky L929 byly nasazeny do 24jamkové destičky a inkubovány v 0,5 ml kultivačního média s různou koncentrací TEG (A, A′) po dobu 1 h (obr. 1). 1), jamky A1-A6 byly použity k měření celkového množství glutathionu (GSH + GSSG), zatímco jamky A′1-A′6 byly použity k měření množství oxidovaného glutathionu (GSSG) v přítomnosti TEG. Po 1 hodině byly buňky odebrány trypsinem a odstředěny (1000 otáček za minutu, 5 min). Poté byl přidán trojnásobný objem roztoku pro odstranění proteinů (50 mg ml-1), aby se odstranily hlučné proteiny. Po trojnásobném rychlém zmrazení a rozmrazení v tekutém dusíku a vodní lázni o teplotě 37 °C byla suspenze umístěna na 5 min do chladničky (4 °C) a vzorky buněčného supernatantu byly získány po centrifugaci (10 000 ot./min, 10 min). Vzorky z jamek A1-A6 byly použity k měření celkové hladiny glutathionu (GSH + GSSG). Roztok NADPH (0,5 mg ml-1) byl přidán k redukci veškerého glutathionu na GSH, poté byla k oxidaci GSH použita 5,5′-dithiobis-(2-nitrobenzoová kyselina) (DTNB), změněná absorbance při 405 nm byla zaznamenána mikrodestičkovou čtečkou (VICTOR™ X3 PerkinElmer 2030 Multilabel Plate Reader).35,36 Vzorky z jamek s A′1-A′6 byly použity k měření hladiny oxidovaného glutathionu (GSSG). Použitím roztoku odstraňovače GSH byl v roztoku vzorku ponechán pouze GSSG. Vzorky byly analyzovány stejnou metodou jako výše uvedené vzorky pro měření hladiny GSSG. Pro výpočet hladiny redukovaného glutathionu bylo odebráno celkové množství glutathionu a množství oxidovaného glutathionu, zatímco jako kontrola byla použita hladina GSH buněk v čistém kultivačním médiu. Výsledky byly prezentovány jako průměr ± SD.
000 ot./min, 10 min). Vzorky z jamek A1-A6 byly použity k měření celkové hladiny glutathionu (GSH + GSSG). Roztok NADPH (0,5 mg ml-1) byl přidán k redukci veškerého glutathionu na GSH, poté byla k oxidaci GSH použita 5,5′-dithiobis-(2-nitrobenzoová kyselina) (DTNB), změněná absorbance při 405 nm byla zaznamenána mikrodestičkovou čtečkou (VICTOR™ X3 PerkinElmer 2030 Multilabel Plate Reader).35,36 Vzorky z jamek s A′1-A′6 byly použity k měření hladiny oxidovaného glutathionu (GSSG). Použitím roztoku odstraňovače GSH byl v roztoku vzorku ponechán pouze GSSG. Vzorky byly analyzovány stejnou metodou jako výše uvedené vzorky pro měření hladiny GSSG. Pro výpočet hladiny redukovaného glutathionu bylo odebráno celkové množství glutathionu a množství oxidovaného glutathionu, zatímco jako kontrola byla použita hladina GSH buněk v čistém kultivačním médiu. Výsledky byly prezentovány jako průměr ± SD.
Stejným postupem bylo testováno celkové množství GSH a GSSG v přítomnosti mPEGA-480 v jamkách v řadě B a B′.
Výsledky a diskuse
3.1 Studium životaschopnosti buněk
Při použití buněk HeLa (model nádorových buněk) (obr. 2A) bylo možné zanedbat cytotoxicitu všech oligomerů PEG v nízkých koncentracích (≤5 mg ml-1). Při zvýšení koncentrace (≥10 mg ml-1) byla pozorována cytotoxicita vzorků PEG závislá na molekulové hmotnosti. U triethylenglykolu (TEG) byla zřejmá cytotoxicita nad 10 mg ml-1 (p < 0,05; na rozdíl od všech ostatních oligomerů při koncentraci nad 5 mg ml-1) a hodnota IC50 TEG pro buňky HeLa byla vypočtena jako 19,8 mg ml-1. Mezitím ostatní oligomery PEG (Mn ∼ 400-4000) rovněž vykazovaly nepatrnou cytotoxicitu.
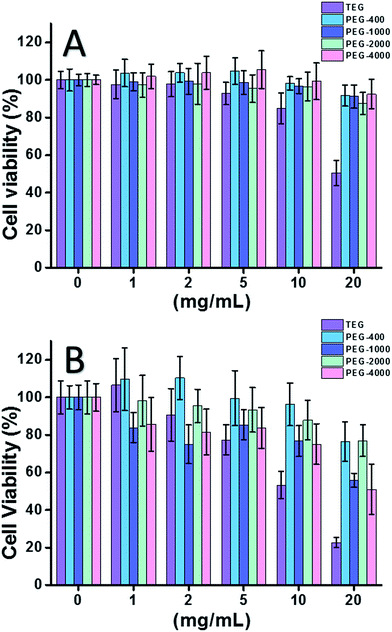
Byla rovněž hodnocena cytotoxicita oligomerů PEG vůči buňkám L929 (model normálních buněk) (obr. 2B). Životaschopnost buněk se podle očekávání snižovala se zvyšující se koncentrací PEG. Kromě TEG vykazovaly detekovatelnou cytotoxicitu také některé oligomery PEG (PEG-1000, PEG-4000), které jsou pro buňky HeLa bezpečné; hodnoty IC50 TEG, PEG-1000 a PEG-4000 byly vypočteny jako 12,4, 22,5 a 20,0 mg ml-1 pro buňky L929, což rovněž ukazuje na cytotoxicitu oligomerů PEG závislou na molekulové hmotnosti.
Výše uvedené výsledky naznačují, že buňky HeLa mají lepší toleranci k oligomerům PEG než buňky L929 vzhledem k houževnaté vitalitě nádorových buněk a TEG má mnohem vyšší cytotoxicitu než ostatní oligomery PEG s vyšší molekulovou hmotností (p < 0,05; kontrast s jakýmkoli jiným oligomerem při koncentraci nad 5 mg ml-1). Je patrné, že současný výzkum prokázal mírnou cytotoxicitu PEG-1000 a PEG-4000 pro buňky L929 a téměř žádnou cytotoxicitu PEG-400 a PEG-2000, což se liší od běžného dojmu, že vysokomolekulární PEG by měly být biokompatibilnější než jejich nízkomolekulární protějšky. Ačkoli důvod cytotoxicity PEG stále není jasný, PEG-400 a PEG-2000 se zdají být lepší volbou pro lidi, kteří chtějí syntetizovat biokompatibilní materiály.
Při testování mPEGMA-500 se životaschopnost buněk HeLa i L929 snižovala se zvyšující se koncentrací mPEGMA-500 (obr. 3A) a nebyl pozorován žádný zjevný rozdíl mezi oběma typy buněk. Hodnoty IC50 mPEGMA-500 jsou 4,7 mg ml-1 pro buňky HeLa a 5,3 mg ml-1 pro buňky L929 po 24hodinové kultivaci, což naznačuje výraznější cytotoxicitu mPEGMA-500 než výše uvedených oligomerů PEG a naznačuje, že pro jejich toxicitu jsou rozhodující koncové skupiny řetězce derivátů PEG. Když byl stejným postupem testován mPEGMA-950, další metakrylát na bázi PEG se stejnou koncovou skupinou řetězce, ale vyšší molekulovou hmotností (obr. 3B), byla pozorována mnohem nižší cytotoxicita mPEGMA-950 pro buňky HeLa nebo L929 (p < 0,05; při koncentraci nad 2 mg ml-1), hodnoty IC50 mPEGMA-950 jsou 20,8 mg ml-1 pro buňky HeLa a 21,5 mg ml-1 pro buňky L929.7 mg ml-1 k buňkám L929 po 24hodinové kultivaci, což rovněž prokazuje cytotoxicitu metakrylátu na bázi PEG závislou na molekulové hmotnosti.
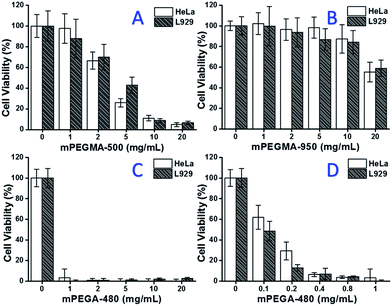
Dále byl testován také akrylát mPEGA-480 na bázi PEG. Přestože rozdíl mezi mPEGA-480 a mPEGMA-500 spočívá pouze v methylové skupině na konci řetězce, mPEGA-480 vykazoval akutní cytotoxicitu (obr. 3C). Více než 95 % buněk ztratilo životaschopnost i s 1 mg mPEGA-480 v kultivačním médiu. Proto bylo nutné provést další experimenty s nižšími koncentracemi pro stanovení jeho cytotoxicity (obr. 3D) a hodnoty IC50 mPEGA-480 byly vypočteny jako 0,2 mg ml-1 pro buňky HeLa a 0,1 mg ml-1 pro buňky L929 po 24hodinové kultivaci.
Experimenty s životaschopností buněk potvrdily, že koncové skupiny řetězce i molekulová hmotnost jsou důležitými prvky ovlivňujícími cytotoxicitu derivátů PEG a monomery na bázi PEG vykazovaly mnohem výraznější cytotoxicitu ve srovnání s oligomery PEG.
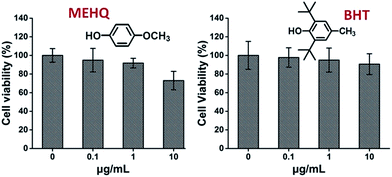
Také byla hodnocena cytotoxicita inhibitorů v monomerech na bázi PEG, hydrochinonmethyletheru (MEHQ, 100 ppm v mPEGA) a butylovaného hydroxytoluenu (BHT, 300 ppm v mPEGMA) (obr. 4) a buňky L929 si zachovaly vysokou životaschopnost (≥90 %) při nízké koncentraci inhibitorů (≤1 μg ml-1). V 1 mg mPEGA-480 je 0,1 μg mL-1 MEHQ a v 10 mg mL-1 mPEGA-500 3 μg mL-1 BHT, zatímco mPEG-480 a mPEGMA-500 vykazovaly při těchto koncentracích zjevnou cytotoxicitu. Zdá se tedy, že stopové množství inhibitorů v monomerech na bázi PEG má zanedbatelný vliv na cytotoxicitu monomerů.
3.2 Pozorování morfologie buněk
K přímému hodnocení cytotoxicity derivátů PEG na buňky L929 bylo použito pozorování optickým mikroskopem. Optické snímky buněk L929 vystavených působení 20 mg ml-1 TEG a 0,1 mg ml-1 mPEGA po dobu 24 h jsou uvedeny na obr. 5A a B.
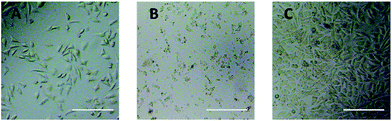
Po inkubaci s 20 mg ml-1 TEG po dobu 24 h si buňky zachovaly podobnou morfologii (obr. 5A) jako kontrolní skupina (obr. 5C, buňky v čistém kultivačním médiu), ale počet buněk dramaticky poklesl, což svědčí o cytotoxicitě TEG ve vysoké koncentraci, která vedla k odumření a následnému oddělení buněk od dna mikrotitrační destičky. Obr. 5B ukazuje morfologii buněk L929 po inkubaci s 0,1 mg ml-1 mPEGA-480. Téměř všechny buňky ztratily normální morfologii, což naznačuje akutní cytotoxicitu mPEGA-480 i při tak nízké koncentraci.
Buňky byly navíc obarveny pomocí fluoresceinu. Dvojité barvení FDA/PI je rychlý, jednoduchý a simultánní postup pro pozorování živých a mrtvých buněk.43 FDA může pronikat do kompletních buněk a hromadit se v nich, proto je nutná kompletní buněčná membrána, aby se zabránilo úniku fluoresceinu z buňky. Naproti tomu PI nemůže projít neporušenou buněčnou membránou, ale může obarvit jádro mrtvých buněk tím, že projde poškozenou buněčnou membránou. Jak ukazuje obr. 6, buňky L929 inkubované s 20 mg ml-1 TEG mají po barvení FDA méně životaschopných buněk (obr. 6b) ve srovnání s kontrolou (obr. 6a) a po barvení PI lze pozorovat více mrtvých buněk (obr. 6b). Akutní cytotoxicita mPEGA-480 byla pozorována také po dvojím barvení FDA/PI, po inkubaci buněk s 0,1 mg ml-1 mPEG-480 po dobu 24 hodin nebylo možné identifikovat žádný zelený signál (obr. 6c a c′′).
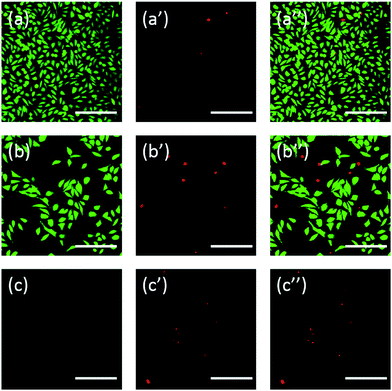
Oboje optické a fluorescenční obrazy intuitivně prokázaly cytotoxicitu těchto derivátů PEG, což dále podpořilo závěr získaný pomocí CCK-8 testů. Je patrné, že mPEGA-480 se zdál být toxičtější pomocí testu dvojitého barvení FDA/PI, což se přisuzuje tomu, že dvojité barvení FDA/PI rozlišuje úplnost živé/mrtvé buněčné membrány, zatímco test CCK-8 zjišťuje aktivitu dehydrogenázy v mitochondriích, což naznačuje, že barvení FDA/PI je vynikajícím doplňkem testu CCK-8, který nabízí více podrobností o stavu buněk.
3.3 Studium mechanismu
Podle experimentů s životaschopností buněk byly vypočteny a shrnuty hodnoty IC50 oligomerů PEG a monomerů na bázi PEG pro buňky HeLa a L929 po 24hodinové kultivaci (tabulka 1), což naznačuje, že monomery na bázi PEG jsou pro buňky mnohem toxičtější než oligomery PEG a nejvyšší cytotoxicitu má mPEGA. Proto byla analyzována tvorba ROS a pokles GSH v buňkách, dva hlavní mechanismy cytotoxicity, aby se prozkoumala možná příčina cytotoxicity.
| TEG | PEG-400 | PEG-1000 | PEG-2000 | PEG-4000 | mPEGMA-500 | mPEGMA-950 | mPEGA-480 | |
|---|---|---|---|---|---|---|---|---|
| HeLa buňky | 19.8 | 32,5 | 36,2 | 38,2 | 29,6 | 4,7 | 20,8 | 0,2 |
| L929 buňky | 12,4 | 24.7 | 22,5 | 28,7 | 20,0 | 5,3 | 21,7 | 0,1 |
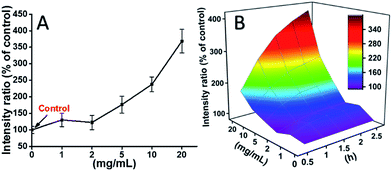
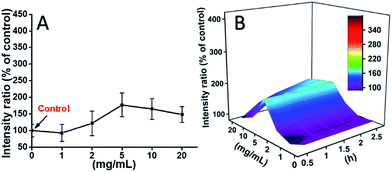
L929 buňky byly inkubovány s TEG a hladiny ROS v různých časových bodech (0, 0,5, 1,0, 1,5, 2 h) byly zjišťovány podle našich předchozích zpráv a zobrazeny na obr. 7. Na obr. 7 jsou znázorněny hladiny ROS v různých časových bodech. Jako příklad jsou na obr. 7A uvedeny hladiny ROS po inkubaci s různými koncentracemi TEG po dobu 2 h. Je jasně vidět, že hladiny ROS zůstávají stabilní při nízké koncentraci TEG (≤2 mg ml-1), ale výrazně se zvyšují, když je koncentrace TEG vyšší než 2 mg ml-1, což odpovídá výsledku experimentu s životaschopností buněk na obr. 2B. Podobně byly nakresleny obrázky závislosti hladiny ROS na koncentraci TEG v různých časových bodech a sloučeny, aby vznikla 3D mapa (obr. 7B). Maximální hladiny ROS byly zjištěny ve 2 h s 20 mg ml-1 TEG, bylo zjištěno přibližně 400% zvýšení hladiny ROS oproti kontrole (hladina ROS = 100), což vedlo k nejjasnější intenzitě fluorescence. Tyto výsledky naznačují, že tvorba ROS je možným mechanismem cytotoxicity TEG a vysoká hladina ROS vyvolaná TEG může být hlavní příčinou apoptózy buněk.
Testovány byly také hladiny ROS indukované mPEGA-480 po 2 h (obr. 8A). Na rozdíl od TEG nezpůsobil mPEGA v buňkách rychlý nárůst ROS, jako maximum bylo pozorováno pouze ∼170% zvýšení ROS ve srovnání s kontrolou. 3D zobrazení hladiny ROS v závislosti na čase mPEGA & (obr. 8B) ukázalo, že hladina ROS vyvolaná mPEGA-480 má podobu vlny a hřeben se objevil při střední koncentraci mPEGA (5 mg ml-1), nelze pozorovat žádnou významnou tvorbu ROS, což naznačuje, že tvorba ROS může k cytotoxicitě mPEGA-480 přispívat pouze částečně.
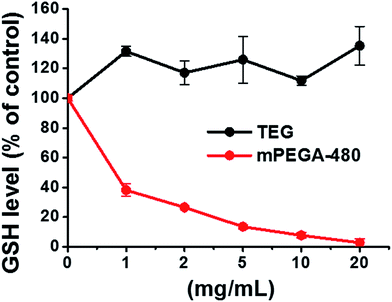
Redukující thiolová skupina v GSH je důležitým antioxidačním zdrojem v organismech. Možný mechanismus cytotoxicity mPEGA-480 je z ní připisován Michaelově adiční reakci mezi thiolovou skupinou a vinylovou vazbou, která vede k porušení intracelulární redoxní rovnováhy a apoptóze buněk. Předchozí výzkum naznačil, že Michaelova adice mezi thiolem a akrylátem je mnohem rychlejší než mezi thiolem a metakrylátem,52 což může být rozumnou příčinou rozdílné akutní cytotoxicity mezi mPEGA-480 a mPEGMA-500.
Závěry
Poprvé byla hodnocena cytotoxicita oligomerů PEG a monomerů na bázi PEG pro buňky HeLa a L929. Byla potvrzena cytotoxicita oligomerů PEG a monomerů na bázi PEG závislá na koncentraci a prezentována jako hodnoty IC50 pro buňky HeLa a L929. PEG-400, PEG-2000 se v současném výzkumu zdají být téměř necytotoxické. PEG-1000, PEG-4000 a mPEGMA-950 vykazovaly mírnou cytotoxicitu, zejména při vysokých koncentracích. TEG a mPEGMA-500 vykazovaly významnou cytotoxicitu a mPEGA-480 vykazoval akutní cytotoxicitu. Kromě toho výsledky studie cytotoxicity ovlivňují také typy buněk, HeLa buňky jsou odolnější vůči PEG derivátům než buňky L929. Tyto výsledky o cytotoxicitě derivátů PEG jsou předběžné, ale zásadní pro jejich budoucí biomedicínské využití, další informace o reakci a chování buněk na jiné deriváty PEG budou dále zkoumány.
Poděkování
Tento výzkum byl podpořen National Science Foundation of China (21574073, 21534006).
- M. V. Cleveland, D. P. Flavin, R. A. Ruben, R. M. Epstein a G. E. Clark, South. Med. J., 2001, 94, 478-481 CrossRef CAS PubMed.
- J. A. DiPalma, M. V. B. Cleveland, J. McGowan a J. L. Herrera, Am. J. Gastroenterol., 2007, 102, 1436-1441 CrossRef CAS PubMed.
- B. A. Erickson, J. C. Austin, C. S. Cooper a M. A. Boyt, J. Urol., 2003, 170, 1518-1520 CrossRef CAS PubMed.
- J. L. Cleland, S. E. Builder, J. R. Swartz, M. Winkler, J. Y. Chang a D. I. C. Wang, Bio/Technology, 1992, 10, 1013-1019 CrossRef CAS PubMed.
- Z. Liu, J. T. Robinson, X. M. Sun a H. J. Dai, J. Am. Chem. Soc., 2008, 130, 10876-10877 CrossRef CAS PubMed.
- J. M. Harris a R. B. Chess, Nat. Rev. Drug Discovery, 2003, 2, 214-221 CrossRef CAS PubMed.
- F. M. Veronese and G. Pasut, Drug Discovery Today, 2005, 10, 1451-1458 CrossR CAS PubMed.
- M. J. Roberts, M. D. Bentley a J. M. Harris, Adv. Drug Delivery Rev., 2002, 54, 459-476 CrossRef CAS PubMed.
- F. M. Veronese, Biomaterials, 2001, 22, 405-417 CrossRef CAS PubMed.
- H. Zhang, T. Zhao, P. Duffy, Y. Dong, A. Ni Annaidh, E. O’Cearbhaill and W. Wang, Adv. Healthcare Mater., 2015, 4, 2260-2268 CrossRef CAS PubMed.
- Y. Dong, Y. Qin, M. Dubaa, J. Killion, Y. Gao, T. Zhao, D. Zhou, D. Duscher, L. Geever, G. C. Gurtner a W. Wang, Polym. Chem., 2015, 6, 6182-6192 RSC.
- T. M. Allen, C. Hansen, F. Martin, C. Redemann a A. Yauyoung, Biochim. Biophys. Acta, Biomembr., 1991, 1066, 29-36 CrossRef CAS.
- Y. L. Zhang, L. Tao, S. X. Li a Y. Wei, Biomacromolecules, 2011, 12, 2894-2901 CrossRef CAS PubMed.
- Y. L. Zhang, B. Yang, L. X. Xu, X. Y. Zhang, L. Tao a Y. Wei, Acta Chim. Sin., 2013, 71, 485-492 CrossRef CAS.
- C. C. Luo, Y. H. Zhang, X. W. Zeng, Y. W. Zeng a Y. G. Wang, J. Colloid Interface Sci., 2005, 288, 444-448 CrossRef CAS PubMed.
- S. Dhar, F. X. Gu, R. Langer, O. C. Farokhzad a S. J. Lippard, Proc. Natl. Acad. Sci. U. S. A., 2008, 105, 17356-17361 CrossRef CAS PubMed.
- J. Manson, D. Kumar, B. J. Meenan and D. Dixon, Gold Bull., 2011, 44, 99-105 CrossRef CAS.
- X. Y. Zhang, C. K. Fu, L. Feng, Y. Ji, L. Tao, Q. Huang, S. X. Li a Y. Wei, Polymer, 2012, 53, 3178-3184 CrossRef CAS.
- X. Y. Zhang, J. F. Hui, B. Yang, Y. Yang, D. D. Fan, M. Y. Liu, L. Tao a Y. Wei, Polym. Chem., 2013, 4, 4120-4125 RSC.
- D. Bontempo a H. D. Maynard, J. Am. Chem. Soc., 2005, 127, 6508-6509 CrossRef CAS PubMed.
- K. L. Heredia, Z. P. Tolstyka and H. D. Maynard, Macromolecules, 2007, 40, 4772-4779 CrossRef CAS.
- H. Hussain, K. Y. Mya a C. He, Langmuir, 2008, 24, 13279-13286 CrossRef CAS PubMed.
- J. P. Magnusson, S. Bersani, S. Salmaso, C. Alexander and P. Caliceti, Bioconjugate Chem., 2010, 21, 671-678 CrossRef CAS PubMed.
- F. J. Xu, Y. L. Li, E. T. Kang a K. G. Neoh, Biomacromolecules, 2005, 6, 1759-1768 CrossRef CAS PubMed.
- L. L. Yu, L. Yao a K. Yang, J. Porous Mater., 2016, 23, 1581-1589 CrossRef CAS.
- S. Yuan, D. Wan, B. Liang, S. O. Pehkonen, Y. P. Ting, K. G. Neoh a E. T. Kang, Langmuir, 2011, 27, 2761-2774 CrossRef CAS PubMed.
- S. A, Q. Xu, D. Zhou, Y. Gao, J. M. Vasquez, U. Greiser, W. Wang, W. Liu a W. Wang, Polym. Chem., 2017, 8, 1283-1287 RSC.
- H. F. Smyth, C. P. Carpenter a C. S. Weil, J. Am. Pharm. Assoc., 1950, 39, 349-354 CrossRef CAS.
- H. F. Smyth, C. P. Carpenter a C. S. Weil, J. Am. Pharm. Assoc., 1955, 44, 27-30 CrossRef CAS.
- D. E. Prentice a S. K. Majeed, Toxicol. Lett., 1978, 2, 119-122 CrossRef CAS.
- H. Tominaga, M. Ishiyama, F. Ohseto, K. Sasamoto, T. Hamamoto, K. Suzuki a M. Watanabe, Anal. Commun., 1999, 36, 47-50 RSC.
- Y. Li, Y. Zhang, F. Shi, L. Tao, Y. Wei a X. Wang, Colloids Surf., B, 2016, 149, 168-173 CrossRef PubMed.
- B. Yang, Y. Zhang, X. Zhang, L. Tao, S. Li a Y. Wei, Polym. Chem., 2012, 3, 3235-3238 RSC.
- H. Wang a J. A. Joseph, Free Radical Biol. Med., 1999, 27, 612-616 CrossRef CAS PubMed.
- I. K. Smith, T. L. Vieweller a C. A. Thorne, Anal. Biochem., 1988, 175, 408-413 CrossRef CAS PubMed.
- I. Rahman, A. Kode a S. K. Biswas, Nat. Protoc., 2006, 1, 3159-3165 CrossRef CAS PubMed.
- R. Jevprasesphant, J. Penny, R. Jalal, D. Attwood, N. B. McKeown a A. D’Emanuele, Int. J. Pharm., 2003, 252, 263-266 CrossRef CAS PubMed.
- A. K. Gupta a S. Wells, IEEE Trans. Nanobioscience, 2004, 3, 66-73 CrossRef PubMed.
- D. Luo, K. Haverstick, N. Belcheva, E. Han a W. M. Saltzman, Macromolecules, 2002, 35, 3456-3462 CrossRef CAS.
- C. W. Chang, E. Bays, L. Tao, S. N. S. Alconcel a H. D. Maynard, Chem. Commun., 2009, 3580-3582 RSC.
- B. D. Fairbanks, P. A. Gunatillake a L. Meagher, Adv. Drug Delivery Rev., 2015, 91, 141-152 CrossRef CAS PubMed.
- T. Zhou, Y. Zhu, X. Li, X. Liu, K. W. K. Yeung, S. Wu, X. Wang, Z. Cui, X. Yang a P. K. Chu, Prog. Mater. Sci., 2016, 83, 191-235 CrossRef CAS.
- K. H. Jones a J. A. Senft, J. Histochem. Cytochem., 1985, 33, 77-79 CrossRef CAS PubMed.
- M. Hayyan, M. A. Hashim a I. M. AlNashef, Chem. Rev., 2016, 116, 3029-3085 CrossRef CAS PubMed.
- A. Lankoff, W. J. Sandberg, A. Wegierek-Ciuk, H. Lisowska, M. Refsnes, B. Sartowska, P. E. Schwarze, S. Meczynska-Wielgosz, M. Wojewodzka a M. Kruszewski, Toxicol. Lett., 2012, 208, 197-213 CrossRef CAS PubMed.
- Y. Chang, S.-T. Yang, J.-H. Liu, E. Dong, Y. Wang, A. Cao, Y. Liu a H. Wang, Toxicol. Lett., 2011, 200, 201-210 CrossRef CAS PubMed.
- X. Cai, J. Hao, X. Zhang, B. Yu, J. Ren, C. Luo, Q. Li, Q. Huang, X. Shi, W. Li a J. Liu, Toxicol. Appl. Pharmacol., 2010, 243, 27-34 CrossRef CAS PubMed.
- S. J. Park, Y. C. Park, S. W. Lee, M. S. Jeong, K.-N. Yu, H. Jung, J.-K. Lee, J. S. Kim a M.-H. Cho, Toxicol. Lett., 2011, 207, 197-203 CrossRef CAS PubMed.
- K. Pulskamp, S. Diabate a H. F. Krug, Toxicol. Lett., 2007, 168, 58-74 CrossRef CAS PubMed.
- A. M. Studer, L. K. Limbach, L. Van Duc, F. Krumeich, E. K. Athanassiou, L. C. Gerber, H. Moch a W. J. Stark, Toxicol. Lett., 2010, 197, 169-174 CrossRef CAS PubMed.
- T. Thurnherr, C. Brandenberger, K. Fischer, L. Diener, P. Manser, X. Maeder-Althaus, J.-P. Kaiser, H. F. Krug, B. Rothen-Rutishauser a P. Wick, Toxicol. Lett. 2011, 200, 176-186 CrossRef CAS PubMed.
- G. Li, R. K. Randev, A. H. Soeriyadi, G. Rees, C. Boyer, Z. Tong, T. P. Davis, C. R. Becer a D. M. Haddleton, Polym. Chem., 2010, 1, 1196-1204 RSC.
