Den almindeligt anvendte lange form af det periodiske system er designet til at fremhæve elektronkonfigurationer. Da det er de yderste (valens)elektroner, der primært er involveret i kemiske vekselvirkninger mellem atomer, er den sidste elektron, der tilføjes til et atom i opbygningsprocessen, af langt større interesse for en kemiker end den første. Denne sidste elektron kaldes den adskilte elektron, fordi den adskiller et atom fra det umiddelbart foregående atom i det periodiske system. Den type af underskal (s, p, d, f), som den særlige elektron er placeret i, er meget tæt forbundet med et grundstofs kemiske opførsel og giver anledning til den klassificering, der er vist ved farvekodningen på det periodiske system, som ses her. De repræsentative grundstoffer er de grundstoffer, hvor den særlige elektron indgår i ans- eller p-underskallen. De fleste af de grundstoffer, hvis kemi og valens vi har diskuteret indtil nu, falder ind under denne kategori. Mange af de repræsentative grundstoffers kemiske egenskaber kan forklares på grundlag af Lewis-diagrammer. Det vil sige, at de repræsentative grundstoffers valenser kan forudsiges på grundlag af antallet af valenselektroner, de har, eller ud fra det antal elektroner, der skal tilføjes for at opnå den samme elektronkonfiguration som et atom af en ædelgas. For repræsentative grundstoffer er antallet af valenselektroner det samme som det periodiske gruppetal, og det antal, der skal til for at matche den næste ædelgaskonfiguration, er 8 minus gruppetallet. Dette stemmer overens med de valensregler, der er afledt af det periodiske system, og resulterer i formler for chlorider af det første dusin grundstoffer, der viser den periodiske variation af valens.
| Element | Atomvægt | Vedstofforbindelser | Syreforbindelser | Oxygenforbindelser | Klorforbindelser |
|---|---|---|---|---|---|
| Vedstof | 1.01 | H2 | H2O, H2O2 | HCl | |
| Helium | 4.00 | Ingen dannet | Ingen dannet | Ingen dannet | |
| Lithium | 6.94 | LiH | Li2O, Li2O2 | LiCl | |
| Beryllium | 9.01 | BeH2 | BeO | BeCl2 | |
| Boron | 10.81 | B2H6 | B2O3 | BCl3 | |
| Kulstof | 12.01 | CH4, C2H6, C3H8 | CO2, CO, C2O3 | CCl4, C2Cl6 | |
| Stickstof | 14.01 | NH3, N2H4, HN3 | N2O, NO, NO2, N2O5 | NCl3 | |
| Oxygen | 16.00 | H2O, H2O2 | O2, O3 | <Cl2O, ClO2, Cl2O7 | |
| Fluorin | 19.00 | HF | OF2, O2F2 | ClF, ClF3, ClF5 | |
| Neon | 20.18 | Ingen dannet | Ingen dannet | Ingen dannet | |
| Natrium | 22.99 | NaH | Na2O, Na2O2 | NaCl | |
| Magnesium | 24.31 | MgH2 | MgO | MgCl2 |
De tre første vandrette rækker eller perioder i det moderne periodiske system består udelukkende af repræsentative grundstoffer. I den første periode er de karakteristiske elektroner for H og He i 1s underskallen. På tværs af den anden periode har Li og Be karakteristiske elektroner i 2s underskallen, og der tilføjes elektroner til 2p underskallen i atomerne fra B til Ne. I den tredje periode fylder 3s underskallen for Na og Mg, og dermed Al, Si, P, S, Cl og Ar. Som en generel regel vil den karakteristiske elektron for de repræsentative grundstoffers vedkommende befinde sig i en ns eller np underskal. Værdien af n, det vigtigste kvantetal for den særlige elektron, kan hurtigt bestemmes ved at tælle nedad fra toppen af det periodiske system. F.eks. er jod et repræsentativt grundstof i den femte periode. Derfor må den karakteristiske elektron være placeret i enten 5s eller 5p underskallen. Da I er på højre side af tabellen, er 5p det korrekte valg.
Når hovedkvantetallet er tre eller mere, er d-type underskaller også mulige. Overgangselementerne eller overgangsmetallerne er de grundstoffer, hvis kendetegnende elektron findes i en d-orbital. De første eksempler på overgangsmetaller (Sc, Ti, V, Cr, Cr, Mn, Fe, Co, Ni, Cu, Zn) findes i den fjerde periode, selv om den kendetegnende elektron i hvert enkelt tilfælde er en 3d-elektron og tilhører den tredje skal. Denne hiatus skyldes, som vi allerede har set, at 4s er lavere i energi end 3d-elektronen. 4s orbitalet begynder således at fylde op og begynder den fjerde periode, før nogen af 3d orbitalerne kan blive besat.
Figur \(\PageIndex{1}\) sammenligner sandsynlighedsfordelingerne for en 4s og en 3d elektron i et V atom. Selv om 4s-elektronskyen i gennemsnit ligger længere væk fra kernen end 3d-skyen, findes en lille del af 4s-elektrontætheden meget tæt på kernen, hvor den næppe er afskærmet fra den samlede kerneladning på +23. Det er den meget stærke tiltrækningskraft fra denne lille del af den samlede 4s-elektrontæthed, der sænker 4s-elektronens energi til under 3d-elektronens.
_and_4s_(color)_Electron_Clouds.jpg?revision=1)
Den kendsgerning, at 4s elektronskyen er mere omfattende end 3d, har en vigtig indflydelse på overgangsstoffernes kemi. Når et atom som V (Figur \(\PageIndex{1}\) ) interagerer med et andet atom, er det de 4s elektroner, der strækker sig længst væk fra kernen, der først kommer i kontakt med det andet atom. Derfor er 4s elektronerne ofte mere betydningsfulde end 3d-elektronerne, når det gælder om at bestemme valens og forbindelsers formler. 3d-elektronerne er “begravet” under overfladen af atomerne i overgangsmetallerne. Tilføjelse af endnu en 3d-elektron har betydeligt mindre indvirkning på deres kemiske egenskaber end tilføjelse af endnu en 3s eller 3p-elektron havde i forbindelse med de repræsentative grundstoffer. Derfor er der en langsom, men støt overgang i egenskaberne fra det ene overgangselement til det andet. Bemærk f.eks. at bortset fra Sc danner alle overgangsmetallerne chlorider, MCl2, hvor metallet har en valens på 2; eksempler herpå er TiCl2, VCl2, CrCl2 osv. Dette kan ses i tabellen, der findes øverst på denne side. Valens 2 svarer til de to 4s valenselektroner.
Hvert overgangsmetal udviser også andre valenser, hvor en eller flere af 3d-elektronerne også er involveret. For eksempel har V (vanadium) i nogle forbindelser en valens på 2 (VO, VCl2), i andre har det en valens på 3 (V2O3, VCl3), i endnu andre har det en valens på 4 (VO2, VCl4), og i mindst ét tilfælde (V2O5) har det en valens på 5. Overgangsmetallernes kemi er mere kompliceret, og der er flere forskellige formler for overgangsmetalforbindelser mulige på grund af denne variable valens. I nogle tilfælde fungerer elektronerne i d-underskallen som valenselektroner, mens de i andre tilfælde ikke gør det. Selv om 3d-elektronskyerne ikke strækker sig længere væk fra kernen end 3s og 3p (og derfor ikke udgør endnu en skal, som 4selektronerne gør), er de grundigt afskærmet fra kerneladningen og fungerer derfor ofte som valenselektroner. Denne Jekyll og Hyde-adfærd hos 3d-elektroner gør livet mere kompliceret (og ofte langt mere interessant) for kemikere, der studerer overgangselementerne.
| Z | Element | Konfiguration | |
|---|---|---|---|
| 1 | H | 1s 1 | |
| 2 | He | 1s 2 | |
| 3 | Li | 2s 1 | 4 | Be | 2s 2 |
| 5 | B | 2s 2 2p1 | |
| 6 | C | 2s 2 2p2 | |
| 7 | N | 2s 2 2p3 | |
| 8 | 0 | 2s 2 2 2p4 | |
| 9 | F | 2s 2 2p5 | 10 | Ne | 2s 2 2 2p6 |
| 11 | Na | 3s 1 | |
| 12 | Mg | 3s 2 | |
| 13 | Al | 3s 2 3p1 | |
| 14 | Si | 3s 2 3p2 | |
| 15 | P | 3s 2 3p3 | |
| 16 | S | 3s 2 3p4 | |
| 17 | Cl | 3s 2 3p5 | |
| 18 | Ar | 3s 2 3p6 | |
| 19 | K | 4s 1 | |
| 20 | Ca | 4s 2 | 21 | Sc | 3d 1 4s 2 |
| 22 | Ti | 3d 2 4s 2 | 3d 2 4s 2 | 23 | V | 3d 3 4s 2 |
| 24 | Cr | 3d 5 4s 1 | |
| 25 | Mn | 3d 5 4s 2 | |
| 26 | Fe | 3d 6 4s 2 | |
| 27 | Co | 3d 7 4s 2 | |
| 28 | Ni | 3d 8 4s 2 | |
| 29 | Cu | 3d 10 4s 1 | 30 | Zn | 3d 10 4s 2 |
| 31 | Ga | 3d 10 4s 2 4p 1 | |
| 32 | Ge | 3d 10 4s 2 4p 2 | |
| 33 | As | 3d 10 4s 2 4p 3 | |
| 34 | Se | 3d 10 4s 2 4p 4 | 35 | Br | 3d 10 4s 2 4p 5 |
| 36 | Kr | 3d 10 4s 2 4p 6 | |
| 37 | Rb | 5s 1 | |
| 38 | Sr | 5s 2 | |
| 39 | Y | 4d 1 5s 2 | |
| 40 | Zr | 4d 2 5s 2 | |
| 41 | Nb | 4d 4 5s 1 | |
| 42 | Mo | 4d 5 5s 1 | |
| 43 | Tc | 4d 5 5 5s 2 | |
| 44 | Ru | 4d 7 5s 1 | 45 | Rh | 4d 8 5s 1 |
| 46 | Pd | 4d 10 | |
| 47 | Ag | 4d 10 5s 1 | |
| 48 | Cd | 4d 10 5s 2 | |
| 49 | In | 4d 10 5s 2 5p 1 | |
| 50 | Sn | 4d 10 5s 2 5p 2 | |
| 51 | Sb | 4d 10 5s 2 5p 3 | |
| 52 | Te | 4d 10 5s 2 5p 4 | |
| 53 | I | 4d 10 5s 2 5p 5 | 54 | Xe | 4d 10 5s 2 5p 6 |
| 55 | Cs | 6s 1 | |
| 56 | Ba | 6s 2 | |
| 57 | 57 | La | 5d 1 6s 2 | 58 | Ce | 4f 1 5d 1 6s 2 |
| 59 | Pr | 4f 3 6s 2 | |
| 60 | Nd | 4f 4 6s 2 | |
| 61 | Pm | 4f 5 6s 2 | |
| 62 | Sm | 4f 6 6s 2 | |
| 63 | Eu | 4f 7 6s 2 | |
| 64 | Gd | 4f 7 5d 1 6s 2 | 65 | Tb | 4f 9 6s 2 |
| 66 | Dy | 4f 10 6s 2 | |
| 66 | Dy | 4f 10 6s 2 | |
| 67 | Ho | 4f 11 6s 2 | |
| 68 | Er | 4f 12 6s 2 | |
| 69 | Tm | 4f 13 6s 2 | |
| 70 | Yb | 4f 14 6s 2 | |
| 71 | Lu | 4f 14 5d 1 6s 2 | 72 | Hf | 4f 14 5d 2 6s 2 |
| 73 | Ta | 4f 14 5d 3 6s 2 | |
| 74 | W | 4f 14 5d 4 6s 2 | |
| 75 | Re | 4f 14 5d 5 6s 2 | |
| 76 | 0s | 4f 14 5d 6 6s 2 | 77 | Ir | 4f 14 5d 7 6s 2 |
| 78 | Pt | 4f 14 5d 9 6s 1 | 79 | Au | 4f 14 5d 10 6s 1 |
| 80 | Hg | 4f 14 5d 10 6s 2 | |
| 81 | Tl | 4f 14 5d 10 6s 2 6p1 | |
| 82 | Pb | 4f 14 5d 10 6s 2 6p2 | |
| 83 | Bi | ||
| 83 | Bi | 4f 14 5d 10 6s 2 6p 3 | |
| 84 | Po | 4f 14 5d 10 6s 2 6p 4 | |
| 85 | At | 4f 14 5d 10 6s 2 6p 5 | |
| 86 | Rn | 4f 14 5d 10 6s 2 6p 6 | |
| 87 | Fr | 7s 1 | |
| 88 | Ra | 7s 2 | |
| 89 | Ac | 6d 1 7s 2 | |
| 90 | Th | 6d 2 7s 2 | |
| 91 | Pa | 5f 2 6d 1 7s 2 | |
| 92 | U | 5f 3 6d 1 7s 2 | |
| 93 | Np | 5f 4 6d 1 7s 2 | |
| 94 | Pu | 5f 6 7s 2 | |
| 95 | Am | 5f 7 7 7s 2 | |
| 96 | Cm | 5f 7 6d 1 s 2 | |
| 97 | Bk | 5f 9 s 2 | 98 | Cf | 5f 10 s 2 |
| 99 | Es | 5f 11 s 2 | |
| 100 | Fm | 5f 12 s 2 | |
| 101 | Md | 5f 13 s 2 | |
| 102 | No | 5f 14 s 2 | |
| 103 | Lr | 5f 14 6d 1 s 2 | |
| 104 | Rf | 5f 14 6d 2 s 2 |
Den tredje hovedkategori af grundstoffer opstår, når den kendetegnende elektron besætter en f-underskjold. Det første eksempel forekommer i tilfældet med lanthanoiderne (grundstoffer med atomnumre mellem 57 og 71). lanthanoiderne har den generelle elektronkonfiguration
4d104f i5s25p65d0 eller 16s2
hvor i er et tal mellem 0 og 14. I opbygningsprocessen for lanthanoiderne tilføjes der således elektroner til en underskal (4f), hvis hovedkvantetal er to mindre end det vigtigste kvantetal for den yderste orbital (6s). Tilføjelse af endnu en elektron til en indre skal, der er så dybt begravet som 4f, har kun en lille eller ingen virkning på disse grundstoffers kemiske egenskaber. De ligner alle meget lanthan (La) og kan passe ind på nøjagtig den samme plads i det periodiske system som La. De lanthanoide grundstoffer ligner hinanden så meget, at der er brug for særlige teknikker til at adskille dem. Som følge heraf blev selv nogenlunde rene prøver af de fleste af dem ikke fremstillet før 1870’erne. Efter grundstoffet actinium (Ac) følger en række atomer, hvor 5f-underskallen er udfyldende. Actinoiderne ligner Ac noget mindre end lanthanoiderne ligner La, fordi der forekommer nogle undtagelser fra den sædvanlige rækkefølge af fyldningsorbitalerne i tilfældet med Th, Pa og U (Tabel \(\PageIndex{1}\) ).
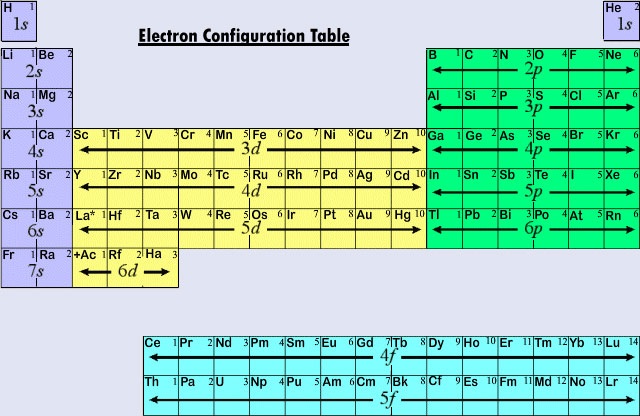
Da lanthanoiderne og de fleste af actinoiderne opfører sig kemisk set, som om de burde passe ind i gruppe IIIB i det periodiske system (hvor Lu og Lr findes), er begge grupper adskilt fra resten af systemet og placeret sammen i en blok nedenfor. Tilsammen kaldes lanthanoiderne og actinoiderne for indre overgangselementer, fordi de f underskaller, der udfyldes, ligger så dybt inde i den resterende elektroniske struktur af deres atomer.
Figur \(\PageIndex{2}\) opsummerer den type underskal, hvori den karakteristiske elektron skal findes for atomer af grundstoffer i forskellige regioner i det periodiske system. Disse sammenfattende oplysninger gør det forholdsvis enkelt at bruge det periodiske system til at få elektronkonfigurationer, som det fremgår af følgende eksempel.
Eksempel \(\PageIndex{1}\): Elektronkonfiguration
Opnå elektronkonfiguration for (a) Nb; (b) Pr.
Løsning
a) Nb, grundstof nummer 41, findes i den femte periode og i et område af det periodiske system, hvor en d-underskal fylder (den anden overgangsrække). Bevæger man sig bagud (mod lavere atomnumre) gennem det periodiske system, er den nærmeste ædelgas Kr, og vi bruger derfor Kr-kernen:
Nb _____
Det næste grundstof efter 36K er 37Rb, hvor en 5s underskal fylder. Hvis vi bevæger os endnu en plads til højre, kommer vi til 38Sr, som har et 5s2-par. Indtil videre har vi Nb _____ 5s2 for Nb-konfigurationen. Vi bevæger os nu længere til højre ind i 4d-underskallen i det periodiske system og tæller over tre felter (Y, Zr, Nb) for at nå frem til Nb. Den samlede elektronkonfiguration er således Nb 4d35s2 (Bemærk, at hovedkvantetallet for d-underskallen er 4 – én mindre end periodens tal. Hvis man ser på tabellen over elektronkonfigurationer, bør det også bemærkes, at Nb er en undtagelse fra de typiske orbitalfyldningsregler) b) En lignende procedure følges for Pr, grundstof nummer 59. Hvis man bevæger sig baglæns gennem tabellen, er den nærmeste ædelgas Xe, og derfor bruger vi Xe-kernen. Tæller vi igen fremad, svarer Cs og Ba til 6s2. Derefter svarer La, Ce og Pr til yderligere tre elektroner i 4f-underskallen. Konfigurationen er således Pr…4f36s2
Det er nødvendigt at fremhæve endnu et punkt om forholdet mellem elektronkonfiguration og det periodiske system. Atomerne i grundstofferne i den samme lodrette kolonne i det periodiske system har ens elektronkonfigurationer. Tag f.eks. de alkalisk-jordiske grundstoffer (gruppe IIA). Ved hjælp af vores regler for afledning af elektronkonfigurationer (eksempel 1) har vi
| Element | Elektronkonfiguration | Lewis-diagram |
|---|---|---|
| Be | 2s2 | Be: | Mg | 3s2 | Mg: | Ca | 4s2 | Ca: |
| Sr | 5s2 | Sr: | Ba | 6s2 | Ba: | Ra | 7s2 | Ra: |
Så de ligheder i kemisk adfærd og valens, der er nævnt tidligere for disse grundstoffer, korrelerer med lighederne i deres yderste elektronskyer. Sådanne ligheder forklarer den succes, som Mendelejevs forudsigelser af egenskaberne for de uopdagede grundstoffer har haft.
Kontributorer og tilskrivninger
-
Ed Vitz (Kutztown University), John W. Moore (UW-Madison), Justin Shorb (Hope College), Xavier Prat-Resina (University of Minnesota Rochester), Tim Wendorff og Adam Hahn.
