Læringsmål
- Beskriv de komponenter, der indgår i en muskelkontraktion
- Forklar, hvordan muskler trækker sig sammen og slapper af
- Beskriv modellen med glidende filamenter for muskelsammentrækning
Den sekvens af begivenheder, der resulterer i sammentrækning af en individuel muskelfiber, begynder med et signal – neurotransmitteren, ACh-fra det motorneuron, der innerverer den pågældende fiber. Den lokale membran i fiberen vil depolarisere sig, når positivt ladede natriumioner (Na+) trænger ind, hvilket udløser et aktionspotentiale, der breder sig til resten af membranen vil depolarisere sig, herunder T-tubuli. Dette udløser frigivelse af calciumioner (Ca++) fra oplagring i det sarkoplasmatiske retikulum (SR). Ca++ udløser derefter en sammentrækning, som opretholdes af ATP (figur 1). Så længe Ca++-ionerne forbliver i sarkoplasmaet for at binde sig til troponin, som holder aktinbindingsstederne “uafskærmede”, og så længe der er ATP til rådighed til at drive krydsbrocyklingen og myosinets træk af aktinstrenge, vil muskelfibrene fortsætte med at forkortes til en anatomisk grænse.

Figur 1. Kontraktion af en muskelfiber. Der dannes en tværbro mellem aktin og myosinhovederne, der udløser kontraktion. Så længe Ca++-ioner forbliver i sarkoplasmaet for at binde til troponin, og så længe der er ATP til rådighed, vil muskelfibrene fortsætte med at forkortes.
Muskelkontraktionen stopper normalt, når signaleringen fra motorneuronen ophører, hvilket repolariserer sarcolemmaet og T-tubuli og lukker de spændingsafhængige calciumkanaler i SR. Ca++-ioner pumpes derefter tilbage i SR, hvilket får tropomyosinen til at genafskærme (eller genoverdække) bindingsstederne på aktinstrengene. En muskel kan også holde op med at trække sig sammen, når den løber tør for ATP og bliver træt (figur 2).

Figur 2. Afslapning af en muskelfiber. Ca++-ioner pumpes tilbage i SR, hvilket får tropomyosinen til at genafskærme bindingsstederne på aktinstrengene. En muskel kan også holde op med at trække sig sammen, når den løber tør for ATP og bliver træt.
De molekylære begivenheder i forbindelse med muskelfiberforkortning finder sted i fibrenes sarkomerer (se figur 3). Kontraktionen af en tværstribet muskelfiber sker, når sarkomererne, der er lineært anbragt i myofibriller, forkortes, når myosinhovederne trækker i actinfilamenterne.
Det område, hvor tykke og tynde filamenter overlapper hinanden, har et tæt udseende, da der er lidt plads mellem filamenterne. Dette område, hvor tynde og tykke filamenter overlapper hinanden, er meget vigtigt for muskelsammentrækningen, da det er her, filamentbevægelsen starter. Tynde filamenter, der er forankret i deres ender ved Z-skiverne, strækker sig ikke helt ind i det centrale område, som kun indeholder tykke filamenter, der er forankret ved deres basis på et sted, der kaldes M-linjen. En myofibrille består af mange sarkomerer, der løber i længden; myofibriller og muskelceller trækker sig således sammen, når sarkomererne trækker sig sammen.
Glidfilamentmodellen for kontraktion
Når der gives signal fra et motorneuron, trækker en skeletmuskelfiber sig sammen, når de tynde filamenter trækkes og derefter glider forbi de tykke filamenter inden for fibrenes sarkomerer. Denne proces er kendt som den såkaldte glidende filamentmodel for muskelkontraktion (figur 3). Glidningen kan kun finde sted, når myosinbindingssteder på aktinfilamenterne eksponeres ved en række trin, der begynder med Ca++-indgang i sarkoplasmaet.

Figur 3. Modellen med glidende filamenter for muskelsammentrækning. Når et sarkomer trækker sig sammen, rykker Z-linjerne tættere sammen, og I-båndet bliver mindre. A-båndet forbliver den samme bredde. Ved fuld kontraktion overlapper de tynde og tykke filamenter hinanden.
Tropomyosin er et protein, der snor sig rundt om kæderne i actinfilamentet og dækker myosinbindingsstederne for at forhindre actin i at binde sig til myosin. Tropomyosin binder sig til troponin for at danne et troponin-tropomyosinkompleks. Troponin-tropomyosinkomplekset forhindrer myosin-“hovederne” i at binde sig til de aktive steder på aktin-mikrofilamenterne. Troponin har også et bindingssted for Ca++-ioner.
For at igangsætte muskelkontraktion skal tropomyosin eksponere myosinbindingsstedet på et aktinfilament for at muliggøre tværbrodannelse mellem aktin- og myosin-mikrofilamenterne. Det første skridt i kontraktionsprocessen er, at Ca++ binder sig til troponin, så tropomyosin kan glide væk fra bindingsstederne på aktinstrengene. Dette giver myosinhovederne mulighed for at binde sig til disse eksponerede bindingssteder og danne tværbroer. De tynde filamenter trækkes derefter af myosinhovederne for at glide forbi de tykke filamenter mod midten af sarkomeren. Men hvert hoved kan kun trække et meget kort stykke, før det har nået sin grænse og skal “spændes igen”, før det kan trække igen, et trin, der kræver ATP.
ATP og muskelkontraktion
For at tynde filamenter fortsat kan glide forbi tykke filamenter under muskelkontraktion, skal myosinhovederne trække i actin ved bindingsstederne, løsne sig, spændes igen, binde sig til flere bindingssteder, trække, løsne sig, spændes igen, osv. Denne gentagne bevægelse er kendt som cross-bridge-cyklussen. Denne bevægelse af myosinhovederne svarer til årerne, når en person ror i en båd: Rorets padle (myosinhovederne) trækker, løftes op af vandet (løsner sig), sættes på plads igen (spændes igen) og nedsænkes så igen for at trække (figur 4). Hver cyklus kræver energi, og den handling, hvor myosinhovederne i sarkomererne gentagne gange trækker i de tynde filamenter, kræver også energi, som tilvejebringes af ATP.
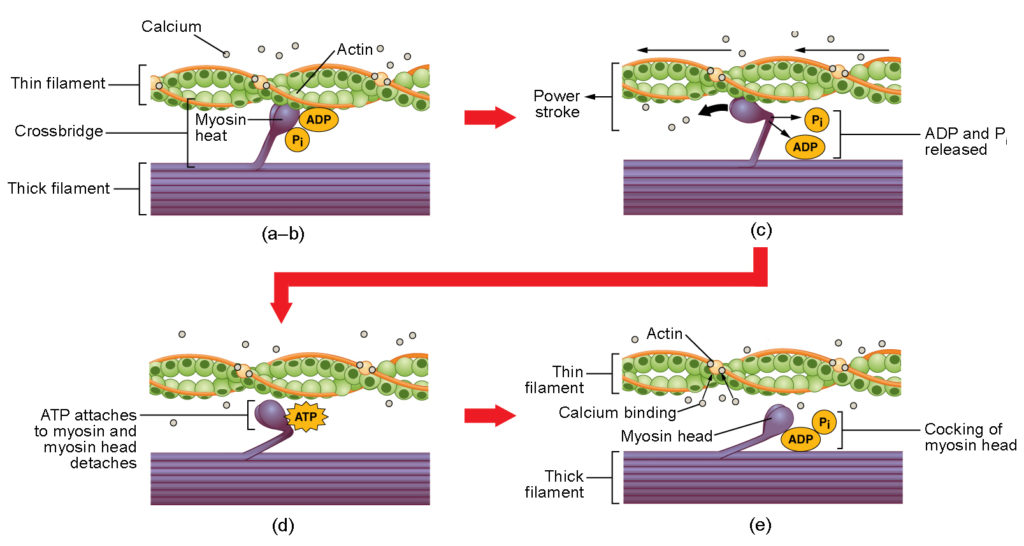
Figur 4. Skeletmuskelkontraktion. (a) Det aktive sted på actin er eksponeret, når calcium binder til troponin. (b) Myosinhovedet tiltrækkes af actin, og myosin binder actin på sit actinbindingssted og danner tværbroen. (c) I løbet af kraftslaget frigives det fosfat, der blev dannet i den foregående kontraktionscyklus. Dette resulterer i, at myosinhovedet svinges mod midten af sarkomeren, hvorefter det tilknyttede ADP og fosfatgruppen frigives. (d) Et nyt ATP-molekyle knytter sig til myosinhovedet, hvilket får krydsbroen til at løsne sig. (e) Myosinhovedet hydrolyserer ATP til ADP og fosfat, hvorved myosinen vender tilbage til den spændte position.
Krydsbrodannelse sker, når myosinhovedet hæfter sig til actin, mens adenosindiphosphat (ADP) og uorganisk fosfat (Pi) stadig er bundet til myosin (figur 4a,b). Pi frigives derefter, hvilket får myosin til at danne en stærkere fastgørelse til actin, hvorefter myosinhovedet bevæger sig mod M-linjen og trækker actin med sig. Efterhånden som actin trækkes med, bevæger filamenterne sig ca. 10 nm mod M-linjen. Denne bevægelse kaldes kraftslaget, da der sker en bevægelse af det tynde filament på dette trin (figur 4c). I fravær af ATP vil myosinhovedet ikke løsne sig fra actin.
En del af myosinhovedet hæfter sig til bindingsstedet på actin, men hovedet har et andet bindingssted for ATP. ATP-binding får myosinhovedet til at løsne sig fra actin (figur 4d). Efter at dette er sket, omdannes ATP til ADP og Pi af myosins iboende ATPaseaktivitet. Den energi, der frigives under ATP-hydrolysen, ændrer vinklen på myosinhovedet til en spændt position (figur 4e). Myosinhovedet er nu i position til yderligere bevægelse.
Når myosinhovedet er spændt, befinder myosin sig i en højenergikonfiguration. Denne energi forbruges, når myosinhovedet bevæger sig gennem kraftslaget, og ved afslutningen af kraftslaget er myosinhovedet i en lav-energi-stilling. Efter kraftslaget frigives ADP, men den dannede tværbro er stadig på plads, og actin og myosin er bundet sammen. Så længe der er ATP tilgængeligt, knyttes det let til myosin, krydsbrocyklussen kan gentage sig, og muskelkontraktionen kan fortsætte.
Bemærk, at hvert tykt filament af ca. 300 myosinmolekyler har flere myosinhoveder, og at mange krydsbroer dannes og brydes løbende under muskelkontraktionen. Multiplicer dette med alle sarkomerer i én myofibrille, alle myofibriller i én muskelfiber og alle muskelfibre i én skeletmuskel, og du kan forstå, hvorfor der er brug for så meget energi (ATP) for at holde skeletmuskulaturen i gang. Faktisk er det tabet af ATP, der resulterer i den dødsstivhed, der observeres kort efter en persons død. Da der ikke er mulighed for yderligere ATP-produktion, er der ikke ATP til rådighed for myosinhovederne til at løsne sig fra aktinbindingsstederne, så tværbroerne forbliver på plads, hvilket forårsager stivheden i skeletmuskulaturen.
Kilder til ATP
ATP leverer den energi, der skal til for at muskelsammentrækningen kan finde sted. Ud over sin direkte rolle i tværbrocyklussen leverer ATP også energien til de aktive Ca++ transportpumper i SR. Muskelkontraktion kan ikke finde sted uden tilstrækkelige mængder ATP. Mængden af ATP, der er lagret i musklerne, er meget lille og er kun tilstrækkelig til at give energi til et par sekunders sammentrækninger. Da ATP nedbrydes, skal det derfor regenereres og erstattes hurtigt for at muliggøre en vedvarende kontraktion. Der er tre mekanismer, hvormed ATP kan regenereres: kreatinphosphatmetabolisme, anaerob glykolyse, fermentering og aerob respiration.
Kreatinphosphat er et molekyle, der kan lagre energi i sine fosfatbindinger. I en hvilende muskel overfører overskydende ATP sin energi til kreatin, hvorved der dannes ADP og kreatinfosfat. Dette fungerer som en energireserve, der kan bruges til hurtigt at skabe mere ATP. Når musklen begynder at trække sig sammen og har brug for energi, overfører kreatinfosfat sit fosfat tilbage til ADP for at danne ATP og kreatin. Denne reaktion katalyseres af enzymet kreatinkinase og sker meget hurtigt; ATP fra kreatinfosfat giver således energi til de første par sekunder af muskelkontraktionen. Kreatinfosfat kan dog kun levere energi i ca. 15 sekunder, hvorefter der skal anvendes en anden energikilde (figur 5).

Figur 5. Muskelmetabolisme. En del ATP er lagret i en muskel i hvile. Når kontraktionen starter, opbruges det i løbet af få sekunder. Der dannes mere ATP fra kreatinfosfat i ca. 15 sekunder.
Når ATP produceret af kreatinfosfat er opbrugt, vender musklerne sig til glykolyse som ATP-kilde. Glykolyse er en anaerob (ikke-syreafhængig) proces, der nedbryder glukose (sukker) for at producere ATP; glykolyse kan dog ikke generere ATP så hurtigt som kreatinphosphat. Skiftet til glykolyse resulterer således i en langsommere hastighed for ATP-tilgængelighed for musklen. Det sukker, der anvendes i glykolysen, kan tilvejebringes fra blodglukose eller ved at metabolisere glykogen, der er lagret i musklen. Nedbrydningen af ét glukosemolekyle producerer to ATP og to molekyler pyrubrinsyre, som kan anvendes i aerob respiration eller, når iltniveauet er lavt, omdannes til mælkesyre (figur 6).

Figur 6. Glykolyse og aerob respiration. Hvert glukosemolekyle producerer to ATP og to molekyler pyrubrinsyre, som kan bruges i aerob respiration eller omdannes til mælkesyre. Hvis der ikke er ilt til rådighed, omdannes pyrubrinsyre til mælkesyre, hvilket kan bidrage til muskeltræthed. Dette sker under anstrengende træning, når der er behov for store mængder energi, men ilten ikke kan tilføres tilstrækkeligt til musklerne.
Hvis der er ilt til rådighed, anvendes pyrubrinsyre i den aerobe respiration. Hvis der imidlertid ikke er ilt til rådighed, omdannes pyrubrinsyre til mælkesyre, hvilket kan bidrage til muskeltræthed. Denne omdannelse gør det muligt at genanvende enzymet NAD+ fra NADH, som er nødvendigt for at glykolysen kan fortsætte. Dette sker under anstrengende træning, når der er behov for store mængder energi, men ilten ikke kan tilføres musklerne i tilstrækkelig grad. Glykolysen i sig selv kan ikke opretholdes i meget lang tid (ca. 1 minuts muskelaktivitet), men den er nyttig til at lette korte udbrud af højintensivt arbejde. Dette skyldes, at glykolysen ikke udnytter glukose særlig effektivt, idet den producerer en nettogevinst på to ATP pr. glukosemolekyle og slutproduktet mælkesyre, som kan bidrage til muskeltræthed, når det ophobes.
Aerob respiration er nedbrydningen af glukose eller andre næringsstoffer i nærvær af ilt (O2) for at producere kuldioxid, vand og ATP. Ca. 95 % af den ATP, der er nødvendig for hvilende eller moderat aktive muskler, leveres af aerob respiration, som finder sted i mitokondrier. Inputstofferne til aerob respiration omfatter glukose, der cirkulerer i blodet, pyrubrinsyre og fedtsyrer. Aerob respiration er meget mere effektiv end anaerob glykolyse, idet den producerer ca. 36 ATP pr. glukosemolekyle mod fire fra glykolyse. Den aerobe respiration kan imidlertid ikke opretholdes uden en konstant tilførsel af O2 til skeletmusklen og er meget langsommere (figur 7). For at kompensere for dette lagrer musklerne en lille mængde overskydende ilt i proteiner kaldet myoglobin, hvilket giver mulighed for mere effektive muskelsammentrækninger og mindre træthed. Aerob træning øger også effektiviteten af kredsløbssystemet, så der kan tilføres O2 til musklerne i længere perioder.

Figur 7. Cellulær respiration. Aerob respiration er nedbrydningen af glukose i tilstedeværelse af ilt (O2) for at producere kuldioxid, vand og ATP. Ca. 95 % af den ATP, der er nødvendig for hvilende eller moderat aktive muskler, leveres af aerob respiration, som finder sted i mitokondrier.
Muskeltræthed opstår, når en muskel ikke længere kan trække sig sammen som reaktion på signaler fra nervesystemet. De nøjagtige årsager til muskeltræthed er ikke fuldt ud kendt, selv om visse faktorer er blevet korreleret med den nedsatte muskelkontraktion, der opstår under træthed. ATP er nødvendigt for normal muskelsammentrækning, og efterhånden som ATP-reserverne reduceres, kan muskelfunktionen falde. Dette kan være en større faktor ved kortvarige, intense muskeludfoldelser end ved vedvarende anstrengelser med lavere intensitet. Ophobning af mælkesyre kan sænke den intracellulære pH-værdi, hvilket påvirker enzym- og proteinaktiviteten. Ubalancer i Na+- og K+-niveauerne som følge af membrandepolarisering kan forstyrre Ca++-strømmen ud af SR. Lange perioder med vedvarende træning kan beskadige SR og sarkolemmaet, hvilket resulterer i nedsat Ca++-regulering.
Intensiv muskelaktivitet resulterer i en iltgæld, som er den mængde ilt, der er nødvendig for at kompensere for ATP, der produceres uden ilt under muskelkontraktion. Der kræves ilt til at genoprette ATP- og kreatinphosphatniveauerne, konvertere mælkesyre til pyrubrinsyre og i leveren til at konvertere mælkesyre til glukose eller glykogen. Andre systemer, der anvendes under træning, kræver også ilt, og alle disse kombinerede processer resulterer i den øgede vejrtrækningsfrekvens, der opstår efter træning. Indtil iltgælden er blevet dækket, er iltoptagelsen forhøjet, selv efter at træningen er ophørt.
Afspænding af en skeletmuskel
Afspænding af skeletmuskelfibre og i sidste ende af skeletmusklen begynder med motorneuronen, som holder op med at frigive sit kemiske signal, ACh, i synapsen ved NMJ. Muskelfibrene repolariseres, hvilket lukker portene i SR, hvor Ca++ blev frigivet. ATP-drevne pumper vil flytte Ca++ ud af sarkoplasmaet tilbage til SR. Dette resulterer i en “genafskærmning” af de aktinbindende steder på de tynde filamenter. Uden evnen til at danne tværbroer mellem de tynde og tykke filamenter mister muskelfibrene deres spænding og slapper af.
Muskelstyrke
Antal af skeletmuskelfibre i en given muskel er genetisk bestemt og ændrer sig ikke. Muskelstyrken er direkte relateret til mængden af myofibriller og sarkomerer i hver fiber. Faktorer, såsom hormoner og stress (og kunstige anabole steroider), der virker på musklen, kan øge produktionen af sarkomerer og myofibriller i muskelfibrene, en ændring kaldet hypertrofi, som resulterer i øget masse og bulk i en skeletmuskel. På samme måde resulterer nedsat brug af en skeletmuskel i atrofi, hvor antallet af sarkomerer og myofibriller forsvinder (men ikke antallet af muskelfibre). Det er almindeligt, at et lem i gips viser atrofierede muskler, når gipsen fjernes, og visse sygdomme, som f.eks. polio, viser atrofierede muskler.
Sygdomme i muskelsystemet
Duchenne muskeldystrofi (DMD) er en progressiv svækkelse af skeletmuskulaturen. Det er en af flere sygdomme, der samlet betegnes “muskeldystrofi”. DMD skyldes mangel på proteinet dystrofin, som hjælper de tynde filamenter af myofibriller med at binde sig til sarcolemmaet. Uden tilstrækkeligt dystrofin får muskelsammentrækninger sarkolemmaet til at rive, hvilket forårsager en tilstrømning af Ca++, der fører til celleskader og nedbrydning af muskelfibre. Efterhånden som muskelskaderne akkumuleres, går muskelmassen tabt, og der udvikles større funktionsnedsættelser.
DMD er en arvelig lidelse, der skyldes et unormalt X-kromosom. Den rammer primært mænd, og den diagnosticeres normalt i den tidlige barndom. DMD viser sig normalt først som vanskeligheder med balance og bevægelse og udvikler sig derefter til en manglende evne til at gå. Det fortsætter med at udvikle sig opad i kroppen fra de nedre ekstremiteter til overkroppen, hvor det påvirker de muskler, der er ansvarlige for vejrtrækning og kredsløb. Den fører i sidste ende til døden på grund af åndedrætsbesvær, og de ramte lever normalt ikke længere end til 20’erne.
Da DMD skyldes en mutation i det gen, der koder for dystrofin, troede man, at det kunne være en effektiv behandling at indføre raske myoblaster hos patienterne. Myoblaster er de embryonale celler, der er ansvarlige for muskeludviklingen, og ideelt set ville de bære sunde gener, der kunne producere den dystrofin, der er nødvendig for normal muskelsammentrækning. Denne fremgangsmåde har stort set ikke haft succes hos mennesker. En nyere fremgangsmåde har involveret forsøg på at øge musklens produktion af utrofin, et protein, der ligner dystrofin, og som måske kan overtage dystrophins rolle og forhindre, at der opstår celleskader.
Selvkontrolspørgsmål
Tag nedenstående quiz for at tjekke din forståelse af muskelfibrernes sammentrækning og afslapning:
