![]()
Personer, der anvender hjælpemidler, kan muligvis ikke få fuld adgang til oplysningerne i denne fil. Hvis du har brug for hjælp, bedes du sende en e-mail til: [email protected]. Skriv 508 Accommodation og titlen på rapporten i emnelinjen i e-mailen.
![]() PDF
PDF
The Advisory Committee on Immunization Practices (ACIP) reviderer hvert år det anbefalede vaccinationsskema for voksne for at sikre, at skemaet afspejler de aktuelle anbefalinger for brugen af godkendte vacciner. I juni 2005 godkendte ACIP vaccinationsskemaet for voksne for oktober 2005-september 2006. Dette skema er også blevet godkendt af American Academy of Family Physicians og American College of Obstetricians and Gynecologists.
Ændringer i skemaet for oktober 2005-september 2006
Skemaet for 2005-2006 adskiller sig fra det tidligere skema på følgende måde:
- Vaccinerne på det aldersbaserede skema (figur 1) er vist, så der kan skelnes mellem vacciner, der anbefales til rutinemæssig brug, og vacciner, der anbefales til voksne med visse risikoindikatorer (svarende til børnevaccinationsprogrammet). Dette illustreres både af farveskemaet og af den brudte linje.
- De gule søjler (“For alle personer i denne gruppe”) og de grønne søjler (“For personer, der mangler dokumentation for vaccination eller bevis for sygdom”) fra det tidligere skema er blevet slået sammen til én gul søjle, som nu lyder: “For alle personer i denne kategori, der opfylder alderskravene, og som mangler bevis for immunitet (f.eks, mangler dokumentation for vaccination eller har ingen beviser for tidligere infektion).”
- Den lilla bjælke er ændret fra “For personer i risiko (f.eks. med medicinske indikationer/indikationer for eksponering)” til “Anbefales, hvis en anden risikofaktor er til stede (f.eks. på grundlag af medicinske, erhvervsmæssige, livsstilsrelaterede eller andre indikationer).” Den lilla bjælke blev tilføjet til kolonnerne for aldersgrupperne 50–64 år og >65 år for mæslinger, fåresyge og røde hunde (MMR-vaccine).
- Spalten “Diabetes, hjertesygdom, kronisk lungesygdom eller kronisk leversygdom, herunder kronisk alkoholisme” er blevet ombyttet med kolonnen “Medfødt immundefekt, leukæmi, lymfom, generaliseret malignitet, behandling med alkylerende midler, antimetabolitter, udsivning af cerebrospinalvæske, stråling eller store mængder kortikosteroider” på skemaet for medicinske/andre indikationer (figur 2), så kontraindikationer for MMR- og varicellavacciner nu står ved siden af hinanden.
- Rækken for varicellavaccine er blevet flyttet op på begge figurer (dvs, til umiddelbart efter MMR-vaccinen), fordi vaccinen nu anbefales generelt til visse aldersgrupper.
- Meningokokvaccine er blevet tilføjet til skemaet over medicinske/andre indikationer (figur 2). Fodnoten er blevet revideret for at indarbejde de nyligt offentliggjorte ACIP-anbefalinger for denne vaccine (1).
- Fodnoten om stivkrampe og difteri (#1) er blevet omformuleret.
- Fodnoten om varicella (#3) er blevet omformuleret i overensstemmelse med ACIP-anbefalinger vedtaget i juni 2005.
- Fodnoten om influenza (#4) er blevet revideret for at tilføje den nyeste højrisikotilstand: neuromuskulære tilstande, der svækker åndedrætsfunktionen (2).
- Der er tilføjet en 10. fodnote vedrørende Haemophilus influenzae type b-vaccination til populationer med høj risiko (dvs, personer med aspleni, leukæmi og infektion med humant immundefektvirus).
Voksenvaccinationsplanen for voksne er tilgængelig på engelsk og spansk på http://www.cdc.gov/nip/recs/adult-schedule.htm. Generelle oplysninger om vaccination af voksne, herunder anbefalinger vedrørende vaccination af personer med HIV og andre immunosuppressive tilstande, kan fås fra statslige og lokale sundhedsafdelinger og fra National Immunization Program på http://www.cdc.gov/nip. Vaccininformationserklæringer er tilgængelige på http://www.cdc.gov/nip/publications/vis. ACIP-erklæringer for hver enkelt anbefalet vaccine kan ses, downloades og udskrives fra det nationale vaccinationsprograms websted på http://www.cdc.gov/nip/publications/acip-list.htm. Instruktioner for indberetning af bivirkninger til Vaccine Adverse Event Reporting System findes på http://www.vaers.hhs.gov eller pr. telefon på 800-822-7967.
- CDC. Forebyggelse og kontrol af meningokoksygdom: anbefalinger fra Advisory Committee for Immunization Practices (ACIP). MMWR 2005;54(nr. RR-7).
- CDC. Forebyggelse og kontrol af influenza: anbefalinger fra det rådgivende udvalg for vaccinationspraksis (ACIP). MMWR 2005;54(nr. RR-8).
Figur 1
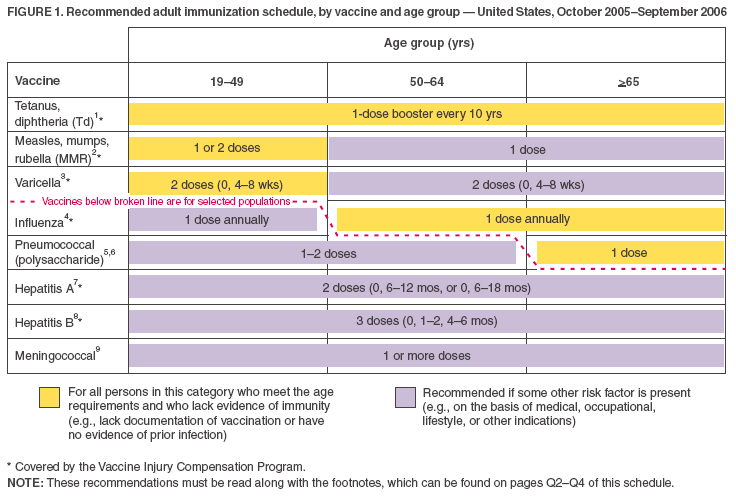
Vend tilbage til toppen.
Figur 2

Vend tilbage til toppen.
Godkendt af Advisory Committee on Immunization Practices, American College of Obstetricians and Gynecologists og American Academy of Family Physicians
1. Vaccination mod stivkrampe og difteri (Td). Voksne med usikre historier af en komplet primær vaccinationsserie med difteri og tetanustoksoid-holdige vacciner bør modtage en primær serie med kombineret Td-toksoid. En primær serie for voksne består af 3 doser; de første 2 doser gives med mindst 4 ugers mellemrum og den tredje dosis 6-12 måneder efter den anden dosis. Giv 1 dosis, hvis personen har modtaget den primære serie, og hvis den sidste vaccination blev modtaget >10 år tidligere. Se ACIP-erklæringen for anbefalinger om indgivelse af Td som profylakse i forbindelse med sårbehandling (http://www.cdc.gov/mmwr/preview/mmwrhtml/00041645.htm). American College of Physicians Task Force on Adult Immunization støtter en anden mulighed for anvendelse af Td hos voksne: en enkelt Td-booster i 50-årsalderen for personer, der har gennemført den fulde pædiatriske serie, herunder teenage/ung voksen-boosteren. Der findes en nyligt godkendt tetanus-diphteria-acellulær–pertussis-vaccine til voksne. ACIP’s anbefalinger for brugen af denne vaccine vil blive offentliggjort.
2. Vaccination mod mæslinger, fåresyge og røde hunde (MMR). Mæslingekomponent: Voksne, der er født før 1957, kan betragtes som immune over for mæslinger. Voksne, der er født i eller efter 1957, bør modtage >1 dosis MMR, medmindre de har en medicinsk kontraindikation, dokumentation for >1 dosis, en historie med mæslinger baseret på en diagnose fra en sundhedsplejerske eller laboratoriebevis for immunitet. En anden dosis MMR anbefales til voksne, der 1) for nylig er blevet udsat for mæslinger eller i forbindelse med et udbrud, 2) tidligere er blevet vaccineret med dræbt mæslingevaccine, 3) er blevet vaccineret med en ukendt type mæslingevaccine i perioden 1963-1967, 4) er studerende på videregående uddannelsesinstitutioner, 5) arbejder i et sundhedsvæsen eller 6) planlægger at foretage en international rejse. Afhold MMR-vacciner eller andre mæslingeholdige vacciner fra HIV-inficerede personer med alvorlig immunosuppression. Mumps-komponent: 1 dosis MMR-vaccine bør være tilstrækkelig til at beskytte personer, der er født i eller efter 1957, og som ikke har haft fåresyge baseret på en diagnose stillet af en sundhedsplejerske, eller som ikke har laboratoriebevis for immunitet. Rubella-komponent: Der skal gives 1 dosis MMR-vaccine til kvinder, hvis rubella-vaccinationshistorik er upålidelig, eller som mangler laboratoriebevis for immunitet. For kvinder i den fødedygtige alder, uanset fødselsår, skal man rutinemæssigt bestemme rubellaimmunitet og rådgive kvinderne om medfødt rubellasyndrom. Kvinder, der er gravide eller kan blive gravide inden for 4 uger efter modtagelse af vaccinen, må ikke vaccineres. Kvinder, der ikke har bevis for immunitet, bør modtage MMR-vaccine ved afslutning eller ophør af graviditeten og før udskrivelse fra sundhedsinstitutionen.
3. Varicella-vaccination. Varicellavaccination anbefales til alle voksne uden dokumentation for immunitet mod varicella. Der bør tages særlig hensyn til personer, der 1) har tæt kontakt med personer med høj risiko for alvorlig sygdom (sundhedspersonale og familiekontakter til immunsvækkede personer) eller 2) er i høj risiko for eksponering eller overførsel (f.eks. lærere af små børn; ansatte i børnepasning; beboere og ansatte i institutionelle miljøer, herunder fængselsinstitutioner; universitetsstuderende; militærpersonale; unge og voksne, der bor i husstande med børn; ikke-gravide kvinder i den fødedygtige alder; og internationale rejsende). Bevis for immunitet mod varicella hos voksne omfatter en eller flere af følgende: 1) dokumenteret alderssvarende varicellavaccination (dvs. modtagelse af 1 dosis før det fyldte 13. år eller modtagelse af 2 doser efter det fyldte 13. år), 2) født i USA før 1966 eller historie af varicella-sygdom før 1966 for ikke-amerikanske personer, der er født i USA.født i USA; 3) anamnese af varicella baseret på en diagnose stillet af en sundhedsplejerske eller på forældrenes eller selvrapportering af typisk varicella-sygdom for personer født i perioden 1966-1997 (for en patient, der rapporterer en anamnese af et atypisk, mildt tilfælde, bør sundhedsplejerskerne søge enten en epidemiologisk forbindelse med et typisk varicella-tilfælde eller bevis for laboratoriebekræftelse, hvis den blev foretaget på tidspunktet for den akutte sygdom); 4) anamnese af herpes zoster baseret på en diagnose stillet af en sundhedsplejerske; eller 5) laboratoriebevis for immunitet. Der må ikke vaccineres kvinder, der er gravide eller kan blive gravide inden for 4 uger efter modtagelse af vaccinen. Vurder gravide kvinder for bevis for varicella-immunitet. Kvinder, som ikke har beviser for immunitet, skal modtage dosis 1 af varicellavaccinen ved afslutning eller ophør af graviditeten og inden udskrivelse fra sundhedsinstitutionen. Dosis 2 bør gives 4–8 uger efter dosis 1.
4. Influenzavaccination. Medicinske indikationer: kroniske lidelser i det kardiovaskulære system eller lungesystemet, herunder astma; kroniske stofskiftesygdomme, herunder diabetes mellitus, nyrefunktionsforstyrrelser, hæmoglobinopatier eller immunosuppression (herunder immunosuppression forårsaget af medicin eller HIV); enhver tilstand (f.eks, kognitiv dysfunktion, rygmarvsskade, krampeforstyrrelse eller anden neuromuskulær lidelse), der forringer åndedrætsfunktionen eller håndteringen af åndedrætssekret eller kan øge risikoen for aspiration, og graviditet i influenzasæsonen. Der findes ingen data om risikoen for alvorlig eller kompliceret influenzasygdom hos personer med aspleni; influenza er imidlertid en risikofaktor for sekundære bakterieinfektioner, der kan forårsage alvorlig sygdom hos personer med aspleni. Erhvervsmæssige indikationer: sundhedspersonale og ansatte i langtidspleje- og plejeboliger. Andre indikationer: beboere på plejehjem og andre langtidspleje- og plejeboliger; personer, der kan overføre influenza til personer med høj risiko (dvs. husstandskontakter i hjemmet og plejere af børn i alderen 0-23 måneder eller personer i alle aldre med højrisikotilstande), og alle, der ønsker at blive vaccineret. Til raske, ikke-gravide personer i alderen 5-49 år uden højrisikotilstande, som ikke er kontaktpersoner til alvorligt immunsvækkede personer på specialafdelinger, kan der gives intranasalt administreret influenzavaccine (FluMist®) i stedet for inaktiveret vaccine.
5. Pneumokok-polysaccharidvaccination. Medicinske indikationer: kroniske lidelser i lungesystemet (undtagen astma); kardiovaskulære sygdomme; diabetes mellitus; kroniske leversygdomme, herunder leversygdom som følge af alkoholmisbrug (f.eks. cirrose); kronisk nyresvigt eller nefrotisk syndrom; funktionel eller anatomisk aspleni (f.eks, seglcellesygdom eller splenectomi); immunosuppressive tilstande (f.eks. medfødt immundefekt, HIV-infektion, leukæmi, lymfom, multipel myelom, Hodgkin-sygdom, generel malignitet eller organ- eller knoglemarvstransplantation); kemoterapi med alkylerende midler, antimetabolitter eller langvarige systemiske kortikosteroider; og cochlear-implantater. Andre indikationer: Andre indikationer: Indfødte fra Alaska og visse indianske befolkningsgrupper; beboere på plejehjem og andre langtidsplejeinstitutioner.
6. Revaccination med pneumokok-polysaccharidvaccine. Engangs revaccination efter 5 år til personer med kronisk nyresvigt eller nefritisk syndrom; funktionel eller anatomisk aspleni (f.eks. seglcellesygdom eller splenectomi); immunosuppressive tilstande (f.eks, medfødt immundefekt, HIV-infektion, leukæmi, lymfom, multipel myelom, Hodgkins sygdom, generaliseret malignitet eller organ- eller knoglemarvstransplantation); eller kemoterapi med alkylerende midler, antimetabolitter eller langvarige systemiske kortikosteroider. For personer i alderen >65 år, engangs revaccination, hvis de er blevet vaccineret >5 år tidligere og var <65 år på tidspunktet for primærvaccinationen.
7. Hepatitis A-vaccination. Medicinske indikationer: Personer med koagulationsfaktorsygdomme eller kronisk leversygdom. Adfærdsindikationer: mænd, der har sex med mænd, eller brugere af ulovlige stoffer. Erhvervsmæssige indikationer: Personer, der arbejder med hepatitis A-virus (HAV)-inficerede primater eller med HAV i et forskningslaboratorium. Andre indikationer: Personer, der rejser til eller arbejder i lande med høj eller intermediær endemicitet for hepatitis A (for en liste over lande, se http://www.cdc.gov/travel/diseases.htm#hepa) samt enhver person, der ønsker at opnå immunitet. De nuværende vacciner bør gives i en 2-dosis serie på enten 0 og 6–12 måneder eller 0 og 6–18 måneder. Hvis den kombinerede hepatitis A- og hepatitis B-vaccine anvendes, skal der gives 3 doser ved 0, 1 og 6 måneder.
8. Hepatitis B-vaccination. Medicinske indikationer: hæmodialysepatienter (brug særlig formulering eller to 20-µg/mL-doser) eller patienter, der modtager koagulationsfaktorkoncentrater. Erhvervsmæssige indikationer: sundhedspersonale og ansatte i den offentlige sikkerhed, der udsættes for blod på arbejdspladsen, og personer under uddannelse på skoler for medicin, tandlægevidenskab, sygepleje, laboratorieteknologi og andre beslægtede sundhedsfag. Adfærdsrelaterede indikationer: brugere af injektionsmidler, personer med mere end én sexpartner inden for de seneste seks måneder, personer med en nyligt erhvervet seksuelt overført sygdom (STD) og mænd, der har sex med mænd. Andre indikationer: husstandskontakter og sexpartnere til personer med kronisk hepatitis B-virus (HBV)-infektion; klienter og personale på institutioner for udviklingshæmmede personer; alle klienter på STD-klinikker; indsatte i fængselsinstitutioner; og internationale rejsende, der skal opholde sig i lande med høj eller mellemliggende prævalens af kronisk HBV-infektion i mere end 6 måneder (for liste over lande, se http://www.cdc.gov/travel/diseases.htm#hepa).
9. Meningokokvaccination. Medicinske indikationer: Voksne med anatomisk eller funktionel aspleni eller terminale komplementkomponentmangler. Andre indikationer: studerende på første år på college, der bor på kollegier; mikrobiologer, der rutinemæssigt udsættes for isolater af Neisseria meningitidis; militærrekrutter; og personer, der rejser til eller opholder sig i lande, hvor meningokoksygdom er hyperendemisk eller epidemisk (f.eks. “meningitisbæltet” i Afrika syd for Sahara i tørkeperioden), især hvis kontakten med lokalbefolkningen vil blive forlænget. Den saudiarabiske regering kræver vaccination af alle rejsende til Mekka i forbindelse med den årlige Hajj. Meningokokkonjugatvaccine foretrækkes til voksne, der opfylder en af ovennævnte indikationer, og som er <55 år gamle, selv om meningokokpolysaccharidvaccine (MPSV4) er et acceptabelt alternativ. Revaccination efter 5 år kan være indiceret for voksne, der tidligere er vaccineret med MPSV4, og som fortsat er i høj risiko for infektion (f.eks. personer, der opholder sig i områder, hvor sygdommen er epidemisk).
10. Udvalgte tilstande, for hvilke Haemophilus influenzae type b (Hib)-vaccine kan anvendes. Hib-konjugatvacciner er godkendt til børn i alderen 6–71 måneder. Der foreligger ingen data om effektivitet, som kan danne grundlag for en anbefaling om anvendelse af Hib-vaccine til ældre børn og voksne med de kroniske sygdomme, der er forbundet med en øget risiko for Hib-sygdom. Undersøgelser tyder dog på god immunogenicitet hos patienter, der har seglcellesygdom, leukæmi eller HIV-infektion, eller som har fået foretaget splenectomier; indgivelse af vaccine til disse patienter er ikke kontraindiceret.
Den anbefalede vaccinationsskema for voksne er blevet godkendt af Advisory Committee on Immunization Practices, American College of Obstetricians and Gynecologists og American Academy of Family Physicians. MMWR’s standard fodnoteformat er blevet ændret med henblik på offentliggørelse af dette skema.
Opfordret citat: Centers for Disease Control and Prevention. Anbefalet vaccinationsskema for voksne — USA, oktober 2005–september 2006. MMWR 2005;54:Q1–Q4.
Dette skema angiver de anbefalede aldersgrupper og medicinske indikationer for rutinemæssig administration af aktuelt godkendte vacciner til personer i alderen >19 år. Licenserede kombinationsvacciner kan anvendes, når nogen af komponenterne i kombinationen er indiceret, og når vaccinens andre komponenter ikke er kontraindiceret. For detaljerede anbefalinger henvises til producenternes indlægssedler og de fuldstændige erklæringer fra ACIP (http://www.cdc.gov/nip/publications/acip-list.htm).
Rapporter alle klinisk signifikante reaktioner efter vaccination til Vaccine Adverse Event Reporting System (VAERS). Rapporteringsformularer og instruktioner om indgivelse af en VAERS-rapport kan fås pr. telefon på 800-822-7967 eller på VAERS-webstedet på http://www.vaers.hhs.gov.
Informationer om, hvordan man indgiver et krav om kompensation for vaccinskader, findes på http://www.hrsa.gov/osp/vicp eller pr. telefon på 800-338-2382. For at indgive et krav for vaccineskader skal du kontakte U.S. Court of Federal Claims, 717 Madison Place, N.W., Washington, DC 20005, telefon 202-357-6400.
Der kan også fås yderligere oplysninger om ovennævnte vacciner og kontraindikationer for vaccination på http://www.cdc.gov/nip eller fra CDC-INFO Contact Center på 800-CDC-INFO (232-4636) på engelsk og spansk, 24 timer i døgnet, 7 dage om ugen.
Anvendelse af handelsnavne og kommercielle kilder er udelukkende til identifikation og indebærer ikke godkendelse fra det amerikanske sundhedsministerium.Henvisninger til ikke-CDC-websteder på internettet leveres som en service til MMWR-læsere og udgør ikke eller indebærer ikke godkendelse af disse organisationer eller deres programmer fra CDC eller det amerikanske sundhedsministerium. CDC er ikke ansvarlig for indholdet af de sider, der findes på disse websteder. De URL-adresser, der er anført i MMWR, var aktuelle på udgivelsesdatoen.
Disclaimer Alle MMWR HTML-versioner af artikler er elektroniske konverteringer fra ASCII-tekst til HTML. Denne konvertering kan have resulteret i tegnoversættelse eller formatfejl i HTML-versionen. Brugerne bør ikke stole på dette HTML-dokument, men henvises til den elektroniske PDF-version og/eller den originale MMWR-papirudgave for at få den officielle tekst, figurer og tabeller. En original papirudgave af dette nummer kan fås ved henvendelse til Superintendent of Documents, U.S. Government Printing Office (GPO), Washington, DC 20402-9371, telefon: (202) 512-1800. Kontakt GPO for aktuelle priser.
**Spørgsmål eller meddelelser vedrørende fejl i formateringen skal rettes til [email protected].
Dat er sidst revideret: 10/13/2005
