A: AMINO ACIDS
BIOCHEMISTRY – DR. JAKUBOWSKI
Sidste opdatering: 27/02/16
Læringsmål/målsætninger for kapitel 2A: Efter undervisningen og denne læsning vil de studerende kunne
- angive ladningen på aminosyresidekæder ved hjælp af Henderson Hasselbach-ligningen og den omtrentlige ladning ved inspektion ved en given pH
- tegne mekanismer og identificere produkter for reaktionen af nukleofile sidekæder Lys og Cys med almindelige kemiske modificeringsmidler og udvide denne forståelse til reaktioner af His.
- tegne mekanismer for disulfidudvekslingsreaktioner for sulfhydryler ved at bruge dem og oxidationstal til at forklare redoxreaktioner af cystein/cystin.
A7. Cystinkemi
To cystein-sidekæder kan interagere kovalent i et protein for at danne et disulfid. Ligesom HOOH (hydrogenperoxid) er mere oxideret end HOH (O i H2O2 har oxidationstal 1-, mens O i H2O har oxidationstal 2-) , er RSSR den oxiderede form (S oxidationstal 1-) og RSH er den reducerede form (S oxidationstal 2-) af thioler. Disse oxidationstal er analoge, da O og S begge er i gruppe 6 i det periodiske system, og begge er mere elektronegative end C.
En hurtig gennemgang af redoxreaktioner og oxidationstal.
Figur: DISULFID – CYSTIN – REAKTIONER
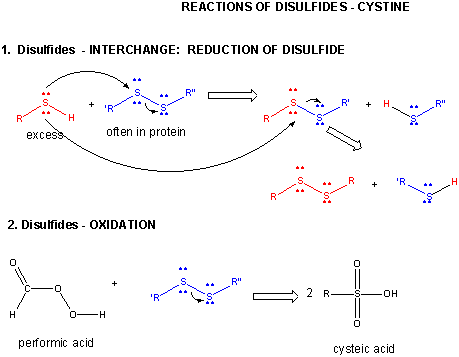
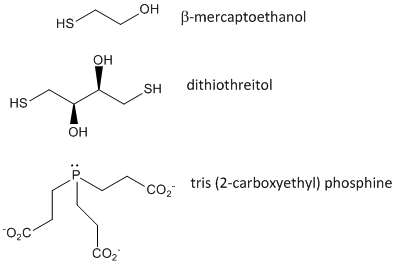
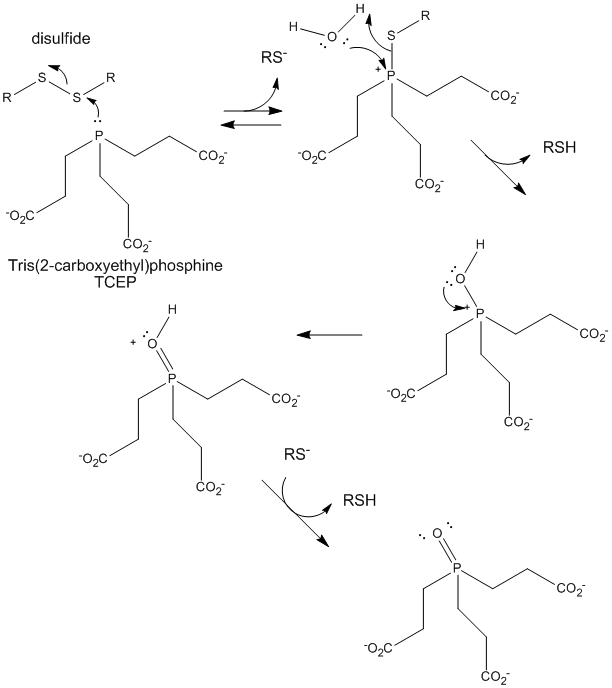
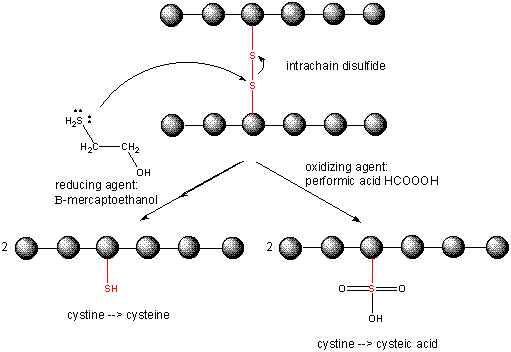
Når et protein foldes, kan to Cys-sidekæder nærme sig hinanden og danne en intrakædet disulfidbinding. Ligeledes kan to Cys-sidekæder på separate proteiner nærme sig hinanden og danne en disulfidbinding mellem kæderne. Sådanne disulfider skal spaltes, og kæderne skal adskilles, før proteinets sekvens kan analyseres. Disulfidet i proteinet kan spaltes ved hjælp af reduktionsmidler såsom beta-mercaptoethanol, dithiothreitol, tris(2-carboxyethyl)phosphin (TCEP) eller oxiderende midler, som yderligere oxiderer disulfidet til separate cysteinsyrer.
Figur: Disulfidoxiderende midler – b-mercaptoethanol, dithiothreitol og fosfiner
Figur: TCEP-reduktion af disulfider
Det indre af cellerne holdes i et reduceret miljø ved tilstedeværelsen af mange “reducerende” midler, såsom tripeptidet g-glu-cys-gly (glutathion). Derfor indeholder intracellulære proteiner normalt ikke disulfider, som er rigelige i ekstracellulære proteiner (f.eks. dem, der findes i blodet) eller i visse organeller såsom det endoplasmatiske retikulum og det mitokondrielle intermembranrum, hvor disulfiderc kan indføres.
Figur:
Spaltning af disulfidbindinger i proteiner
Cystein Redox-kemi
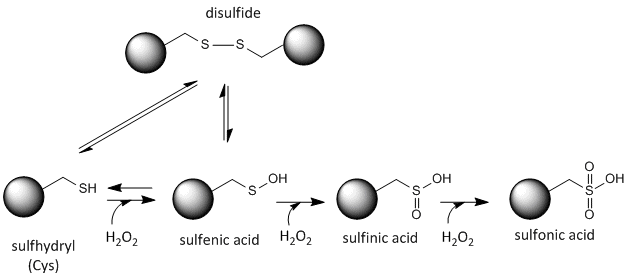
Svovlstoffet i cystein er redox-aktivt og kan derfor eksistere i en lang række forskellige tilstande, afhængigt af det lokale redox-miljø og tilstedeværelsen af oxiderende og reducerende stoffer. Et potent oxidationsmiddel, der kan fremstilles i cellerne, er hydrogenperoxid, som kan føre til mere drastiske og irreversible kemiske modifikationer af Cys-sidekæderne. Hvis et reaktivt Cys er vigtigt for proteinets funktion, kan proteinets funktion moduleres (nogle gange reversibelt, andre gange irreversibelt) med forskellige oxiderende stoffer, som vist i figuren nedenfor.
Figur:Redoxtilstand for cystein
Navigation
Vend tilbage tilKapitel 2A: Aminosyreafsnit
Vend tilbage tilBiochemistry Online Table of Contents
Arkiveret version af det fuldeKapitel 2A: Amino Acids
