 Open Access artikel
Open Access artikel Denne Open Access artikel er licenseret under en
Denne Open Access artikel er licenseret under en
Creative Commons Attribution 3.0 Unported Licence
Guoqiang Liua, Yongsan Liab, Lei Yangd, Yen Weia, Xing Wangb, Zhiming Wangc og Lei Tao *a
*a
aKey Laboratory of Bioorganic Phosphorus Chemistry & Chemical Biology (Ministry of Education), Department of Chemistry, Tsinghua University, Beijing 100084, P. R. China. E-mail: [email protected]
bThe State Key Laboratory of Chemical Resource Engineering, Beijing University of Chemical Technology, Beijing 100029, P. R. China
College of Pharmaceutical Science, Zhejiang Chinese Medical University, Hangzhou, Zhejiang 311400, P. R. China
College of Pharmaceutical Science, Zhejiang Chinese Medical University, Hangzhou, Zhejiang 311400, P. R. China China
dCancer Institute & Hospital, Peking Union Medical College & Chinese Academy of Medical Science, Beijing 100021, P. R. China
Først offentliggjort den 27. marts 2017
Polyethylenglycol (PEG)-derivater er blevet anvendt i vid udstrækning i bio-relateret forskning. PEG-oligomerer (med forskellige molekylvægte) eller PEG-baserede monomerer (med forskellige kædeendegrupper) har imidlertid faktisk forskellige kemiske og fysiske egenskaber, hvilket kan føre til potentiel toksicitet. I dette arbejde er cytotoksiciteten af en række PEG-derivater (oligomerer og monomerer) blevet målt ved hjælp af humane livmoderhalskræftceller (HeLa) og en cellelinje af fibroblaster, der stammer fra mus (L929), som modelceller. De fleste af PEG-oligomerne er sikre for begge celletyper, undtagen triethylenglycol (TEG), som er giftigt i høje koncentrationer for L929-celler. På den anden side viste PEG-baserede monomerer, herunder poly(ethylenglycol)methyletheracrylat (mPEGA) og poly(ethylenglycol)methylethermethacrylat (mPEGMA), tydelig cytotoksicitet. Efterfølgende er disse toksiske PEG-derivater blevet undersøgt for at afdække de forskellige mekanismer bag deres toksicitet. Denne aktuelle forskning evaluerede PEG-derivaternes cytotoksicitet og påpegede den potentielle fare ved “sikre” biomaterialer, hvilket kan være en nyttig reference for folk til at bruge PEG-derivater i fremtidig biomedicinsk forskning.
Indledning
Polyethylenglycol (PEG) er blevet anvendt i vid udstrækning på forskellige medicinske områder på grund af dets fremragende egenskaber såsom tilfredsstillende sikkerhed, biokompatibilitet, hydrofilicitet osv. PEG er f.eks. blevet anvendt i nogle Food and Drug Administration-godkendte afføringsmidler på grund af dets fremragende evne til at holde på fugten og smøre.1-3 Et andet eksempel er, at modificering af lægemidler/proteiner med PEG (PEGylering) effektivt kan forbedre deres vandopløselighed og halveringstid for lægemidler4,5 , hvilket resulterer i øget sikkerhed og terapeutiske virkninger. PEGylering er faktisk ved at blive en af de mest attraktive bioteknologier og opnår stor succes inden for grundforskning og på markedet.6-11 På nuværende tidspunkt er mange PEG-derivater blevet brugt som fremragende udgangsmaterialer til at syntetisere en række nye polymere materialer til bioanvendelser.12 For eksempel er en lineær PEG blevet modificeret som en difunktionaliseret PEG (DF-PEG), som kunne bruges til hurtigt at generere en interessant selvhelbredende hydrogel.13,14 Nogle PEG-oligomerer er blevet anvendt til at modificere overfladen af uorganiske nanopartikler for at forbedre vandopløseligheden og reducere toksiciteten af disse uorganiske materialer.15-17 Nogle kommercielle PEG-baserede monomerer såsom poly(ethylenglycol)methyletheracrylat (mPEGA) og poly(ethylenglycol)methylethermethacrylat (mPEGMA) er blevet anvendt til at fremstille forgrenede polymerer til efterfølgende proteinkonjugering, selvmontering, lægemiddelafgivelse osv.18-27
Selv om PEG normalt betragtes som næsten ikke-toksisk, har forskere bemærket nogle usikre problemer med PEG med lav molekylvægt. Smyth et al. rapporterede om kronisk oral toksicitet af PEG-oligomer (Mn ∼ 200) hos rotter28,29 , og de negative resultater er også blevet observeret hos aber30 , hvilket tyder på potentielle sikkerhedsproblemer med disse “sikre” materialer. I betragtning af den brede anvendelse af PEG-derivater på forskningsområder er det derfor nødvendigt og vigtigt at foretage en systematisk undersøgelse af cytotoksiciteten af disse PEG-oligomerer og PEG-baserede monomerer med henblik på deres videre anvendelse på biorelaterede områder (skema 1).
I det aktuelle arbejde blev cytotoksiciteten af nogle PEG-oligomerer (med forskellige molekylvægte) og kommercielle PEG-baserede monomerer (med forskellige kædeendegrupper) for humane livmoderhalskræftceller (HeLa) og en cellelinje af fibroblast afledt af mus (L929) evalueret. Den molekylvægt-afhængige cytotoksicitet af PEG-oligomerer er blevet observeret, og de forskellige cytotoksicitetsmekanismer for PEG-oligomerer og PEG-baserede monomerer blev afsløret for første gang. Disse cytotoksicitetsoplysninger om PEG-derivater kan være værdifulde referencer for folk til at vælge PEG som udgangsmaterialer og designe rensningsruter for at fremstille biokompatible PEG-baserede materialer til yderligere biomedicinske anvendelser.
Materialer og metoder
2.1 Kemikalier
Triethylenglycol (TEG, 97 %, HEOWNS), PEG-400 (Mn ∼ 400, TCI), PEG-1000 (Mn ∼ 1000, Jiangsu Haitian Petrochemical Works), PEG-2000 (Mn ∼ 2000, SCRC), PEG-4000 (Mn ∼ 4000, SCRC), poly(ethylenglycol)methyletheracrylat 480 (mPEGA-480, Mn ∼ 480, Sigma-Aldrich), poly(ethylenglycol)methylethermethacrylat 500 (mPEGMA-500, Mn ∼ 500, Sigma-Aldrich) og poly(ethylenglycol)methylethermethacrylat 950 (mPEGMA-950, Mn ∼ 950, Sigma-Aldrich) blev anvendt direkte uden yderligere rensning.
Humane livmoderhalskræftceller (HeLa) og en cellelinje af fibroblast afledt af mus (L929) blev erhvervet fra American type culture collection (ATCC). Dulbecco’s modificeret ørne-medium (DMEM, Corning-Cellgro), fosfatbufferet saltvand (PBS, pH ∼ 7,2-7,4, 0,01 M, Solarbio), føtalt kvægserum (FBS, Gibco), Roswell Park Memorial Institute 1640-kulturmedium (RPMI 1640-kulturmedium, Gibco), penicillin-streptomycinopløsning (Gibco), trypsin-EDTA (Gibco, 0.25%), 4-(3-(3-(2-methoxy-4-nitrophenyl)-2-(4-nitrophenyl)-2H-tetrazol-3-ium-5-yl)benzen-1,3-disulfonat (CCK-8, Beyotime), 2,7-dichlordihydrofluorescein-diacetat (DCFH-DA, Beyotime), oxideret glutathion (GSSG, Beyotime), nicotinamid adenin dinukleotidfosfat (NADPH, Beyotime), 5,5′-dithiobis-(2-nitrobenzoesyre) (DTNB, Beyotime), fluoresceindiacetat (FDA, Sigma) og propidiumjodid (PI, 94 %, Sigma) blev anvendt som købt.
2.2 Celledyrkning
Celledyrkningen blev opretholdt i et inkubator på 37 °C med 5 % CO2, og kulturmediet blev skiftet hver eller hver anden dag for at opretholde cellernes eksponentielle vækst. HeLa-celler var afledt af livmoderhalskræftceller og blev dyrket i DMEM-medium suppleret med 10 % føtal bovin serum (FBS) og 1 % penicillin og streptomycin. L929-celler stammer fra mus og blev dyrket i RPMI 1640-medium suppleret med 10 % føtal bovin serum (FBS) og 1 % penicillin og streptomycin.
2.3 Cytotoksicitetsanalyse
Resultaterne blev præsenteret som gennemsnit ± standardafvigelse (SD), og den halvt maksimalt hæmmende koncentration 50% (IC50) værdierne af PEG-derivater blev beregnet ved hjælp af SPSS 15.0.
I overensstemmelse med vores tidligere arbejde32,33 kunne fluorescein diacetat (FDA) og propidiumjodid (PI) anvendes som en hurtig og bekvem dobbeltfarvningsmetode til at observere cellens levedygtighed. L929-celler blev udsået i en 24-hulsplade med en tæthed på ∼5 × 104 celler pr. mL. Efter tilhæftning blev cellerne vasket med PBS og dyrket med forskellige koncentrationer af PEG-derivater i kulturmedium i 24 timer. Derefter blev der tilsat en PBS-FDA-PI-blanding (FDA: 3 μg mL-1; PI: 3 μg mL-1), og 24-brøndepladen blev inkuberet ved 37 °C i 15 minutter. Et fluorescensmikroskop (Leica Germany) blev anvendt til at observere de levende og døde celler under henholdsvis 450-490 nm og 515-560 nm båndpasnings excitationsfiltre (I3 og N2.1) (100 W kviksølvlampe).
Kort fortalt blev L929-celler udsået i en 24-well-plade og inkuberet i 0,5 mL kulturmedium med forskellige koncentrationer af TEG (A, A′) i 1 time (Fig. 1), A1-A6 brønde blev brugt til at måle den samlede mængde glutathion (GSH + GSSG), mens A′1-A′6 brønde blev brugt til at måle mængden af oxideret glutathion (GSSG) i tilstedeværelsen af TEG. Efter 1 time blev cellerne opsamlet ved trypsindigmentering og centrifugering (1000 rpm, 5 min). Derefter blev der tilsat tredobbelt volumen proteinfjernelsesopløsning (50 mg mL-1) for at fjerne de larmende proteiner. Efter tre hurtige frysnings- og optøningscyklusser i flydende nitrogen og et 37 °C vandbad blev suspensionen anbragt i et køleskab (4 °C) i 5 min, og prøverne af celleoverstand blev udtaget efter centrifugering (10 000 rpm, 10 min). Prøver fra A1-A6-brønde blev anvendt til måling af det samlede glutathionniveau (GSH + GSSG). NADPH-opløsning (0,5 mg mL-1) blev tilsat for at reducere alt glutathion til GSH, hvorefter 5,5′-dithiobis-(2-nitrobenzoesyre) (DTNB) blev anvendt til at oxidere GSH, og den ændrede absorbans ved 405 nm blev registreret med en mikropladelæser (VICTOR™ X3 PerkinElmer 2030 Multilabel Plate Reader).35,36 Prøver fra A′1-A′6-brønde blev anvendt til at måle niveauet af oxideret glutathion (GSSG). Ved at bruge GSH-fjernelsesopløsningen blev der kun GSSG tilbage i prøveopløsningen. Prøverne blev analyseret efter samme metode som ovenfor for at måle GSSG-niveauet. Den samlede glutathionmængde og mængden af oxideret glutathion blev indsamlet for at beregne niveauet af reduceret glutathion, mens GSH-niveauet for celler i rent kulturmedium blev anvendt som kontrol. Resultaterne blev præsenteret som gennemsnit ± SD.
000 rpm, 10 min). Prøver fra A1-A6-brønde blev anvendt til måling af det samlede glutathionniveau (GSH + GSSG). NADPH-opløsning (0,5 mg mL-1) blev tilsat for at reducere alt glutathion til GSH, hvorefter 5,5′-dithiobis-(2-nitrobenzoesyre) (DTNB) blev anvendt til at oxidere GSH, og den ændrede absorbans ved 405 nm blev registreret med en mikropladelæser (VICTOR™ X3 PerkinElmer 2030 Multilabel Plate Reader).35,36 Prøver fra A′1-A′6-brønde blev anvendt til at måle niveauet af oxideret glutathion (GSSG). Ved at bruge GSH-fjernelsesopløsningen blev der kun GSSG tilbage i prøveopløsningen. Prøverne blev analyseret efter samme metode som ovenfor for at måle GSSG-niveauet. Den samlede glutathionmængde og mængden af oxideret glutathion blev indsamlet for at beregne niveauet af reduceret glutathion, mens GSH-niveauet for celler i rent kulturmedium blev anvendt som kontrol. Resultaterne blev præsenteret som gennemsnit ± SD.
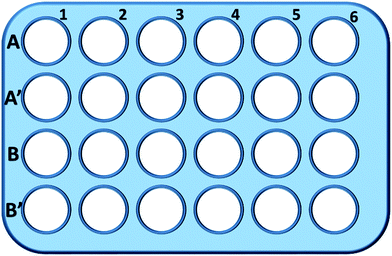
Brønde i linje B og B′ blev brugt til at teste den samlede mængde GSH og GSSG i nærværelse af henholdsvis mPEGA-480 ved samme procedure.
Resultater og diskussion
3.1 Celleviabilitetsundersøgelse
Når HeLa-cellen (en model for kræftceller) blev anvendt (fig. 2A), kunne cytotoksiciteten af alle PEG-oligomerer ved lave koncentrationer (≤5 mg mL-1) ignoreres. Ved øget koncentration (≥10 mg mL-1) blev der observeret molekylvægt-afhængig cytotoksicitet af PEG-prøver. Triethylenglycol (TEG) viste tydelig cytotoksicitet over 10 mg mL-1 (p < 0,05; i modsætning til alle andre oligomerer, når koncentrationen er over 5 mg mL-1), og IC50-værdien af TEG for HeLa-celler blev beregnet som 19,8 mg mL-1. I mellemtiden viste andre PEG-oligomerer (Mn ∼ 400-4000) også en lille cytotoksicitet.
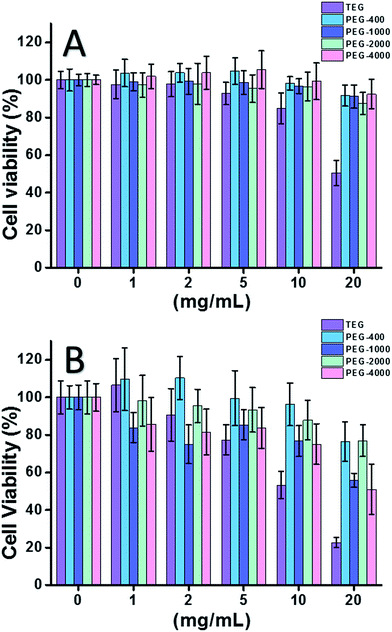
Cytotoksiciteten af PEG-oligomerer over for L929-celler (en model for normale celler) blev også vurderet (fig. 2B). Cellens levedygtighed faldt som forventet med stigende PEG-koncentration. Ud over TEG viste nogle PEG-oligomerer (PEG-1000, PEG-4000), som er sikre for HeLa-celler, også påviselig cytotoksicitet, IC50-værdierne for TEG, PEG-1000 og PEG-4000 blev beregnet som henholdsvis 12,4, 22,5 og 20,0 mg mL-1 for L929-celler, hvilket også indikerer den molekylvægt-afhængige cytotoksicitet af PEG-oligomerer.
Overstående resultater antydede, at HeLa-celler har en bedre tolerance over for PEG-oligomerer end L929-celler på grund af kræftcellers vedholdende vitalitet, og TEG har meget højere cytotoksicitet end andre PEG-oligomerer med højere molekylvægt (p < 0,05; kontrast med enhver anden oligomer, når koncentrationen er over 5 mg mL-1). Det bemærkes, at den aktuelle forskning påviste den moderate cytotoksicitet af PEG-1000 og PEG-4000 over for L929-celler og den næsten ikke-cytotoksicitet af PEG-400 og PEG-2000, hvilket er forskelligt fra det almindelige indtryk, at PEG’er med høj molekylvægt skulle være mere biokompatible end deres modstykker med lav molekylvægt. Selv om årsagen til PEG’s cytotoksicitet stadig ikke er klarlagt, synes PEG-400 og PEG-2000 at være bedre valg for folk, der ønsker at syntetisere biokompatible materialer.
Da mPEGMA-500 blev testet, faldt celleviabiliteten af både HeLa-celler og L929-celler med øget koncentration af mPEGMA-500 (fig. 3A), og der blev ikke observeret nogen tydelig forskel mellem to celletyper. IC50-værdierne for mPEGMA-500 er 4,7 mg mL-1 for HeLa-celler og 5,3 mg mL-1 for L929-celler efter 24 timers dyrkning, hvilket indikerer en mere betydelig cytotoksicitet af mPEGMA-500 end ovennævnte PEG-oligomerer og antyder, at kædeendegrupperne af PEG-derivater er afgørende for deres toksicitet. Da mPEGMA-950, et andet PEG-baseret methacrylat med samme kædeendegruppe, men højere molekylvægt, blev testet efter samme procedure (fig. 3B), blev der observeret en meget lavere cytotoksicitet af mPEGMA-950 over for HeLa-celler eller L929-celler (p < 0,05; når koncentrationen er over 2 mg mL-1), IC50-værdierne for mPEGMA-950 er 20,8 mg mL-1 for HeLa-celler og 21,8 mg mL-1 for HeLa-celler.7 mg mL-1 til L929-celler efter 24 timers dyrkning, hvilket også viser den molekylvægt-afhængige cytotoksicitet af PEG-baseret methacrylat.
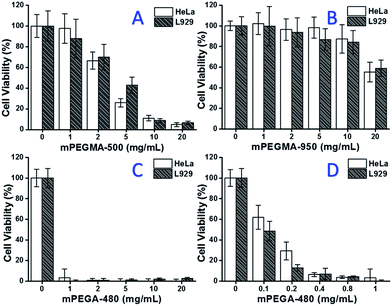
Det PEG-baserede akrylat mPEGA-480 blev desuden også testet. Selv om forskellen mellem mPEGA-480 og mPEGMA-500 kun er en methylgruppe i kædeenden, viste mPEGA-480 akut cytotoksicitet (fig. 3C). Mere end 95 % af cellerne mistede deres levedygtighed selv med 1 mg mPEGA-480 mPEGA-480 i kulturmediet. Der skal således udføres yderligere forsøg med lavere koncentrationer for at bestemme dens cytotoksicitet (Fig. 3D), og IC50-værdierne for mPEGA-480 blev beregnet som 0,2 mg mL-1 for HeLa-celler og 0,1 mg mL-1 for L929-celler efter 24 timers dyrkning.
Celleviabilitetsforsøgene bekræftede, at både kædeendegrupper og molekylvægt er vigtige indflydelseselementer for PEG-derivaternes cytotoksicitet, og de PEG-baserede monomerer viste en langt mere mærkbar cytotoksicitet sammenlignet med PEG-oligomerer.
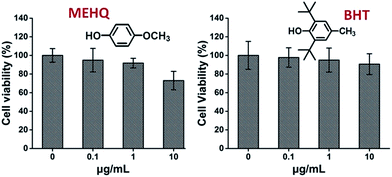
I mellemtiden blev cytotoksiciteten af inhibitorer i PEG-baserede monomerer, hydroquinonmethylether (MEHQ, 100 ppm i mPEGA) og butyleret hydroxytoluen (BHT, 300 ppm i mPEGMA), også evalueret (fig. 4), og L929-cellerne forblev høj levedygtighed (≥90 %) ved lavt koncentrerede inhibitorer (≤1 μg mL-1). Der er 0,1 μg mL-1 MEHQ i 1 mg mL-1 mPEGA-480 og 3 μg mL-1 BHT i 10 mg mL-1 mPEGA-500, mens mPEG-480 og mPEGMA-500 udviste tydelig cytotoksicitet ved disse koncentrationer. Således synes spormængden af inhibitorer i PEG-baserede monomerer at have en ubetydelig indflydelse på monomerernes cytotoksicitet.
3.2 Observation af cellemorfologi
Optisk mikroskopobservation blev anvendt til direkte at evaluere cytotoksiciteten af PEG-derivater til L929-celler. De optiske billeder af L929-celler, der blev udsat for 20 mg mL-1 TEG og 0,1 mg mL-1 mPEGA i 24 timer, blev vist i henholdsvis figur 5A og B.
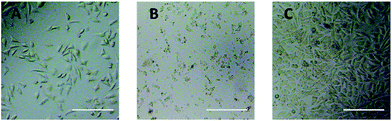
Efter inkubation med 20 mg mL-1 TEG i 24 timer beholdt cellerne den samme morfologi (Fig. 5A) som i kontrolgruppen (Fig. 5C, celler i rent kulturmedium), men celletallet faldt dramatisk, hvilket indikerer cytotoksiciteten af TEG i høj koncentration, hvilket førte til død og efterfølgende løsrivelse af cellerne fra mikropladens bund. Fig. 5B viste morfologien af L929-celler efter inkubation med 0,1 mg mL-1 mPEGA-480. Næsten alle celler mistede normal morfologi, hvilket tyder på den akutte cytotoksicitet af mPEGA-480 selv ved en så lav koncentration.
Dertil kommer, at cellerne også blev farvet med fluorescein. FDA/PI-dobbeltfarvning er en hurtig, enkel og samtidig procedure til at observere levende og døde celler.43 FDA kan trænge ind i hele cellerne og ophobes i cellerne, og derfor er det nødvendigt med en komplet cellemembran for at forhindre, at fluorescein lækker ud af cellen. I modsætning hertil kan PI ikke passere gennem den intakte cellemembran, men kan farve kernen i døde celler ved at passere gennem den beskadigede cellemembran. Som det fremgår af fig. 6, har L929-celler, der er inkuberet med 20 mg mL-1 TEG, færre levedygtige celler efter FDA-farvning (fig. 6b) sammenlignet med kontrollen (fig. 6a), og der kan observeres flere døde celler efter PI-farvning (fig. 6b), og der kan observeres flere døde celler efter PI-farvning (fig. 6b). 6b′), hvilket er identisk med resultatet ved observation ved optisk mikroskopi. mPEGA-480’s akutte cytotoksicitet blev også observeret efter FDA/PI-dobbeltfarvningsproceduren, idet der ikke kunne identificeres noget grønt signal efter inkubation af celler med 0,1 mg mL-1 mPEG-480 i 24 timer (fig. 6c og c′′′).
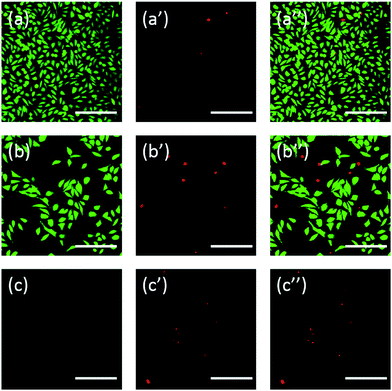
Både optiske og fluorescerende billeder viste intuitivt cytotoksiciteten af disse PEG-derivater, hvilket yderligere understøtter den konklusion, der blev opnået gennem CCK-8-analyser. Det bemærkes, at mPEGA-480 virkede mere giftig ved FDA/PI-dobbeltfarvning, hvilket skyldes, at FDA/PI-dobbeltfarvning skelner mellem fuldstændigheden af levende/døde cellemembraner, mens CCK-8-analysen registrerer aktiviteten af dehydrogenase i mitokondrier, hvilket tyder på, at FDA/PI-farvning er et glimrende supplement til CCK-8-analysen for at give flere detaljer om cellestatusen.
3.3 Mekanismeundersøgelse
Ifølge celleviabilitetsforsøgene blev IC50-værdierne for PEG-oligomerer og PEG-baserede monomerer til HeLa- og L929-celler efter 24 timers dyrkning beregnet og opsummeret (tabel 1), hvilket tyder på, at de PEG-baserede monomerer er meget mere toksiske for celler end PEG-oligomerer, og mPEGA har den højeste cytotoksicitet. Generering af ROS og nedgang af GSH i cellerne, to hovedmekanismer for cytotoksicitet, blev derfor analyseret for at undersøge den mulige årsag til cytotoksicitet.
| TEG | PEG-400 | PEG-1000 | PEG-2000 | PEG-4000 | mPEGMA-500 | mPEGMA-950 | mPEGA-480 | |
|---|---|---|---|---|---|---|---|---|
| HeLa-celler | 19.8 | 32,5 | 36,2 | 38,2 | 29,6 | 4,7 | 20,8 | 0,2 |
| L929 celler | 12,4 | 24.7 | 22,5 | 28,7 | 20,0 | 5,3 | 21,7 | 0,1 |
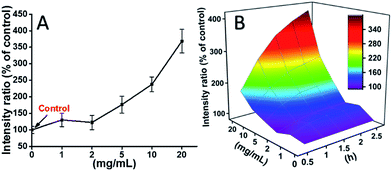
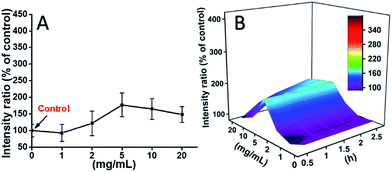
L929-celler blev inkuberet med TEG, og ROS-niveauerne på forskellige tidspunkter (0, 0,5, 1,0, 1,5, 2 timer) blev detekteret i henhold til vores tidligere rapporter og vist i fig. 7. Som et eksempel blev ROS-niveauerne efter inkubation med forskellige koncentrationer TEG i 2 timer vist i fig. 7A. Det er tydeligt at se, at ROS-niveauerne holdt sig stabile ved lav TEG-koncentration (≤2 mg mL-1), men steg betydeligt, når TEG-koncentrationen er højere end 2 mg mL-1, hvilket stemmer overens med resultatet af celleviabilitetsforsøget i Fig. 2B. Tilsvarende blev tallene for ROS-niveauet vs. TEG-koncentrationen på forskellige tidspunkter tegnet og slået sammen for at få et 3D-kort (fig. 7B). De maksimale ROS-niveauer blev fundet ved 2 timer med 20 mg mL-1 TEG, et ca. 400 % forøget ROS-niveau i forhold til kontrol (ROS-niveau = 100) blev påvist, hvilket resulterede i den lyseste fluorescensintensitet. Disse resultater tyder på, at generering af ROS er den mulige mekanisme for TEG’s cytotoksicitet, og at det høje ROS-niveau, der induceres af TEG, kan være hovedårsagen til celleapoptose.
De ROS-niveauer, der blev induceret af mPEGA-480 efter 2 timer, blev også testet (fig. 8A). I modsætning til TEG forårsagede mPEGA ikke den hurtige stigning af ROS i cellerne, kun ∼170% ROS-stigning sammenlignet med kontrollen blev observeret som maksimum. 3D ROS-niveauet vs. mPEGA & tid (Fig. 8B) viste ROS-niveauet induceret af mPEGA-480 som en bølge, og toppen optrådte ved moderat koncentration af mPEGA (5 mg mL-1), der kan ikke observeres nogen betydelig generering af ROS, hvilket tyder på, at genereringen af ROS måske kun delvis bidrager til cytotoksiciteten af mPEGA-480.
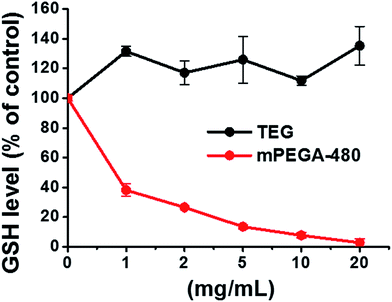
Den reducerende thiolgruppe i GSH er en vigtig anti-oxidationskilde i organismer. En mulig mekanisme for cytotoksiciteten af mPEGA-480 tilskrives heraf Michael-additionsreaktionen mellem thiolgruppen og vinylbindingen, hvilket fører til den brudte intracellulære redoxligevægt og celleapoptose. Tidligere forskning tydede på, at Michael-additionen mellem thiol og akrylat er meget hurtigere end mellem thiol og methacrylat,52 hvilket kan være en rimelig årsag til den forskellige akutte cytotoksicitet mellem mPEGA-480 og mPEGMA-500.
Konklusioner
Cytotoksiciteten af PEG-oligomerer og PEG-baserede monomerer til HeLa-celler og L929-celler blev evalueret for første gang. Koncentrationsafhængig cytotoksicitet af PEG-oligomerer og PEG-baserede monomerer er blevet bekræftet og præsenteret som IC50-værdier for HeLa-celler og L929-celler. PEG-400 og PEG-2000 synes næsten ikke at være cytotoksiske i den nuværende forskning. PEG-1000, PEG-4000 og mPEGMA-950 viste moderat cytotoksicitet, især ved høje koncentrationer. TEG og mPEGMA-500 udviste betydelig cytotoksicitet, og mPEGA-480 udviste akut cytotoksicitet. Desuden har celletyperne også indflydelse på resultaterne af cytotoksicitetsundersøgelsen, idet HeLa-celler er mere robuste end L929-celler til at tolerere PEG-derivater. Disse resultater om PEG-derivaternes cytotoksicitet er foreløbige, men grundlæggende for deres fremtidige biomedicinske anvendelse, og flere oplysninger om cellernes reaktion og adfærd over for andre PEG-derivater vil blive undersøgt yderligere.
Anerkendelser
Denne forskning blev støttet af National Science Foundation of China (21574073, 21534006).
- M. V. Cleveland, D. P. Flavin, R. A. Ruben, R. M. Epstein og G. E. Clark, South. Med. J., 2001, 94, 478-481 CrossRef CAS PubMed.
- J. A. DiPalma, M. V. B. Cleveland, J. McGowan og J. L. Herrera, Am. J. Gastroenterol., 2007, 102, 1436-1441 CrossRef CAS PubMed.
- B. A. Erickson, J. C. Austin, C. S. Cooper og M. A. Boyt, J. Urol., 2003, 170, 1518-1520 CrossRef CAS PubMed.
- J. L. Cleland, S. E. Builder, J. R. Swartz, M. Winkler, J. Y. Chang og D. I. C. Wang, Bio/Technology, 1992, 10, 1013-1019 CrossRef CAS PubMed.
- Z. Liu, J. T. Robinson, X. M. Sun og H. J. Dai, J. Am. Chem. Soc., 2008, 130, 10876-10877 CrossRef CAS PubMed.
- J. M. Harris og R. B. Chess, Nat. Rev. Drug Discovery, 2003, 2, 214-221 CrossRef CAS PubMed.
- F. M. Veronese og G. Pasut, Drug Discovery Today, 2005, 10, 1451-1458 CrossRef CAS PubMed.
- M. J. Roberts, M. D. Bentley og J. M. Harris, Adv. Drug Delivery Rev., 2002, 54, 459-476 CrossRef CAS PubMed.
- F. M. Veronese, Biomaterials, 2001, 22, 405-417 CrossRef CAS PubMed.
- H. Zhang, T. Zhao, P. Duffy, Y. Dong, A. Ni Annaidh, E. O’Cearbhaill og W. Wang, Adv. Healthcare Mater., 2015, 4, 2260-2268 CrossRef CAS PubMed.
- Y. Dong, Y. Qin, M. Dubaa, J. Killion, Y. Gao, T. Zhao, D. Zhou, D. Duscher, L. Geever, G. C. Gurtner og W. Wang, Polym. Chem., 2015, 6, 6182-6192 RSC.
- T. M. Allen, C. Hansen, F. Martin, C. Redemann og A. Yauyoung, Biochim. Biophys. Acta, Biomembr., 1991, 1066, 29-36 CrossRef CAS.
- Y. L. Zhang, L. Tao, S. X. Li og Y. Wei, Biomacromolecules, 2011, 12, 2894-2901 CrossRef CAS PubMed.
- Y. L. Zhang, B. Yang, L. X. X. Xu, X. Y. Zhang, L. Tao og Y. Wei, Acta Chim. Sin., 2013, 71, 485-492 CrossRef CAS.
- C. C. Luo, Y. H. Zhang, X. W. Zeng, Y. W. Zeng og Y. G. Wang, J. Colloid Interface Sci., 2005, 288, 444-448 CrossRef CAS PubMed.
- S. Dhar, F. X. Gu, R. Langer, O. C. Farokhzad og S. J. Lippard, Proc. Natl. Acad. Sci. U. S. A., 2008, 105, 17356-17361 CrossRef CAS PubMed.
- J. Manson, D. Kumar, B. J. Meenan og D. Dixon, Gold Bull., 2011, 44, 99-105 CrossRef CAS.
- X. Y. Zhang, C. K. Fu, L. Feng, Y. Ji, L. Tao, Q. Huang, S. X. Li og Y. Wei, Polymer, 2012, 53, 3178-3184 CrossRef CAS.
- X. Y. Zhang, J. F. Hui, B. Yang, Y. Yang, D. D. Fan, M. Y. Liu, L. Tao og Y. Wei, Polym. Chem., 2013, 4, 4120-4125 RSC.
- D. Bontempo og H. D. Maynard, J. Am. Chem. Soc., 2005, 127, 6508-6509 CrossRef CAS PubMed.
- K. L. Heredia, Z. P. Tolstyka og H. D. Maynard, Macromolecules, 2007, 40, 4772-4779 CrossRef CAS.
- H. Hussain, K. Y. Mya og C. He, Langmuir, 2008, 24, 13279-13286 CrossRef CAS PubMed.
- J. P. Magnusson, S. Bersani, S. Salmaso, S. Salmaso, C. Alexander og P. Caliceti, Bioconjugate Chem., 2010, 21, 671-678 CrossRef CAS PubMed.
- F. J. Xu, Y. L. Li, E. T. Kang og K. G. Neoh, Biomacromolecules, 2005, 6, 1759-1768 CrossRef CAS PubMed.
- L. L. Yu, L. Yao og K. Yang, J. Porous Mater., 2016, 23, 1581-1589 CrossRef CAS.
- S. Yuan, D. Wan, B. Liang, S. O. Pehkonen, Y. P. Ting, K. G. Neoh og E. T. Kang, Langmuir, 2011, 27, 2761-2774 CrossRef CAS PubMed.
- S. A, Q. Xu, D. Zhou, Y. Gao, J. M. Vasquez, U. Greiser, W. Wang, W. Liu og W. Wang, Polym. Chem., 2017, 8, 1283-1287 RSC.
- H. F. Smyth, C. P. Carpenter og C. S. Weil, J. Am. Pharm. Assoc., 1950, 39, 349-354 CrossRef CAS.
- H. F. Smyth, C. P. Carpenter og C. S. Weil, J. Am. Pharm. Assoc., 1955, 44, 27-30 CrossRef CAS.
- D. E. Prentice og S. K. Majeed, Toxicol. Lett., 1978, 2, 119-122 CrossRef CAS.
- H. Tominaga, M. Ishiyama, F. Ohseto, K. Sasamoto, T. Hamamoto, K. Suzuki og M. Watanabe, Anal. Commun., 1999, 36, 47-50 RSC.
- Y. Li, Y. Zhang, F. Shi, L. Tao, Y. Wei og X. Wang, Colloids Surf., B, 2016, 149, 168-173 CrossRef PubMed.
- B. Yang, Y. Zhang, X. Zhang, L. Tao, S. Li og Y. Wei, Polym. Chem., 2012, 3, 3235-3238 RSC.
- H. Wang og J. A. Joseph, Free Radical Biol. Med., 1999, 27, 612-616 CrossRef CAS PubMed.
- I. K. Smith, T. L. Vieweller og C. A. Thorne, Anal. Biochem., 1988, 175, 408-413 CrossRef CAS PubMed.
- I. Rahman, A. Kode og S. K. Biswas, Nat. Protoc., 2006, 1, 3159-3165 CrossRef CAS PubMed.
- R. Jevprasesphant, J. Penny, R. Jalal, D. Attwood, N. B. McKeown og A. D’Emanuele, Int. J. Pharm., 2003, 252, 263-266 CrossRef CAS PubMed.
- A. K. Gupta og S. Wells, IEEE Trans. Nanobioscience, 2004, 3, 66-73 CrossRef PubMed.
- D. Luo, K. Haverstick, N. Belcheva, E. Han og W. M. Saltzman, Macromolecules, 2002, 35, 3456-3462 CrossRef CAS.
- C. W. Chang, E. Bays, L. Tao, S. N. S. Alconcel og H. D. Maynard, Chem. Commun., 2009, 3580-3582 RSC.
- B. D. Fairbanks, P. A. Gunatillake og L. Meagher, Adv. Drug Delivery Rev., 2015, 91, 141-152 CrossRef CAS PubMed.
- T. Zhou, Y. Zhu, X. Li, X. Liu, K. W. K. Yeung, S. Wu, X. Wang, Z. Cui, X. Yang og P. K. Chu, Prog. Mater. Sci., 2016, 83, 191-235 CrossRef CAS.
- K. H. Jones og J. A. Senft, J. Histochem. Cytochem., 1985, 33, 77-79 CrossRef CAS PubMed.
- M. Hayyan, M. A. Hashim og I. M. AlNashef, Chem. Rev., 2016, 116, 3029-3085 CrossRef CAS PubMed.
- A. Lankoff, W. J. Sandberg, A. Wegierek-Ciuk, H. Lisowska, M. Refsnes, B. Sartowska, P. E. Schwarze, S. Meczynska-Wielgosz, M. Wojewodzka og M. Kruszewski, Toxicol. Lett., 2012, 208, 197-213 CrossRef CAS PubMed.
- Y. Chang, S.-T. Yang, J.-H. Liu, E. Dong, Y. Wang, A. Cao, Y. Liu og H. Wang, Toxicol. Lett., 2011, 200, 201-210 CrossRef CAS PubMed.
- X. Cai, J. Hao, X. Zhang, B. Yu, J. Ren, C. Luo, Q. Li, Q. Huang, X. Shi, W. Li og J. Liu, Toxicol. Appl. Pharmacol., 2010, 243, 27-34 CrossRef CAS PubMed.
- S. J. Park, Y. C. Park, S. W. Lee, M. S. Jeong, K.-N. Yu, H. Jung, J.-K. Lee, J. S. Kim og M.-H. Cho, Toxicol. Lett., 2011, 207, 197-203 CrossRef CAS PubMed.
- K. Pulskamp, S. Diabate og H. F. Krug, Toxicol. Lett., 2007, 168, 58-74 CrossRef CAS PubMed.
- A. M. Studer, L. K. Limbach, L. Van Duc, F. Krumeich, E. K. Athanassiou, L. C. Gerber, H. Moch og W. J. Stark, Toxicol. Lett., 2010, 197, 169-174 CrossRef CAS PubMed.
- T. Thurnherr, C. Brandenberger, K. Fischer, L. Diener, P. Manser, X. Maeder-Althaus, J.-P. Kaiser, H. F. Krug, B. Rothen-Rutishauser og P. Wick, Toxicol. Lett., 2011, 200, 176-186 CrossRef CAS PubMed.
- G. Li, R. K. Randev, A. H. Soeriyadi, G. Rees, C. Boyer, Z. Tong, T. P. Davis, C. R. Becer og D. M. Haddleton, Polym. Chem., 2010, 1, 1196-1204 RSC.
