Insektindsamling er en interessant hobby for mange, men den er også meget nyttig i videnskabelig forskning. Dette indlæg vil forklare, hvordan man samler og bevarer insekter, og vise hvordan de skal pinnes.
Insekter kan samles på alle tidspunkter, selv om de hovedsageligt er til stede i løbet af foråret og frem til det sene efterår. Sommeren er nok det bedste tidspunkt, da insekterne er mest talrige. Varme, solrige dage vil sandsynligvis have flest insekter til stede, men det vil være klogt at kontrollere på forskellige tidspunkter og under forskellige vejrforhold, da forskellige insekter vil dukke op på forskellige tidspunkter. Om natten er gadelygter og verandaer et godt sted at kigge. Løvfald og planter vil sandsynligvis huse insekter, og der er også mange nataktive insekter, som holder sig væk fra lys.
Insamlingsudstyr:
- Insektnet – Disse kan købes eller laves. De bør være lavet af net, som er syet til et muslin- eller lærredsstof, der vikles rundt om tråden. Herfra kan insektet overføres til en krukke, enten ved at sætte krukken ned i nettet eller ved at holde insektet i brystkassen.
-

Min dræberkrukke. PC: Colton Weaver Drabskrukke – Det er bedst at have 2-3 krukker i mange forskellige former og størrelser. Ideelt set er de med kork, men det kan dog afhænge af. De skal være tydeligt mærket med “POISON”. Gips eller bomuld lægges i krukken for at holde det dræbende middel. Borror, Delong og Triplehorn anbefaler cyanid, men ethylacetat kan også anvendes og er betydeligt mere sikkert. Carbon tetrachlorid eller chloroform kan også anvendes.
- Pilleæsker med væv
- Konvolutter, eller papir til at lave dem – Nyttigt til midlertidig opbevaring. Disse kan let fremstilles i felten og vil holde dine prøver relativt sikre.
- Flasker fyldt med konserveringsvæske
- Tang
- Håndlinse
- Aspirator – Disse fanger små insekter i flasker ved hjælp af din ånde. Typisk har de en skærm, der forhindrer dig i at indånde insektet.
- Slående paraply eller lagen – Et lagen eller en paraply placeres under en plante, som derefter slås eller rystes, så små insekter falder ned på lagen.
- Sifter – Bladmuld kan langsomt sigtes på hvidt stof eller karton, og derefter kan de fundne insekter suges op.
- Fælder – Der findes mange typer fælder. En Berlese-tragt har en tragt med en skærm og en pære i toppen, med alkohol i bunden. Insekterne tiltrækkes og falder derefter ned i den dræbende krukke. En lysfælde kan være effektiv mod nogle insekter og kan være så enkel som en lampe over det dræbende middel eller en gåfælde, hvor insekterne sætter sig ned og kan indsamles med hånden. Faldfælder kan bruges til ådselsbiller eller andre ikke-flyvende insekter og er ganske enkelt dåser med lokkemad i bunden. Insekterne falder i og kan ikke undslippe. En simpel fælde kan blot være en sukkeropløsning spredt ud på en overflade.
- Hovedlampe
- Skaftkniv
Håndtering af fangsten: Mange insekter med blødt legeme kan lægges direkte i 70-90% isopropyl- eller ethylalkohol. Dette omfatter larver og nymfer af mange arter samt nogle mindre insekter. Hårdtlevende insekter bør lægges i et glas til aflivning. Hvor lang tid det tager, afhænger af insektet såvel som af aflivningsmidlet og kan variere fra et par minutter til et par timer. Når insektet er dødt, bør det fjernes så hurtigt som muligt for at undgå yderligere misfarvning. De kan opbevares i pilleæsker eller i de ovenfor beskrevne papirkuverter.
Relaxing: Hvis man ikke kan fastgøre og sprede et eksemplar med det samme, vil det sandsynligvis tørre ind. Når det er i denne tilstand, er det ret skørt og vil gå i stykker, hvis man forsøger at arrangere det. For at afhjælpe dette kan du enten bruge et afslapningskammer, afslapningsvæske eller koge insektet i vand (dette kan dog skade det).
Afslapningskamre er beholdere med vådt sand eller stof indeni. Ideelt set bør der tilsættes karbolsyre for at forhindre, at der opstår skimmelsvamp. Efter et døgn eller to bør man kunne manipulere med eksemplaret igen.
Relaxeringsvæske kan laves af forskellige blandinger, og normalt lader man insektet ligge i det i flere minutter. En blanding, der ofte er kendt som Barber’s væske, er anført nedenfor:
| 95% ethylalkohol | 50 cm3 |
| Vand | 50cm3 |
| Ethyl acetat | 20cm3 |
| Benzen | 7cm3 |
En anden metode, der kan anvendes, er indsprøjtning af ledningsvand. Dette virker på mange Lepidoptera. Ved hjælp af en 20-25 gauge-nål sprøjtes vand ind i thoraxet under vingen, indtil det er helt fyldt. Efter 5-20 minutter bør dit insekt være afslappet.
Konservering i væske: Dette kan bruges på mange insekter med blødt legeme (f.eks. enmåfluer, stenfluer, dyndfluer m.m.), som ikke kan pinnes, medmindre de er tørret som nævnt ovenfor. Det er også nyttigt til meget små eksemplarer, der skal undersøges på objektglas, samt insektlarver og -nymfer. Leddyr, der ikke er insekter, bør også konserveres på denne måde.
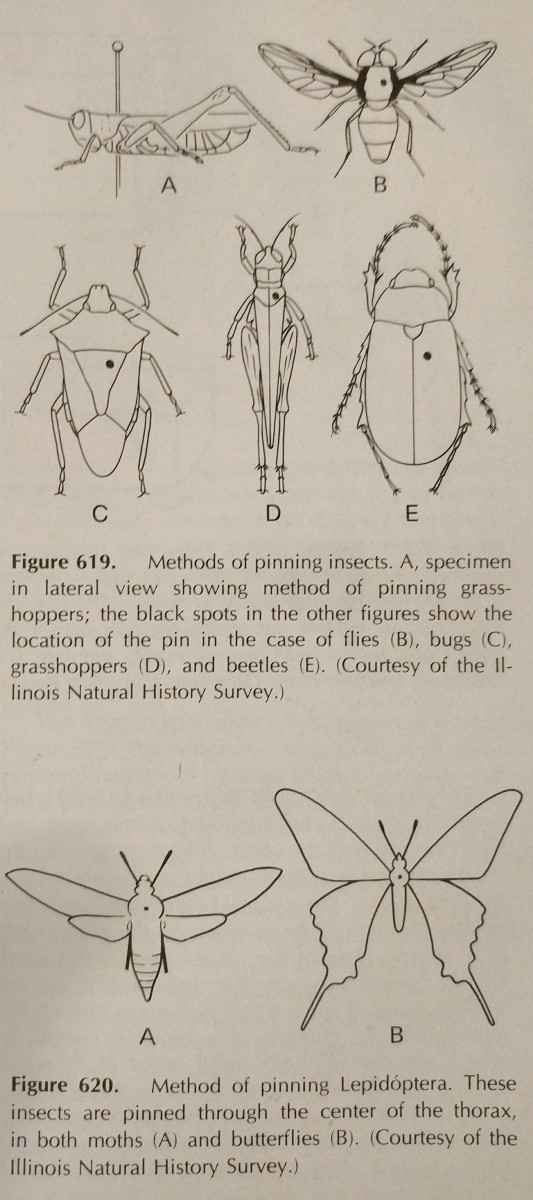
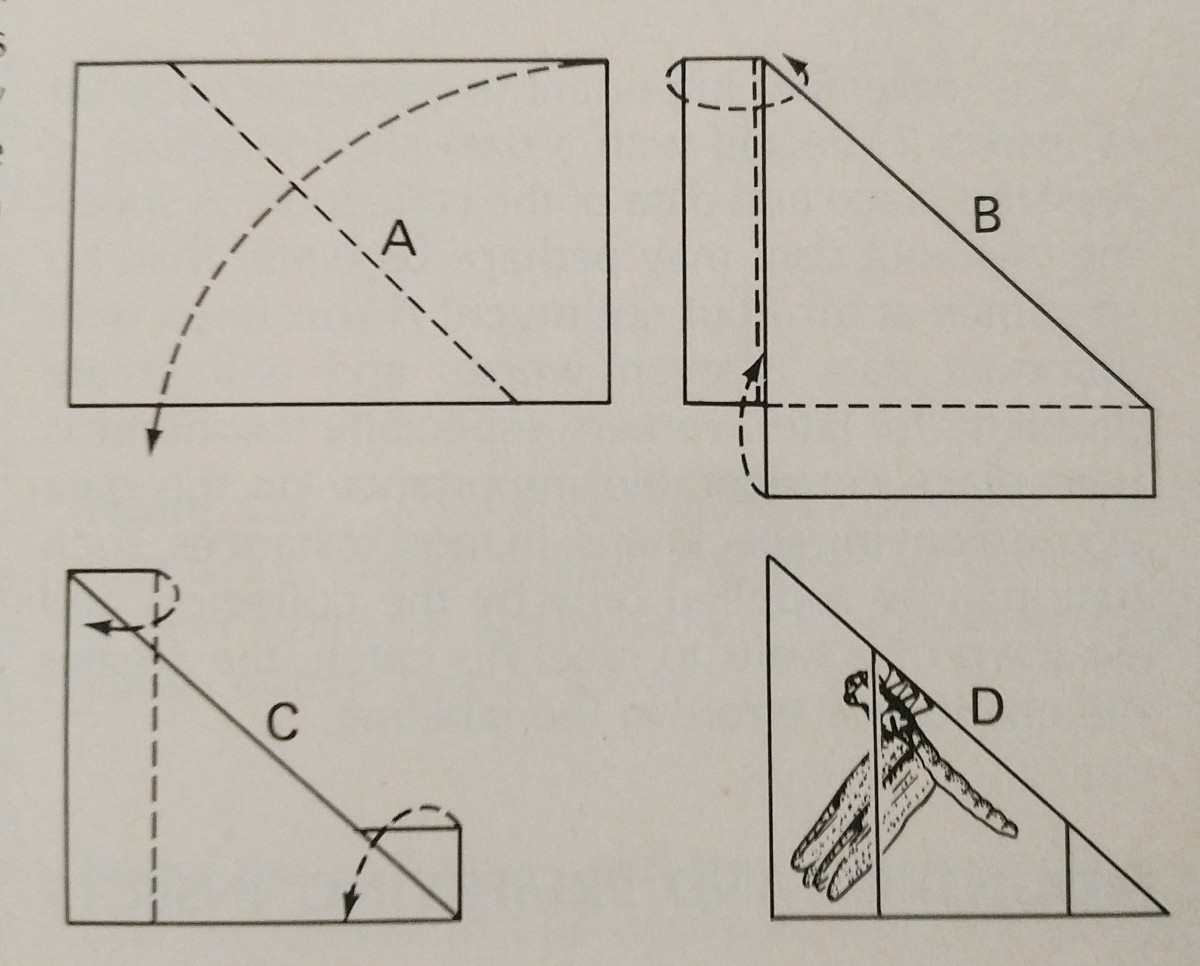
Pinning: Dette er den letteste måde at konservere et hårdtlevende insekt på. Farverne falmer ofte, når insektet tørrer, men dette er dog svært at undgå. Der bør anvendes specielle insektnåle, som er længere og ikke ruster. Disse fås i størrelserne 00-7, men de mindre kan være mindre anvendelige. Forskellige bestillinger bør fastgøres på forskellige steder, hvilket er vist på billedet. Benene skal være udstrakte, og det samme gælder for vingerne. Ofte vil bierne have tungen udstrakt for at gøre det lettere at identificere dem.
Det er bedst, hvis alle arter i en samling er pinned i ensartede afstande. Omkring 25 mm over spidsen er ideelt, og ensartede afstande kan let opnås ved at bruge en pinningblok, som blot er en træblok med huller boret i forskellige dybder.
Spredning af et insekt handler i høj grad om øvelse. Brug af et spredningsbræt gør opgaven meget lettere,
og det er vigtigt at have ekstra stifter og papirstrimler. Stifter kan bruges til at flytte rundt på lemmer og vinger.
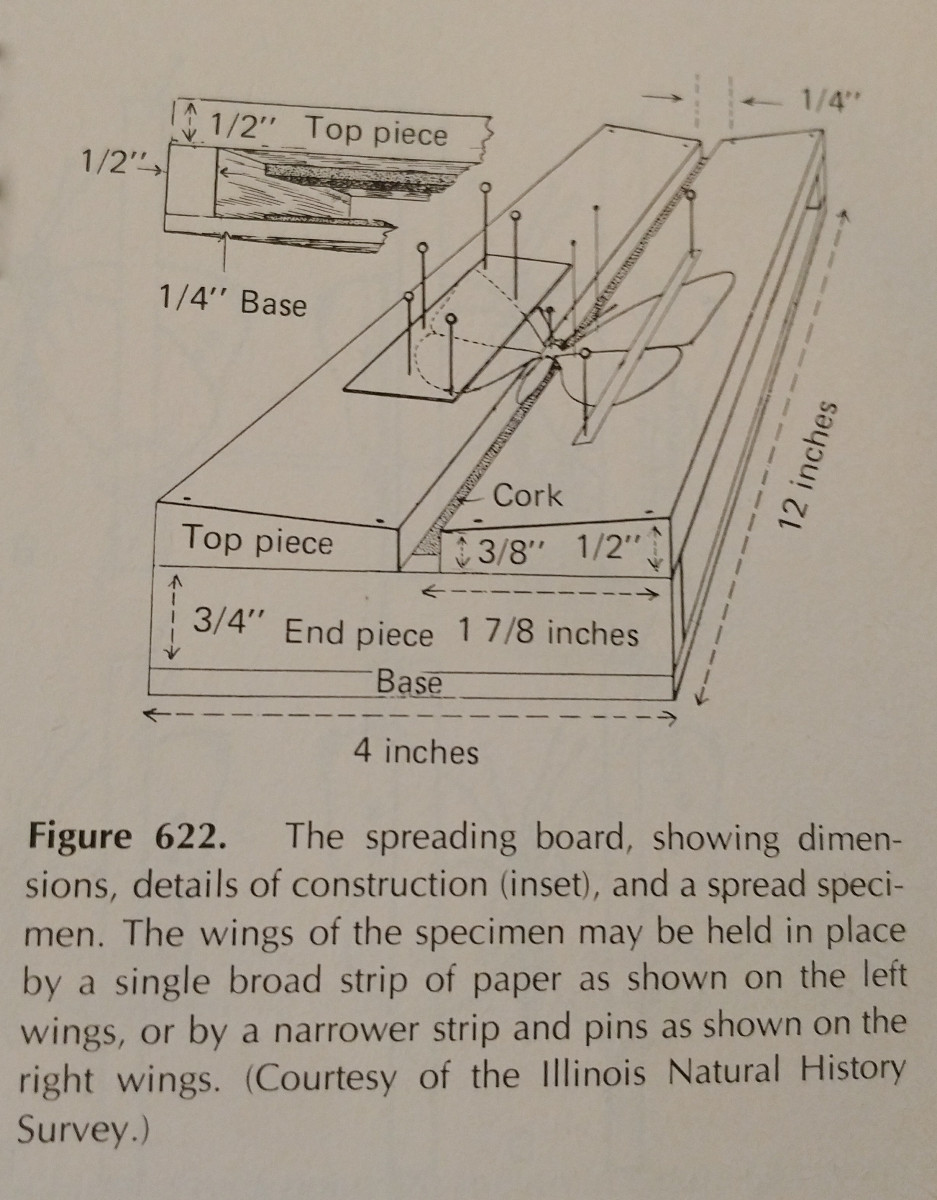
Typisk skal der lægges pres på den forreste marginale vingeåre, især hos Lepidoptera. Den bageste margin af en Lepidoptera’s vinger skal være i en ret vinkel med dens thorax, og bagvingerne skal være opad, så der ikke er noget mellemrum mellem dem og forvingerne, som vist på illustrationen. Det er  vigtigt at være meget forsigtig og bruge en pincet til at håndtere insekterne. De er meget skrøbelige, og ofte kan skæl og antenne let slås af. Papirstrimler og nåle kan bruges til at fastgøre vingerne, og så holder de sig på plads, når de tørrer.
vigtigt at være meget forsigtig og bruge en pincet til at håndtere insekterne. De er meget skrøbelige, og ofte kan skæl og antenne let slås af. Papirstrimler og nåle kan bruges til at fastgøre vingerne, og så holder de sig på plads, når de tørrer.
Små insekter kræver en vis opfindsomhed for at blive monteret, og de kan limes fast på kortspidser, små nåle eller mikroskopiske objektglas. Du skal blot fastgøre kortspidsen, komme en lillebitte mængde lim på den og derefter lime insektet på.
Tørring: Mange fastnålede insekter kan lufttørres på et varmt og tørt sted. Større møl kan kræve et tørrekammer med en eller flere lyspærer indeni, og nogle store eksemplarer skal måske endda have fjernet deres bagkropsorganer. Der er ingen endelig tid, det tager et eksemplar at tørre, men det kommer med erfaringen.
Insekter med blødt legeme kan frysetørres eller vakuumtørres og derefter pinnes for at skabe et ikke-fragilt, ikke-affarvet eksemplar. Typisk ville de skrumpe sammen, men dette trin gør dem tørre nok til at blive på en nål.
Typisk anvendes en ethylalkoholopløsning. Nogle af de almindelige er anført nedenfor.
| Hood’s solution | |
| 70-80% Ethylalkohol | 95 cm3 |
| Glycerin | 5 cm3 |
| Kahle’s opløsning | ||
| 95% Ethylalkohol | 30 cm3 | |
| Formaldehyd | 12 cm3 | |
| Glacialeddikesyre | 4 cm3 | |
| Vand | 60 cm3 |
| Alkoholisk Bouin’s opløsning | |
| 80% ethylalkohol | 150 cm3 |
| Formaldehyd | 60 cm3 |
| Glacededdikesyre | 15 cm3 |
| Pitronsyre | 1g |
Når vi nu er ved emnet opløsninger, Ethylacetat kan ofte være ineffektivt på larver, så her er dræbende midler, der er tilstrækkelige:
| KAAD-blanding | |
| 95% Ethylalkohol | 70-100 cm3 |
| Kerosin (reduceres til larver med blødt legeme som f.eks. maddiker) | 10 cm3 |
| Glaciale eddikesyre | 20 cm3 |
| Dioxan | 10 cm3 |
| XA-blanding | ||
| 95% ethylacetat | 50 cm3 | |
| Xylen | 50 cm3 |
Beide metoder bør tage 1/2 – 4 timer. Alle kendte aflivningsmidler fjerner farve, især grønt, tillader og rødt.
Typisk bør konserverede eksemplarer inspiceres en eller to gange om året, hvis der er fordampet væske. Hvis det er tilfældet, bør den udskiftes.
Montering på objektglas i mikroskop: Der findes to typer af indfatninger i mikroskoper: permanente og midlertidige. De anvender forskellige indstøbningsmedier, og ved midlertidige indstøbninger returneres prøverne normalt til konserveringsmiddel efter indstøbningen, hvor de kan opbevares på ubestemt tid. Permanente indfatninger monteres én gang og kan derefter ikke fjernes, men de kan dog holde sig et godt stykke tid, endda flere år.
Mange insekter med bløde kroppe kan sættes direkte i indfatningsmedium, men nogle skal først klares i en særlig væske. De vigtigste opløsninger, der anvendes til dette, er KOH og Nesbitts opløsning. Denne proces indebærer ofte, at insektet skal ligge i blød i flere timer til mange dage, når det gøres koldt, selv om det kan gøres hurtigere ved hjælp af varme og KOH.
Små eksemplarer kan monteres i et normalt objektglas, mens større eksemplarer kan kræve et depressionsobjekt eller støtte til dækglasset.
De medier, der anvendes til midlertidig indfatning af objektglas, omfatter vand, alkohol, glycerin og glyceringelé. Vand og alkohol kan kun holde et par minutter, før de fordamper, så glycerin bruges generelt, hvis eksemplarer skal studeres i længere tid.
Det afslutter dette indlæg og afsnittet om konservering i Borror, Delong og Triplehorn. Det meste af resten af arbejdet med dette SOS vil bestå i at samle mine dokumenter og dias, samt at sikre, at mine flowdiagrammer og min protokol er i orden.
