Når en gas i stabil strømning passerer gennem en forsnævring, f.eks. i en åbning eller ventil, oplever den normalt en temperaturændring. Dette skyldes til dels ændringer i den kinetiske energi, men der er en anden del, som skyldes gassens ikke-idealitet. Hvis kanalerne opstrøms og nedstrøms er tilstrækkeligt store til, at den kinetiske energi er ubetydelig på disse steder, måles temperaturerne opstrøms og nedstrøms tilstrækkelig langt væk fra den forstyrrelse, der skabes af forsnævringen, og systemet er adiabatisk; den målte effekt skyldes alene ikke-idealiteten. Ud fra termodynamikkens første lov er en sådan proces isenthalpisk, og man kan med fordel definere en Joule-Thomson-koefficient som:
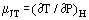
som et mål for den temperaturændring, der er resultatet af et trykfald på tværs af forsnævringen.
For de fleste virkelige gasser ved omkring omgivelsesforhold er μ positiv – dvs. temperaturen falder, når den passerer gennem forsnævringen. For brint og helium er den negativ, og temperaturen stiger. Ved højere temperaturer falder μ for de fleste gasser og kan endda blive negativ. μ kan også blive negativ ved påføring af tryk, selv ved omgivelsestemperatur, men tryk på over 200 bar er normalt nødvendige for at opnå dette.
