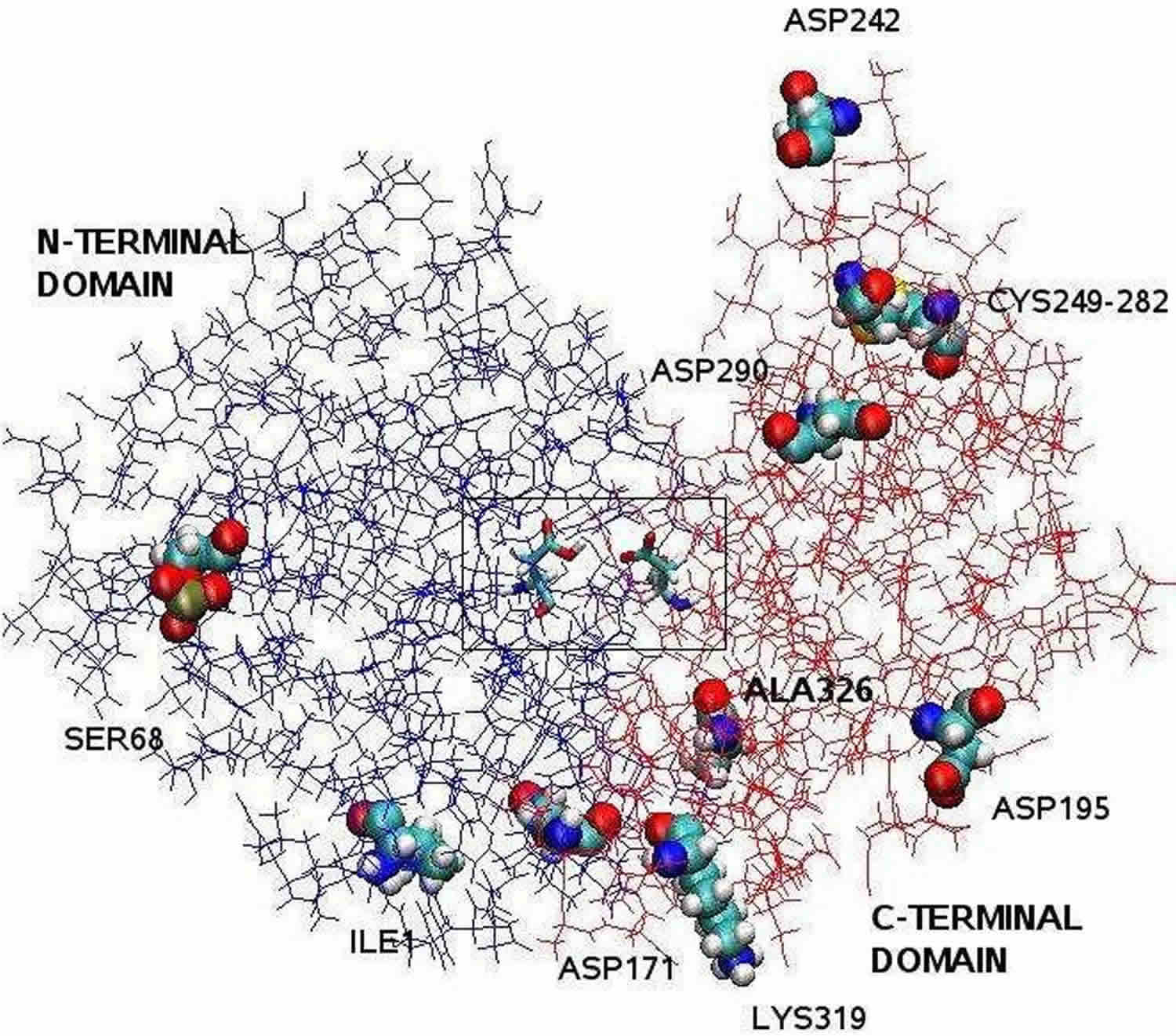
 Fodnote: Den pepsinstruktur, der er klarlagt ved hjælp af røntgenkrystallografi, er bilobal med en stor spalte med et aktivt sted mellem de to lapper. Residualerne 1 til 175 udgør det N-terminale domæne, mens residerne 176 til 326 udgør det C-terminale domæne. To aspartater i midten af kløften, Asp32 og Asp215, fungerer som katalysatorrester. Det katalytiske sted, der består af Asp32 og Asp215, er placeret i midten af kløften. De ladede aminosyrerester på proteinets overflade er Asp171, Asp195, Asp242, Asp290, Lys319, Ile1 (N-terminal), Ala326 (C-terminal). Den fosforylerede Ser68 er fuldt eksponeret for opløsningsmidlet, og disulfidbroen mellem Cys 249 og Cys 282 er placeret på proteinoverfladen.
Fodnote: Den pepsinstruktur, der er klarlagt ved hjælp af røntgenkrystallografi, er bilobal med en stor spalte med et aktivt sted mellem de to lapper. Residualerne 1 til 175 udgør det N-terminale domæne, mens residerne 176 til 326 udgør det C-terminale domæne. To aspartater i midten af kløften, Asp32 og Asp215, fungerer som katalysatorrester. Det katalytiske sted, der består af Asp32 og Asp215, er placeret i midten af kløften. De ladede aminosyrerester på proteinets overflade er Asp171, Asp195, Asp242, Asp290, Lys319, Ile1 (N-terminal), Ala326 (C-terminal). Den fosforylerede Ser68 er fuldt eksponeret for opløsningsmidlet, og disulfidbroen mellem Cys 249 og Cys 282 er placeret på proteinoverfladen.
Pepsin har som en aspartisk protease et meget lavt pH-optimum. Kondjoyan, Daudin og Santé-Lhoutellier 9) undersøgte fordøjeligheden af myofibrillære proteiner og fandt maksimal pepsinaktivitet ved pH omkring 2. Pletschke, Naudé og Oelofsen 10) undersøgte hydrolysen af hæmoglobin med svine- og strudsepepsin og fandt også en optimal pH-værdi på 2,0 for pepsinaktivitet. Når pepsinenzymet først er aktiveret ved pH <4,5, bliver det let denatureret ved pH over 7,0, hvilket udgør egenskaber, der bestemmer pepsinens karakteristika 11).
I modsætning til pH’s indflydelse er virkningen af ionisk styrke på enzymaktiviteten mindre ofte diskuteret. Tidligere arbejde udført af Dale og White 12) viste, at en forøgelse af ionstyrken klart nedsætter reaktionshastigheden for immobiliseret pancreatisk ribonuklease, mens Butré, Wierenga og Gruppen 13) undersøgte den enzymatiske hydrolyse af valleproteinisolat med alcalase og neutrase, og fandt også, at tilstedeværelsen af 0.5M NaCl mindskede hydrolysehastigheden.
To potente naturligt forekommende inhibitorer af pepsin er kendt: pepstatin, et pentapeptid fra Streptomyces, og en unik proteinøs inhibitor fra Ascaris. Pepsin gennemgår også feedback-hæmning; et produkt fra proteinfordøjelsen bremser reaktionen ved at hæmme pepsin 14).
Hvor produceres pepsin?
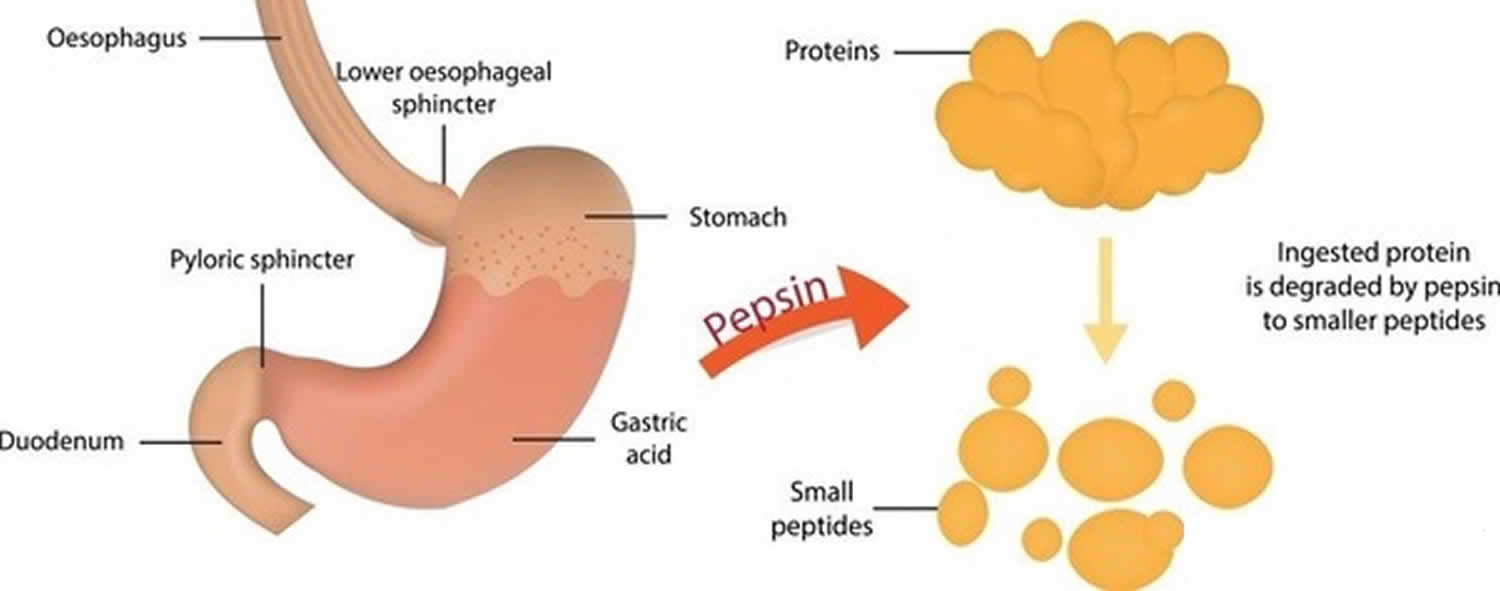
Høvdingecellerne udskiller pepsin i form af en inaktiv enzymprækursor kaldet pepsinogen. Når pepsinogen kommer i kontakt med saltsyre fra parietalcellerne, nedbrydes det hurtigt og danner pepsin 15). Pepsin begynder fordøjelsen af næsten alle typer kostprotein til polypeptider. Dette enzym er mest aktivt i et surt miljø, hvilket tilvejebringes af saltsyren i mavesaften.
Figur 2. Maveceller (mavekirtler)
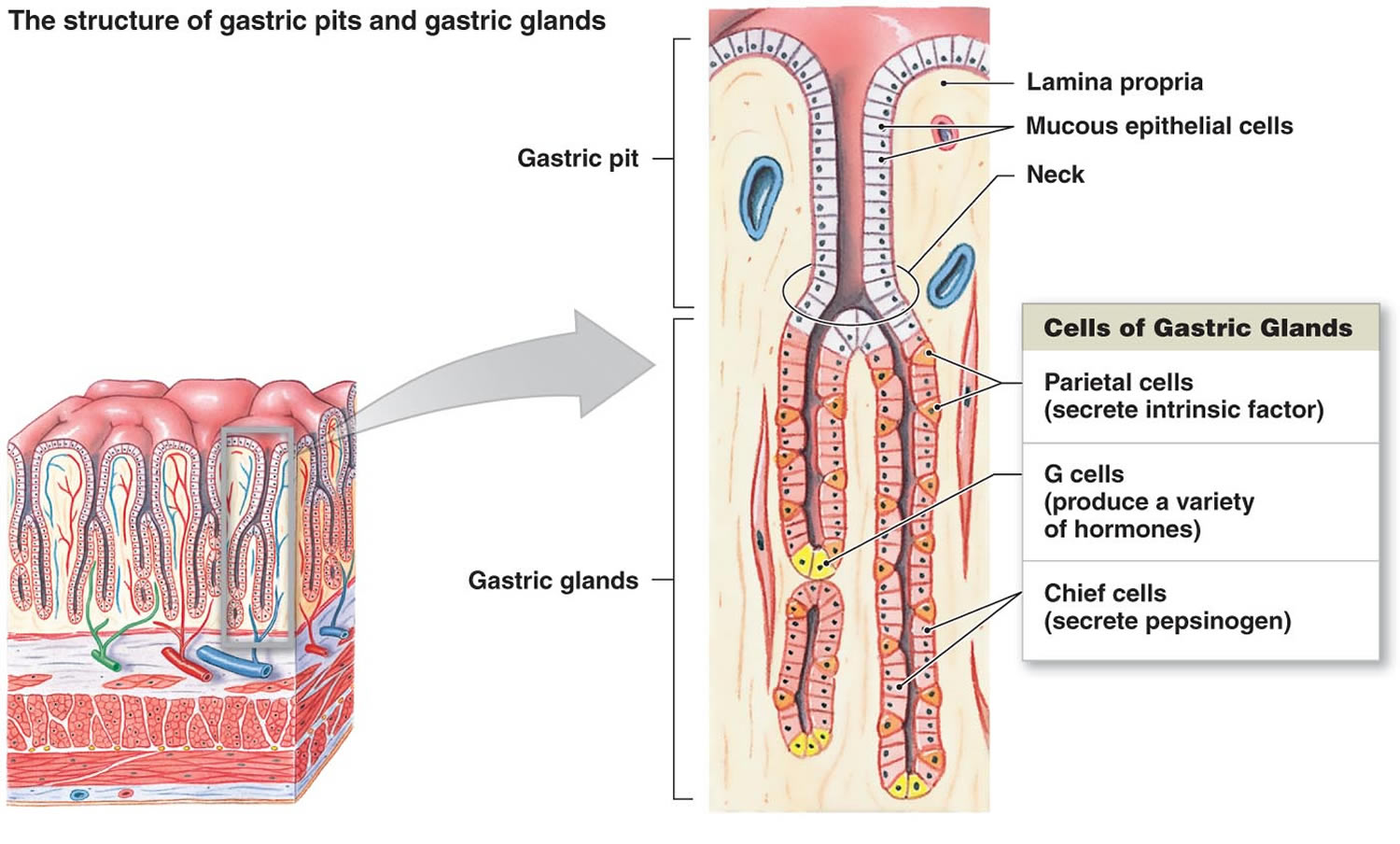 Fodnote: Mavesækkenes foring. Mavekirtler omfatter slimhindeceller, parietalceller og høvdingeceller. Maveslimhinden er besat med mavehuller, som er åbninger til mavekirtlerne.
Fodnote: Mavesækkenes foring. Mavekirtler omfatter slimhindeceller, parietalceller og høvdingeceller. Maveslimhinden er besat med mavehuller, som er åbninger til mavekirtlerne.
Hvad gør pepsin?
Pepsin dannet af pepsinogen (inaktiv form af pepsin) i nærværelse af saltsyre, fordøjer næsten alle typer af kostprotein til polypeptider (mindre proteinforbindelser). Pepsin fordøjer proteiner i stærk mavesyre. Pepsin er optimeret til fordøjelse af fødevarer i mavens sure miljø og er den første protease, som fødevareproteiner møder i fordøjelseskanalen. Pepsin er mest aktivt i sure miljøer mellem 37 °C og 42 °C 16).
Pepsins specificitet (dvs. pepsins spaltningssandsynlighed af peptidbindinger) påvirkes hovedsageligt af aminosyreresterne på position P1 og P1′, mens aminosyreresterne på andre subsites også kan spille en rolle. Generelt foretrækker pepsin at spalte efter phenylalanin, leucin og methionin, mens det sjældent spalter efter histidin, lysin, prolin og argininin 17). Aromatiske rester tyrosin, tryptofan og phenylalanin foretrækkes ved position P1′. Prolin er stærkt ugunstigt stillet ved position P2, P2′ og P3′, mens histidin, lysin og arginin er ugunstigt stillet ved position P3. P4- og P4′-positionerne har kun ringe indflydelse 18).
Figur 3. Pepsinfunktion