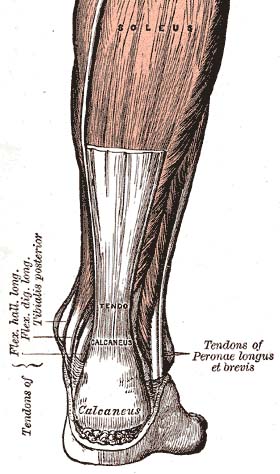

tendo
D013710
H3.03.00.0.00020
Anatomisk terminologi
En sene eller senebånd er et sejt bånd af fibrøst bindevæv, der forbinder muskler med knogler og er i stand til at modstå spændinger.
Sener ligner ligamenter; begge er lavet af kollagen. Ligamenter forbinder en knogle med en anden, mens sener forbinder muskler med knogler.
Struktur
Histologisk set består sener af tæt, regelmæssigt bindevæv. Den vigtigste cellulære komponent i senerne er specialiserede fibroblaster kaldet tenocytter. Tenocytterne syntetiserer den ekstracellulære matrix i senerne, der er rigelig af tæt pakkede kollagenfibre. Kollagenfibrene er parallelle med hinanden og organiseret i fascikler. De enkelte fascikler er bundet af endotendineum, som er et delikat løst bindevæv, der indeholder tynde kollagenfibriller og elastiske fibre. Grupper af fascikler er afgrænset af epitenon, som er en kappe af tæt, uregelmæssigt bindevæv. Hele senen er omsluttet af en fascia. Mellemrummet mellem fascien og senevævet er udfyldt med paratenon, et fedtholdigt areolært væv. Normale sunde sener er forankret til knoglen med Sharpey’s fibre.
Ekstracellulær matrix
Den tørre masse i normale sener, som udgør 30-45% af deres samlede masse, består af:
- 60-85% kollagen
- 60-80% kollagen I
- 0-10% kollagen III
- 2% kollagen IV
- små mængder af kollagen V, VI og andre
- 15-40% ikke-kollagene ekstracellulære matrixkomponenter, herunder:
- 3% brusk oligomerisk matrixprotein,
- 1-2% elastin,
- 1-5% proteoglykaner,
- 0.2% uorganiske komponenter såsom kobber, mangan og calcium.
Mens kollagen I udgør størstedelen af kollagenet i senen, er der mange mindre kollagener til stede, som spiller vigtige roller for en korrekt udvikling og funktion af senen. Disse omfatter type II kollagen i de bruskagtige zoner, type III kollagen i reticulinfibrene i karvæggene, type IX kollagen, type IV kollagen i kapillærernes basalmembraner, type V kollagen i karvæggene og type X kollagen i den mineraliserede fibrobrusk nær grænsefladen til knoglen.
Ultrastruktur og kollagensyntese
Kollagenfibre samler sig til makroaggregater. Efter sekretion fra cellen, der er spaltet af procollagen N- og C-proteaser, samler tropokollagenmolekylerne sig spontant til uopløselige fibriller. Et kollagenmolekyle er ca. 300 nm langt og 1-2 nm bredt, og de dannede fibriller kan have en diameter på mellem 50 og 500 nm. I sener samles fibrillerne derefter yderligere til fascikler, som er ca. 10 mm lange og har en diameter på 50-300 μm, og til sidst til en senefiber med en diameter på 100-500 μm.
Kollagenet i senerne holdes sammen med proteoglykan (en forbindelse bestående af et protein bundet til glykosaminoglykan-grupper, der især findes i bindevæv) komponenter, herunder decorin og, i komprimerede områder af senen, aggrecan, som er i stand til at binde sig til kollagenfibrillerne på specifikke steder. Proteoglykanerne er sammenvævet med kollagenfibrillerne – deres glykosaminoglykan-sidekæder (GAG) har flere interaktioner med fibrillernes overflade – hvilket viser, at proteoglykanerne er vigtige strukturelt set i forbindelse med sammenbindingen af fibrillerne. De vigtigste GAG-komponenter i senen er dermatansulfat og chondroitinsulfat, som associerer sig med kollagen og er involveret i fibrillernes samlingsproces under senens udvikling. Dermatansulfat menes at være ansvarlig for at danne forbindelser mellem fibriller, mens chondroitinsulfat menes at være mere involveret i at optage volumen mellem fibrillerne for at holde dem adskilt og hjælpe med at modstå deformation. Dekorins dermatansulfat-sidekæder aggregerer i opløsning, og denne adfærd kan bidrage til samlingen af kollagenfibriller. Når decorinmolekyler er bundet til en kollagenfibrille, kan deres dermatansulfatkæder strække sig ud og associere sig med andre dermatansulfatkæder på decorin, der er bundet til separate fibriller, og derved skabe interfibrillære broer og i sidste ende forårsage parallel tilpasning af fibrillerne.
Tenocytter
Tenocytterne producerer kollagenmolekylerne, som aggregerer ende-til-ende og side-til-side for at producere kollagenfibriller. Fibrilbundterne er organiseret til at danne fibre med de langstrakte tenocytter tæt pakket mellem dem. Der er et tredimensionelt netværk af celleprocesser forbundet med kollagen i senen. Cellerne kommunikerer med hinanden gennem gap junctions, og denne signalering giver dem evnen til at registrere og reagere på mekanisk belastning.
Blodkar kan visualiseres i endotendonet, der løber parallelt med kollagenfibrene, med lejlighedsvis forgrenede tværgående anastomoser.
Den indre senemasse menes ikke at indeholde nogen nervefibre, men epitenon og paratenon indeholder nerveender, mens Golgi-seneorganer er til stede ved overgangen mellem sene og muskel.
Senens længde varierer i alle hovedgrupper og fra person til person. Senelængden er i praksis den afgørende faktor med hensyn til den faktiske og potentielle muskelstørrelse. F.eks. vil en mand med en kortere sene og en længere bicepsmuskel have et større potentiale for muskelmasse end en mand med en længere sene og en kortere muskel, når alle andre relevante biologiske faktorer er lige store. Succesfulde bodybuildere vil generelt have kortere sener. Omvendt er det i sportsgrene, der kræver, at atleter skal udmærke sig i handlinger som løb eller spring, en fordel at have en længere akillessene end gennemsnittet og en kortere lægmuskel.
Senenes længde er bestemt af genetisk disposition og har ikke vist sig hverken at stige eller falde som reaktion på miljøet, i modsætning til muskler, som kan forkortes ved traumer, ubalancer i brugen og manglende restitution og udstrækning. RAT
Funktioner

Traditionelt er sener blevet betragtet som en mekanisme, hvormed muskler forbinder sig med knogler samt muskler i sig selv, der fungerer til at overføre kræfter. Denne forbindelse gør det muligt for senerne at modulere kræfter passivt under bevægelsen, hvilket giver ekstra stabilitet uden aktivt arbejde. I løbet af de sidste to årtier har meget forskning imidlertid fokuseret på de elastiske egenskaber hos visse sener og deres evne til at fungere som fjedre. Det er ikke alle sener, der skal udfylde den samme funktionelle rolle, idet nogle sener hovedsageligt er beregnet til at positionere lemmerne, f.eks. fingrene, når man skriver (positionssener), mens andre sener fungerer som fjedre for at gøre bevægelsen mere effektiv (energilagringssener). Energilagrende sener kan lagre og genvinde energi med høj effektivitet. F.eks. strækker akillessenen sig under et menneskes skridt, når ankelleddet dorsiflexeres. I den sidste del af skridtet, når foden plantar-flexer (peger tæerne nedad), frigives den lagrede elastiske energi. Da senen strækker sig, kan musklen desuden fungere med mindre eller endog ingen længdeændring, hvilket gør det muligt for musklen at generere mere kraft.
Senens mekaniske egenskaber afhænger af kollagenfiberdiameteren og -orienteringen. Kollagenfibrillerne er parallelle med hinanden og tæt pakket, men viser et bølgelignende udseende på grund af plane bølger, eller krusninger, på en skala på flere mikrometer. I sener har kollagenfibrene en vis fleksibilitet på grund af fraværet af hydroxyprolin- og prolinrester på bestemte steder i aminosyresekvensen, hvilket giver mulighed for dannelse af andre konformationer som f.eks. bøjninger eller interne loops i triple helixen og resulterer i udviklingen af krusninger. Krumningerne i kollagenfibrillerne gør det muligt for senerne at have en vis fleksibilitet samt en lav kompressionsstivhed. Da senen desuden er en flerstrenget struktur, der består af mange delvist uafhængige fibriller og fascikler, opfører den sig ikke som en enkelt stang, og denne egenskab bidrager også til dens fleksibilitet.
Senernes proteoglykankomponenter er også vigtige for de mekaniske egenskaber. Mens kollagenfibrillerne gør det muligt for senerne at modstå trækspænding, gør proteoglykanerne det muligt for dem at modstå kompressionsspænding. Disse molekyler er meget hydrofile, hvilket betyder, at de kan absorbere en stor mængde vand og derfor har et højt svulmningsforhold. Da de er ikke-kovalent bundet til fibrillerne, kan de reversibelt associeres og disassocieres, således at broerne mellem fibrillerne kan brydes og genetableres. Denne proces kan være medvirkende til, at fibrillen kan strække sig og formindskes i diameter under spænding. Proteoglykanerne kan imidlertid også spille en rolle for senens trækegenskaber. Senenes struktur er i realiteten et fiberkompositmateriale, der er opbygget som en række hierarkiske niveauer. På hvert niveau i hierarkiet er kollagenenhederne bundet sammen af enten kollagenkrydsforbindelser eller proteoglykaner for at skabe en struktur, der er meget modstandsdygtig over for trækbelastning. Det er blevet påvist, at collagenfibrillernes forlængelse og belastning alene er meget lavere end den samlede forlængelse og belastning af hele senen under samme belastning, hvilket viser, at den proteoglykanrige matrix også skal undergå deformation, og at der sker en stivning af matrixen ved høje belastningshastigheder. Denne deformation af den ikke-kollagenholdige matrix sker på alle niveauer i senehierarkiet, og ved at modulere denne matrix’ organisation og struktur kan man opnå de forskellige mekaniske egenskaber, der kræves af forskellige sener, og der kan opnås de forskellige mekaniske egenskaber, som forskellige sener kræver. Energilagrende sener har vist sig at udnytte betydelige mængder af glidning mellem fascikler for at opnå de høje belastningsegenskaber, som de kræver, mens positionssener i højere grad er afhængige af glidning mellem kollagenfibre og fibriller. Nylige data tyder imidlertid på, at energilagrende sener også kan indeholde fascikler, der er snoede eller spiralformede af natur – et arrangement, der ville være yderst fordelagtigt for at opnå den fjederlignende adfærd, der kræves i disse sener.
Mekanik
Sener er viskoelastiske strukturer, hvilket betyder, at de udviser både elastisk og viskøs adfærd. Når senerne strækkes, udviser de typisk “blødt væv”-adfærd. Kraft-udstræknings- eller spændings-/forstrækningskurven starter med et område med meget lav stivhed, da krympestrukturen retter sig op, og kollagenfibrene retter sig ud, hvilket tyder på et negativt Poisson-forhold i senens fibre. For nylig har forsøg in vivo (ved hjælp af MRI) og ex vivo (ved mekanisk testning af forskellige dødninge-senevæv) vist, at sunde sener er meget anisotrope og udviser et negativt Poisson-forhold (auxetisk) i nogle planer, når de strækkes op til 2 % i længden, dvs. inden for deres normale bevægelsesområde. Efter dette “tå”-område bliver strukturen betydeligt stivere og har en lineær spændings-/forstrækningskurve, indtil den begynder at svigte. Senernes mekaniske egenskaber varierer meget, da de er tilpasset til senerens funktionelle krav. De energilagrende sener har en tendens til at være mere elastiske eller mindre stive, så de lettere kan lagre energi, mens de stivere positionssener har en tendens til at være lidt mere viskoelastiske og mindre elastiske, så de kan give en finere kontrol af bevægelsen. En typisk energilagrende sene vil svigte ved ca. 12-15 % deformation og en spænding i størrelsesordenen 100-150 MPa, selv om nogle sener er betydeligt mere strækbare end dette, f.eks. den overfladiske digitale bøjesene hos heste, som strækker sig med over 20 %, når de galoperer. Positionssener kan svigte ved belastninger så lave som 6-8%, men kan have moduler i størrelsesordenen 700-1000 MPa.
Flere undersøgelser har vist, at sener reagerer på ændringer i mekanisk belastning med vækst- og remodelleringsprocesser, ligesom knogler. Især viste en undersøgelse, at manglende brug af akillessenen hos rotter resulterede i et fald i den gennemsnitlige tykkelse af de kollagenfiberbundter, der udgør senen. Hos mennesker viste et eksperiment, hvor personer blev udsat for et simuleret mikrogravitationsmiljø, at senerne blev væsentligt mindre stive, selv når forsøgspersonerne blev bedt om at udføre genopretningsøvelser. Disse virkninger har betydning på områder lige fra behandling af sengeliggende patienter til udformning af mere effektive øvelser til astronauter.
Healing
Senerne i foden er meget komplekse og indviklede. Derfor er helingsprocessen for en brækket sene langvarig og smertefuld. De fleste mennesker, der ikke får lægehjælp inden for de første 48 timer efter skaden, vil lide af kraftig hævelse, smerte og en brændende fornemmelse der, hvor skaden er opstået.
Det blev antaget, at sener ikke kunne gennemgå matrixomsætning, og at tenocytter ikke var i stand til at reparere. Det er imidlertid siden blevet vist, at tenocytter i senen i løbet af en persons levetid aktivt syntetiserer matrixkomponenter, samt at enzymer som matrixmetalloproteinaser (MMP’er) kan nedbryde matrixen. Sener er i stand til at helbrede og komme sig efter skader i en proces, der styres af tenocytterne og deres omgivende ekstracellulære matrix.
De tre hovedstadier af seneheling er inflammation, reparation eller proliferation og remodellering, som yderligere kan opdeles i konsolidering og modning. Disse stadier kan overlappe med hinanden. I den første fase rekrutteres inflammatoriske celler som neutrofile til skadestedet sammen med erytrocytter. Monocytter og makrofager rekrutteres inden for de første 24 timer, og der sker en fagocytose af nekrotisk materiale på skadestedet. Efter frigivelse af vasoaktive og kemotaktiske faktorer indledes angiogenese og proliferation af tenocytter. Tenocytterne bevæger sig derefter ind på skadestedet og begynder at syntetisere kollagen III. Efter et par dage begynder reparations- eller proliferationsfasen. I denne fase er tenocytterne involveret i syntesen af store mængder kollagen og proteoglykaner på skadestedet, og niveauerne af GAG og vand er høje. Efter ca. seks uger begynder remodelleringsfasen. Den første del af denne fase er konsolideringen, som varer fra ca. seks til ti uger efter skaden. I denne periode mindskes syntesen af kollagen og GAG’er, og cellulariteten mindskes også, da vævet bliver mere fibrøst som følge af den øgede produktion af kollagen I, og fibrillerne bliver rettet ud i retning af den mekaniske belastning. Den sidste modningsfase indtræder efter ti uger, og i løbet af denne periode sker der en stigning i krydsforbindelsen af kollagenfibrillerne, hvilket gør vævet stivere. Gradvist, over ca. et år, bliver vævet fra fibrøst til arlignende.
Matrixmetalloproteinaser (MMP’er) spiller en meget vigtig rolle i nedbrydningen og remodelleringen af ECM’en under helingsprocessen efter en seneskade. Visse MMP’er, herunder MMP-1, MMP-2, MMP-8, MMP-13 og MMP-14, har kollagenaseaktivitet, hvilket betyder, at de i modsætning til mange andre enzymer er i stand til at nedbryde kollagen I-fibriller. MMP-1’s nedbrydning af kollagenfibriller sammen med tilstedeværelsen af denatureret kollagen er faktorer, som menes at forårsage en svækkelse af sene-ECM’en og en forøgelse af potentialet for, at der opstår en ny bristning. Som reaktion på gentagen mekanisk belastning eller skade kan cytokiner frigives af tenocytter og kan inducere frigivelse af MMP’er, hvilket forårsager nedbrydning af ECM og fører til tilbagevendende skade og kroniske tendinopatier.
En række andre molekyler er involveret i reparation og regenerering af sener. Der er fem vækstfaktorer, som har vist sig at være signifikant opregulerede og aktive under seneheling: insulinlignende vækstfaktor 1 (IGF-I), platelet-derived growth factor (PDGF), vaskulær endothelial vækstfaktor (VEGF), basisk fibroblastvækstfaktor (bFGF) og transformerende vækstfaktor beta (TGF-β). Disse vækstfaktorer har alle forskellige roller i forbindelse med helingsprocessen. IGF-1 øger kollagen- og proteoglykanproduktionen i den første fase af inflammationen, og PDGF er også til stede i de tidlige faser efter skaden og fremmer syntesen af andre vækstfaktorer sammen med syntesen af DNA og proliferationen af seneceller. De tre isoformer af TGF-β (TGF-β1, TGF-β2 og TGF-β3) er kendt for at spille en rolle i sårheling og ardannelse. VEGF er velkendt for at fremme angiogenese og inducere endothelcelleproliferation og migration, og VEGF mRNA er blevet vist at blive udtrykt på stedet for seneskader sammen med kollagen I mRNA. Knoglemorfogenetiske proteiner (BMP) er en undergruppe af TGF-β superfamilien, der kan inducere knogle- og bruskdannelse samt vævsdifferentiering, og BMP-12 specifikt har vist sig at påvirke dannelse og differentiering af senevæv og at fremme fibrogenese.
Effekter af aktivitet på heling
I dyremodeller er der gennemført omfattende undersøgelser for at undersøge virkningerne af mekanisk belastning i form af aktivitetsniveau på seneskader og heling. Mens udstrækning kan forstyrre helingen i den indledende inflammatoriske fase, har det vist sig, at kontrolleret bevægelse af senerne efter ca. en uge efter en akut skade kan bidrage til at fremme tenocytternes syntese af kollagen, hvilket fører til øget trækstyrke og diameter af de helede sener og færre adhæsioner end sener, der er immobiliserede. Ved kroniske seneskader har mekanisk belastning også vist sig at stimulere fibroblastproliferation og kollagensyntese sammen med kollagenomlægning, hvilket alt sammen fremmer reparation og remodellering. For yderligere at understøtte teorien om, at bevægelse og aktivitet bidrager til heling af senerne, er det blevet vist, at immobilisering af senerne efter en skade ofte har en negativ effekt på helingen. Hos kaniner har kollagenfascikler, der er immobiliseret, vist nedsat trækstyrke, og immobilisering resulterer også i lavere mængder af vand, proteoglykaner og kollagen-crosslinks i senerne.
Der er blevet foreslået flere mekanotransduktionsmekanismer som årsager til tenocytternes respons på mekanisk kraft, der sætter dem i stand til at ændre deres genekspression, proteinsyntese og cellefænotype og i sidste ende forårsage ændringer i senestrukturen. En vigtig faktor er mekanisk deformation af den ekstracellulære matrix, som kan påvirke actincytoskelettet og dermed påvirke cellens form, motilitet og funktion. Mekaniske kræfter kan overføres af fokale adhæsionssteder, integriner og celle-celleforbindelser. Ændringer i aktincytoskelettet kan aktivere integriner, som formidler “udefra og ind” og “indefra og ud”-signalering mellem cellen og matrixen. G-proteiner, som inducerer intracellulære signalkaskader, kan også være vigtige, og ionkanaler aktiveres ved strækning for at lade ioner som calcium, natrium eller kalium trænge ind i cellen.
Samfund og kultur
Sinew blev i hele den førindustrielle tidsalder brugt i vid udstrækning som en hård og holdbar fiber. Nogle specifikke anvendelser omfatter anvendelse af sener som tråd til syning, fastgørelse af fjer til pile (se fletch), surring af værktøjsklinger til skafter osv. Det anbefales også i overlevelsesvejledninger som et materiale, der kan bruges til at lave stærkt reb til f.eks. fælder eller levende strukturer. Tendon skal behandles på særlige måder for at kunne fungere hensigtsmæssigt til disse formål. Inuit og andre cirkumpolare folkeslag anvendte senen som det eneste reb til alle husholdningsformål på grund af manglen på andre egnede fiberkilder i deres økologiske levesteder. De elastiske egenskaber ved bestemte sener blev også brugt i sammensatte rekurvebuer, der blev foretrukket af steppenomaderne i Eurasien og af de amerikanske indianere. Det første stenkastende artilleri benyttede sig også af senerens elastiske egenskaber.
Senerne er et fremragende rebmateriale af tre grunde: Det er ekstremt stærkt, det indeholder naturlige limstoffer, og det krymper, når det tørrer, hvilket gør det unødvendigt at lave knuder.
Kulinariske anvendelser
Sene (især oksekødssene) bruges som mad i nogle asiatiske køkkener (ofte serveret på yum cha- eller dim sum-restauranter). En populær ret er suan bao niu jin, hvor senerne marineres i hvidløg. Den findes også nogle gange i den vietnamesiske nudelret phở.
Klinisk betydning
Skader
Senerne er udsat for mange typer af skader. Der findes forskellige former for tendinopatier eller seneskader som følge af overbelastning. Disse typer skader resulterer generelt i betændelse og degeneration eller svækkelse af senerne, hvilket i sidste ende kan føre til seneruptur. Tendinopatier kan skyldes en række faktorer, der vedrører senens ekstracellulære matrix (ECM), og deres klassificering har været vanskelig, fordi deres symptomer og histopatologi ofte ligner hinanden.
Den første kategori af tendinopatier er paratenonitis, som henviser til betændelse i paratenonet eller paratendinbladet, der ligger mellem senen og dens kappe. Tendinose henviser til en ikke-inflammatorisk skade på senen på celleniveau. Nedbrydningen skyldes skader på kollagenet, cellerne og de vaskulære komponenter i senen og er kendt for at føre til brud. Observationer af sener, der har været udsat for spontan bristning, har vist tilstedeværelsen af kollagenfibriller, der ikke er i den korrekte parallelle orientering eller ikke er ensartede i længde eller diameter, sammen med afrundede tenocytter, andre celleanormaliteter og indvækst af blodkar. Andre former for tendinose, som ikke har ført til brud, har også vist degeneration, desorientering og udtynding af kollagenfibriller samt en stigning i mængden af glykosaminoglykaner mellem fibrillerne. Den tredje er paratenonitis med tendinose, hvor der både er tale om en kombination af paratenonbetændelse og senedegeneration. Den sidste er tendinitis, som henviser til degeneration med inflammation i senen samt vaskulær disruption.
Tendinopatier kan være forårsaget af flere iboende faktorer, herunder alder, kropsvægt og ernæring. De extrinsiske faktorer er ofte relateret til sport og omfatter overdrevne kræfter eller belastninger, dårlige træningsteknikker og miljøforhold.
Andre dyr

I nogle organismer, bemærkelsesværdige er fugle og ornithischiske dinosaurer, kan dele af senen blive forbenede. I denne proces infiltrerer osteocytter senen og lægger knogle ned, som de ville gøre det i sesamknogler som f.eks. i patella. Hos fugle sker forbening af sener primært i baglåret, mens forbenede aksiale muskelsener hos ornithischiske dinosaurer danner et gitterværk langs neural- og hæmalstængerne på halen, formentlig som støtte.
Se også
| Wikimedia Commons har flere filer relateret til Sener. |
- Aponeurose
- Knoglevæv
- Chordae tendineae
- Liste over muskler i det menneskelige legeme
- Senehinde
- ^ Dorlands Medical Dictionary, side 602
- ^ Caldini, E. G.; Caldini, N.; De-Pasquale, V.; Strocchi, R.; Guizzardi, S.; Ruggeri, A.; Montes, G. S. (1990). “Distribution of elastic system fibres in the rat tail tendon and its associated sheaths”. Cells Tissues Organs. 139 (4): 341-348. doi:10.1159/000147022. PMID 1706129.
- ^ Grant, T. M.; Thompson, M. S.; Urban, J.; Yu, J. (2013). “Elastiske fibre er bredt fordelt i senen og stærkt lokaliseret omkring tenocytter”. Journal of Anatomy. 222 (6): 573-579. doi:10.1111/joa.12048. PMC 3666236. PMID 23587025.
- ^ Dorlands Medical Dictionary 2012. side 1382
- ^ a b c Jozsa, L., og Kannus, P., Human Tendons: Anatomi, fysiologi og patologi. Human Kinetics: Champaign, IL, 1997.
- ^ Lin, T. W.; Cardenas, L.; Cardenas, L.; Soslowsky, L. J. (2004). “Biomekanik af seneskader og reparation af sener”. Journal of Biomechanics. 37 (6): 865-877. doi:10.1016/j.jbiomech.2003.11.005. PMID 15111074.
- ^ Kjær, Michael (april 2004). “Den ekstracellulære matrix’ rolle i tilpasning af sener og skeletmuskulatur til mekanisk belastning”. Physiological Reviews. 84 (2): 649-698. doi:10.1152/physrev.00031.2003. ISSN 0031-9333. PMID 15044685.
- ^ Taye, Nandaraj; Karoulias, Stylianos Z.; Hubmacher, Dirk (januar 2020). “De “andre” 15-40 %: The Role of Non-Collagenous Extracellular Matrix Proteins and Minor Collagens in Tendon”. Journal of Orthopaedic Research. 38 (1): 23-35. doi:10.1002/jor.24440. ISSN 0736-0266. PMC 6917864. PMID 31410892.
- ^ Fukuta, S.; Oyama, M.; Oyama, M.; Kavalkovich, K.; Fu, F. H.; Niyibizi, C. (1998). “Identifikation af collagener af type II, IX og X på det sted, hvor achillessenen fra kvæg er indsat”. Matrix Biology. 17 (1): 65-73. doi:10.1016/S0945-053X(98)90125-1. PMID 9628253.
- ^ Fratzl, P. (2009). “Cellulose og kollagen: fra fibre til væv”. Current Opinion in Colloid & Interface Science. 8 (1): 32-39. doi:10.1016/S1359-0294(03)00011-6.
- ^ Zhang, G. E., Y.; Chervoneva, I.; Robinson, P. S.; Beason, D. P.; Carine, E. T.; Soslowsky, L. J.; Iozzo, R. V.; Birk, D. E. (2006). “Decorin regulerer samling af kollagenfibriller og erhvervelse af biomekaniske egenskaber under senens udvikling”. Journal of Cellular Biochemistry. 98 (6): 1436-1449. doi:10.1002/jcb.20776. PMID 16518859. S2CID 39384363. CS1 maint: multiple names: authors list (link)
- ^ Raspanti, M.; Congiu, T.; Guizzardi, S. (2002). “Structural Aspects of the Extracellular Matrix of the Tendon : An Atomic Force and Scanning Electron Microscopy Study”. Archives of Histology and Cytology. 65 (1): 37-43. doi:10.1679/aohc.65.37. PMID 12002609.
- ^ Scott, J. E. O., C. R.; Hughes, E. W. (1981). “Proteoglycan-collagen-arrangementer i rottehalesenen under udvikling. An electron microscopical and biochemical investigation”. Biochemical Journal. 195 (3): 573-581. doi:10.1042/bj1950573. PMC 1162928. PMID 6459082. CS1 maint: multiple names: authors list (link)
- ^ Scott, J. E. (2003). “Elasticitet i ekstracellulær matrix ‘formmoduler’ af sener, brusk osv. A glidende proteoglycan-filamentmodel”. Journal of Physiology. 553 (2): 335-343. doi:10.1113/jphysiol.2003.050179. PMC 2343561. PMID 12923209.
- ^ McNeilly, C. M.; Banes, A. J.; Banes, A. J.; Benjamin, M.; Ralphs, J. R. (1996). “Tendon cells in vivo form a three dimensional network of cell processes linked by gap junctions”. Journal of Anatomy. 189 (Pt 3): 593-600. PMC 1167702. PMID 8982835.
- ^ “Having a short Achilles tendon may be an athlete’s Achilles heel”. Hentet 2007-10-26.
- ^ Young, Michael. “A Review on Postural Realignment and its Muscular and Neural Components” (PDF).
- ^ Thorpe C.T., Birch H.L., Clegg P.D., Screen H.R.C. (2013). Den rolle, som den ikke-kollagene matrix spiller for senens funktion. Int J ExpPathol. 94;4: 248-59.
- ^ Hulmes, D. J. S. S. (2002). “Building Collagen Molecules, Fibrils, and Suprafibrillar Structures”. Journal of Structural Biology. 137 (1-2): 2-10. doi:10.1006/jsbi.2002.4450. PMID 12064927.
- ^ Silver, F. H.; Freeman, J. W.; Seehra, G. P. (2003). “Collagen self-assembly and the development of tendon mechanical properties”. Journal of Biomechanics. 36 (10): 1529-1553. doi:10.1016/S0021-9290(03)00135-0. PMID 14499302.
- ^ Ker, R. F. (2002). “Implikationerne af senernes tilpasningsdygtige træthedskvalitet for deres konstruktion, reparation og funktion”. Comparative Biochemistry and Physiology A. 133 (4): 987-1000. doi:10.1016/S1095-6433(02)00171-X. PMID 12485688.
- ^ Cribb, A. M.; Scott, J.E. (1995). In Tendon response to tensile-stress – an ultrastructural investigation of collagen – proteoglycan interactions in stressed tendon,1995; Cambridge Univ Press.pp 423-428.
- ^ Screen H.R., Lee D.A., Lee D.A., Bader D.L., Shelton J.C. (2004). “An investigation into the effects of the hierarchical structure of tendon fascicles on micromechanical properties”. Proc Inst Mech Eng H. 218 (2): 109-119. doi:10.1243/095441104322984004. PMID 15116898. S2CID 46256718. CS1 maint: multiple names: authors list (link)
- ^ Puxkandl, R.; Zizak, I.; Paris, O.; Keckes, J.; Tesch, W.; Bernstorff, S.; Purslow, P.; Fratzl, P. (2002). “Viscoelastiske egenskaber af kollagen: synkrotronstråleundersøgelser og strukturmodel”. Philosophical Transactions of the Royal Society B. 357 (1418): 191-197. doi:10.1098/rstb.2001.1033. PMC 1692933. PMID 11911776.
- ^ Gupta H.S., Seto J., Krauss S., Krauss S., Boesecke P.& Screen H.R.C. (2010). In situ-analyse på flere niveauer af viskoelastiske deformationsmekanismer i senekollagen. J. Struct. Biol. 169(2):183-191.
- ^ Thorpe C.T; Udeze C.P; Birch H.L.; Clegg P.D.; Screen H.R.C. (2012). “Specialisering af senens mekaniske egenskaber skyldes inter-fascikulære forskelle”. Journal of the Royal Society Interface. 9 (76): 3108-3117. doi:10.1098/rsif.2012.0362. PMC 3479922. PMID 22764132.
- ^ Thorpe C.T.; Klemt C; Riley G.P.; Birch H.L.; Clegg P.D.; Screen H.R.C. (2013). “Spiralformede understrukturer i energilagrende sener giver en mulig mekanisme til effektiv energilagring og returnering”. Acta Biomater. 9 (8): 7948-56. doi:10.1016/j.actbio.2013.05.004. PMID 23669621.
- ^ Gatt R, Vella Wood M, Gatt A, Zarb F, Formosa C, Azzopardi KM, Casha A, Agius TP, Schembri-Wismayer P, Attard L, Chockalingam N, Grima JN (2015). “Negative Poisson’s ratioer i sener: En uventet mekanisk reaktion”. Acta Biomater. 24: 201-208. doi:10.1016/j.actbio.2015.06.018. PMID 26102335.
- ^ Batson EL, Paramour RJ, Smith TJ, Birch HL, Patterson-Kane JC, Goodship AE. (2003). Equine Vet J. |volume=35 |issue=3 |pages=314-8. Er materialeegenskaberne og matrixsammensætningen af hestens bøjesener og strækkesener bestemt af deres funktioner?
- ^ ScreenH.R.C., Tanner, K.E. (2012). Structure & Biomechanics of Biological Composites. In: Encyclopaedia of Composites 2nd Ed. Nicolais & Borzacchiello.Pub. John Wiley & Sons, Inc. ISBN 978-0-470-1282828-2 (sider 2928-39)
- ^ Nakagawa, Y. (1989). “Effekten af afbrug på akillessenenes ultrastruktur hos rotter”. European Journal of Applied Physiology. 59 (3): 239-242. doi:10.1007/bf02386194. PMID 2583169. S2CID 20626078.
- ^ Reeves, N. D. (2005). “Indflydelse af 90-dages simuleret mikrogravitation på de mekaniske egenskaber af menneskelige sener og virkningen af modforanstaltninger til genoptræning”. Journal of Applied Physiology. 98 (6): 2278-2286. doi:10.1152/japplphysiol.01266.2004. hdl:11379/25397. PMID 15705722.
- ^ a b Riley, G. (2004). “Patogenese af tendinopati. Et molekylært perspektiv” (PDF). Reumatologi. 43 (2): 131-142. doi:10.1093/rheumatology/keg448. PMID 1286757575.
- ^ a b c d Sharma, P. M., N. (2006). “Biologi ved seneskader: heling, modellering og remodellering”. Journal of Musculoskeletal and Neuronal Interactions. 6 (2): 181-190. PMID 16849830. CS1 maint: multiple names: authors list (link)
- ^ a b c d Sharma, P.; Maffulli, N. (2005). “Seneskader og tendinopati: Helbredelse og reparation”. Journal of Bone and Joint Surgery. American Volume. 87A (1): 187-202. doi:10.2106/JBJS.D.01850. PMID 15634833. S2CID 1111422.
- ^ a b c d e f Wang, J. H. C. C. (2006). “Mechanobiology of tendon”. Journal of Biomechanics. 39 (9): 1563-1582. doi:10.1016/j.jbiomech.2005.05.011. PMID 16000201.
- ^ Riley, G. P.; Curry, V.; DeGroot, J.; van El, B.; Verzijl, N.; Hazleman, B. L.; Bank, R. A. (2002). “Matrix metalloproteinase-aktiviteter og deres sammenhæng med kollagenomdannelse i senepatologi”. Matrix Biology. 21 (2): 185-195. doi:10.1016/S0945-053X(01)00196-2. PMID 11852234.
- ^ Moulin, V.; Tam, B. Y. Y. Y.; Castilloux, G.; Auger, F. A.; O’Connor-McCourt, M. D.; Philip, A.; Germain, L. (2001). “Føtale og voksne humane hudfibroblaster viser iboende forskelle i kontraktile kapacitet”. Journal of Cellular Physiology. 188 (2): 211-222. doi:10.1002/jcp.1110. PMID 11424088. S2CID 22026692.
- ^ Boyer, M. I. W. W., J. T.; Lou, J.; Manske, P. R.; Gelberman, R. H.; Cai, S. R. (2001). “Kvantitativ variation i vascular endothelial growth factor mRNA-ekspression under tidlig heling af bøjesenen: en undersøgelse i en hundemodel”. Journal of Orthopaedic Research. 19 (5): 869-872. doi:10.1016/S0736-0266(01)00017-1. PMID 11562135. S2CID 20903366. CS1 maint: multiple names: authors list (link)
- ^ Astrom, M.; Rausing, A. (1995). “Kronisk akillessenenopati – en oversigt over kirurgiske og histopatologiske fund”. Clinical Orthopaedics and Related Research. 316 (316): 151-164. doi:10.1097/00003086-199507000-00021. PMID 7634699. S2CID 25486134.
- ^ Berge, James C. Vanden; Storer, Robert W. (1995). “Intratendinous ossifikation hos fugle: A review”. Journal of Morphology. 226 (1): 47-77. doi:10.1002/jmor.1052260105. PMID 29865323. S2CID 46926646.
- ^ Organ, Chris L. (2006). “Biomekanik af forbenede sener hos ornithopode dinosaurer”. Paleobiology. 32 (4): 652-665. doi:10.1666/05039.1. S2CID 86568665.
