Die übliche Langform des Periodensystems ist so gestaltet, dass die Elektronenkonfigurationen im Vordergrund stehen. Da es die äußersten (Valenz-)Elektronen sind, die in erster Linie an den chemischen Wechselwirkungen zwischen den Atomen beteiligt sind, ist das letzte Elektron, das einem Atom im Aufbauprozess hinzugefügt wird, für einen Chemiker von weitaus größerem Interesse als das erste. Dieses letzte Elektron wird als Unterscheidungselektron bezeichnet, weil es ein Atom von dem unmittelbar vorhergehenden im Periodensystem unterscheidet. Die Art der Unterschale (s, p, d, f), in der sich das Unterscheidungselektron befindet, steht in engem Zusammenhang mit dem chemischen Verhalten eines Elements und führt zu der Klassifizierung, die sich aus der Farbkodierung im Periodensystem ergibt, die Sie hier sehen. Die repräsentativen Elemente sind diejenigen, bei denen das Unterscheidungselektron in die ans- oder p-Unterschale gelangt. Die meisten der Elemente, deren Chemie und Wertigkeit wir bisher besprochen haben, fallen in diese Kategorie. Viele der chemischen Eigenschaften der repräsentativen Elemente lassen sich mit Hilfe von Lewis-Diagrammen erklären. Das heißt, die Wertigkeiten der repräsentativen Elemente lassen sich anhand der Anzahl ihrer Valenzelektronen oder der Anzahl der Elektronen, die hinzugefügt werden müssten, um die gleiche Elektronenkonfiguration wie ein Edelgasatom zu erreichen, vorhersagen. Bei den repräsentativen Elementen entspricht die Anzahl der Valenzelektronen der Nummer der Periodengruppe, und die Anzahl, die benötigt wird, um die nächste Edelgaskonfiguration zu erreichen, ist 8 minus die Gruppennummer. Dies stimmt mit den aus dem Periodensystem abgeleiteten Valenzregeln überein und führt zu Formeln für die Chloride des ersten Dutzend Elemente, die die periodische Variation der Valenz zeigen.
| Element | Atomgewicht | Wasserstoff-Verbindungen | Sauerstoff-Verbindungen | Chlor-Verbindungen |
|---|---|---|---|---|
| Wasserstoff | 1.01 | H2 | H2O, H2O2 | HCl |
| Helium | 4.00 | Nicht gebildet | Nicht gebildet | Nicht gebildet |
| Lithium | 6.94 | LiH | Li2O, Li2O2 | LiCl |
| Beryllium | 9.01 | BeH2 | BeO | BeCl2 |
| Bor | 10.81 | B2H6 | B2O3 | BCl3 |
| Kohlenstoff | 12.01 | CH4, C2H6, C3H8 | CO2, CO, C2O3 | CCl4, C2Cl6 |
| Stickstoff | 14.01 | NH3, N2H4, HN3 | N2O, NO, NO2, N2O5 | NCl3 |
| Sauerstoff | 16.00 | H2O, H2O2 | O2, O3 | <Cl2O, ClO2, Cl2O7 |
| Fluor | 19.00 | HF | OF2, O2F2 | ClF, ClF3, ClF5 |
| Neon | 20.18 | Nicht gebildet | Nicht gebildet | Nicht gebildet |
| Natrium | 22.99 | NaH | Na2O, Na2O2 | NaCl |
| Magnesium | 24.31 | MgH2 | MgO | MgCl2 |
Die ersten drei horizontalen Reihen oder Perioden im modernen Periodensystem bestehen ausschließlich aus repräsentativen Elementen. In der ersten Periode befinden sich die Unterscheidungselektronen von H und He in der 1s-Unterschale. In der zweiten Periode haben Li und Be Unterscheidungselektronen in der 2s-Unterschale, und in den Atomen von B bis Ne werden Elektronen in der 2p-Unterschale hinzugefügt. In der dritten Periode füllt sich die 3s-Unterschale für Na und Mg und damit für Al, Si, P, S, Cl und Ar. In der Regel befindet sich das Unterscheidungselektron bei den repräsentativen Elementen in einer ns oder np Unterschale. Der Wert von n, der Hauptquantenzahl für das Unterscheidungselektron, lässt sich schnell ermitteln, indem man vom oberen Ende des Periodensystems abwärts zählt. Jod ist zum Beispiel ein repräsentatives Element der fünften Periode. Daher muss das Unterscheidungselektron entweder die 5s oder 5p Unterschale besetzen. Da I auf der rechten Seite des Periodensystems steht, ist 5p die richtige Wahl.
Wenn die Hauptquantenzahl drei oder mehr beträgt, sind auch d-Typ-Unterschalen möglich. Die Übergangselemente oder Übergangsmetalle sind die Elemente, deren Unterscheidungselektron sich in einem d-Orbital befindet. Die ersten Beispiele für Übergangsmetalle (Sc, Ti, V, Cr, Mn, Fe, Co, Ni, Cu, Zn) befinden sich in der vierten Periode, obwohl das Unterscheidungselektron in jedem Fall ein 3d-Elektron ist und zur dritten Schale gehört. Diese Lücke entsteht, wie wir bereits gesehen haben, weil das 4s eine niedrigere Energie hat als das 3d. Das 4s-Orbital beginnt sich also zu füllen und die vierte Periode beginnt, bevor eines der 3d-Orbitale besetzt werden kann.
Abbildung \(\PageIndex{1}\) vergleicht die Wahrscheinlichkeitsverteilungen eines 4s und eines 3d-Elektrons in einem V-Atom. Obwohl die 4s-Elektronenwolke im Durchschnitt weiter vom Kern entfernt ist als die 3d-Wolke, befindet sich ein kleiner Teil der 4s-Elektronendichte sehr nahe am Kern, wo er kaum von der gesamten Kernladung von +23 abgeschirmt ist. Es ist die sehr starke Anziehungskraft dieses kleinen Teils der gesamten 4s-Elektronendichte, die die Energie des 4s-Elektrons unter die des 3d-Elektrons senkt.
_and_4s_(color)_Electron_Clouds.jpg?revision=1)
Die Tatsache, dass die 4s-Elektronenwolke umfangreicher ist als die 3d-Elektronenwolke, hat einen wichtigen Einfluss auf die Chemie der Übergangselemente. Wenn ein Atom wie V (Abbildung \(\PageIndex{1}\) ) mit einem anderen Atom in Wechselwirkung tritt, sind es die 4s-Elektronen, die am weitesten vom Kern entfernt sind, die das andere Atom zuerst berühren. Daher sind die 4s-Elektronen bei der Bestimmung der Wertigkeit und der Formeln von Verbindungen oft bedeutender als die 3d-Elektronen. Die 3d-Elektronen sind unter den Oberflächen der Atome der Übergangsmetalle „begraben“. Die Hinzufügung eines weiteren 3d-Elektrons hat wesentlich geringere Auswirkungen auf ihre chemischen Eigenschaften als die Hinzufügung eines weiteren 3s oder 3p-Elektrons im Falle der repräsentativen Elemente. Daher gibt es einen langsamen, aber stetigen Übergang der Eigenschaften von einem Übergangselement zum anderen. Man beachte beispielsweise, dass mit Ausnahme von Sc alle Übergangsmetalle Chloride, MCl2, bilden, bei denen das Metall eine Wertigkeit von 2 hat; Beispiele sind TiCl2, VCl2, CrCl2 usw. Dies geht aus der Tabelle oben auf dieser Seite hervor. Die Wertigkeit 2 entspricht den beiden 4s-Valenz-Elektronen.
Jedes der Übergangsmetalle weist auch andere Wertigkeiten auf, bei denen auch ein oder mehrere 3d-Elektronen beteiligt sind. So hat V (Vanadium) in einigen Verbindungen eine Wertigkeit von 2 (VO, VCl2), in anderen eine Wertigkeit von 3 (V2O3, VCl3), in wieder anderen eine Wertigkeit von 4 (VO2, VCl4) und in mindestens einem Fall (V2O5) eine Wertigkeit von 5. Die Chemie der Übergangsmetalle ist komplizierter, und aufgrund dieser variablen Wertigkeit ist eine größere Vielfalt an Formeln für Übergangsmetallverbindungen möglich. In einigen Fällen fungieren die Elektronen in den d-Unterschalen als Valenzelektronen, in anderen Fällen hingegen nicht. Obwohl die 3d-Elektronenwolken nicht weiter vom Kern entfernt sind als 3s und 3p (und daher keine weitere Schale wie die 4s-Elektronen bilden), sind sie gründlich von der Kernladung abgeschirmt und fungieren daher oft als Valenzelektronen. Dieses Jekyll- und Hyde-Verhalten der 3d-Elektronen macht das Leben für Chemiker, die die Übergangselemente untersuchen, komplizierter (und oft viel interessanter).
| Z | Element | Konfiguration |
|---|---|---|
| 1 | H | 1s 1 |
| 2 | He | 1s 2 |
| 3 | Li | 2s 1 |
| 4 | Be | 2s 2 |
| 5 | B | 2s 2 2p1 |
| 6 | C | 2s 2 2p2 |
| 7 | N | 2s 2 2p3 |
| 8 | 0 | 2s 2 2p4 |
| 9 | F | 2s 2 2p5 |
| 10 | Ne | 2s 2 2p6 |
| 11 | Na | 3s 1 |
| 12 | Mg | 3s 2 |
| 13 | Al | 3s 2 3p1 |
| 14 | Si | 3s 2 3p2 |
| 15 | P | 3s 2 3p3 |
| 16 | S | 3s 2 3p4 |
| 17 | Cl | 3s 2 3p5 |
| 18 | Ar | 3s 2 3p6 |
| 19 | K | 4s 1 |
| 20 | Ca | 4s 2 |
| 21 | Sc | 3d 1 4s 2 |
| 22 | Ti | 3d 2 4s 2 |
| 23 | V | 3d 3 4s 2 |
| 24 | Cr | 3d 5 4s 1 |
| 25 | Mn | 3d 5 4s 2 |
| 26 | Fe | 3d 6 4s 2 |
| 27 | Co | 3d 7 4s 2 |
| 28 | Ni | 3d 8 4s 2 |
| 29 | Cu | 3d 10 4s 1 |
| 30 | Zn | 3d 10 4s 2 |
| 31 | Ga | 3d 10 4s 2 4p 1 |
| 32 | Ge | 3d 10 4s 2 4p 2 |
| 33 | As | 3d 10 4s 2 4p 3 |
| 34 | Se | 3d 10 4s 2 4p 4 |
| 35 | Br | 3d 10 4s 2 4p 5 |
| 36 | Kr | 3d 10 4s 2 4p 6 |
| 37 | Rb | 5s 1 |
| 38 | Sr | 5s 2 |
| 39 | Y | 4d 1 5s 2 |
| 40 | Zr | 4d 2 5s 2 |
| 41 | Nb | 4d 4 5s 1 |
| 42 | Mo | 4d 5 5s 1 |
| 43 | Tc | 4d 5 5s 2 |
| 44 | Ru | 4d 7 5s 1 |
| 45 | Rh | 4d 8 5s 1 |
| 46 | Pd | 4d 10 |
| 47 | Ag | 4d 10 5s 1 |
| 48 | Cd | 4d 10 5s 2 |
| 49 | In | 4d 10 5s 2 5p 1 |
| 50 | Sn | 4d 10 5s 2 5p 2 |
| 51 | Sb | 4d 10 5s 2 5p 3 |
| 52 | Te | 4d 10 5s 2 5p 4 |
| 53 | I | 4d 10 5s 2 5p 5 |
| 54 | Xe | 4d 10 5s 2 5p 6 |
| 55 | Cs | 6s 1 |
| 56 | Ba | 6s 2 |
| 57 | La | 5d 1 6s 2 |
| 58 | Ce | 4f 1 5d 1 6s 2 |
| 59 | Pr | 4f 3 6s 2 |
| 60 | Nd | 4f 4 6s 2 |
| 61 | Pm | 4f 5 6s 2 |
| 62 | Sm | 4f 6 6s 2 |
| 63 | Eu | 4f 7 6s 2 |
| 64 | Gd | 4f 7 5d 1 6s 2 |
| 65 | Tb | 4f 9 6s 2 |
| 66 | Dy | 4f 10 6s 2 |
| 67 | Ho | 4f 11 6s 2 |
| 68 | Er | 4f 12 6s 2 |
| 69 | Tm | 4f 13 6s 2 |
| 70 | Yb | 4f 14 6s 2 |
| 71 | Lu | 4f 14 5d 1 6s 2 |
| 72 | Hf | 4f 14 5d 2 6s 2 |
| 73 | Ta | 4f 14 5d 3 6s 2 |
| 74 | W | 4f 14 5d 4 6s 2 |
| 75 | Re | 4f 14 5d 5 6s 2 |
| 76 | 0s | 4f 14 5d 6 6s 2 |
| 77 | Ir | 4f 14 5d 7 6s 2 |
| 78 | Pt | 4f 14 5d 9 6s 1 |
| 79 | Au | 4f 14 5d 10 6s 1 |
| 80 | Hg | 4f 14 5d 10 6s 2 |
| 81 | Tl | 4f 14 5d 10 6s 2 6p1 |
| 82 | Pb | 4f 14 5d 10 6s 2 6p2 |
| 83 | Bi | 4f 14 5d 10 6s 2 6p 3 |
| 84 | Po | 4f 14 5d 10 6s 2 6p 4 |
| 85 | At | 4f 14 5d 10 6s 2 6p 5 |
| 86 | Rn | 4f 14 5d 10 6s 2 6p 6 |
| 87 | Fr | 7s 1 |
| 88 | Ra | 7s 2 |
| 89 | Ac | 6d 1 7s 2 |
| 90 | Th | 6d 2 7s 2 |
| 91 | Pa | 5f 2 6d 1 7s 2 |
| 92 | U | 5f 3 6d 1 7s 2 |
| 93 | Np | 5f 4 6d 1 7s 2 |
| 94 | Pu | 5f 6 7s 2 |
| 95 | Am | 5f 7 7s 2 |
| 96 | Cm | 5f 7 6d 1 s 2 |
| 97 | Bk | 5f 9 s 2 |
| 98 | Cf | 5f 10 s 2 |
| 99 | Es | 5f 11 s 2 |
| 100 | Fm | 5f 12 s 2 |
| 101 | Md | 5f 13 s 2 |
| 102 | No | 5f 14 s 2 |
| 103 | Lr | 5f 14 6d 1 s 2 |
| 104 | Rf | 5f 14 6d 2 s 2 |
Die dritte große Kategorie von Elementen tritt auf, wenn das Unterscheidungselektron eine f-Unterschale besetzt. Das erste Beispiel sind die Lanthanoide (Elemente mit Ordnungszahlen zwischen 57 und 71), die die allgemeine Elektronenkonfiguration
4d104f i5s25p65d0 oder 16s2
haben, wobei i eine Zahl zwischen 0 und 14 ist. Beim Aufbau der Lanthanoide werden also Elektronen zu einer Unterschale (4f) hinzugefügt, deren Hauptquantenzahl um zwei niedriger ist als die des äußersten Orbitales (6s). Die Hinzufügung eines weiteren Elektrons zu einer inneren Schale, die so tief vergraben ist wie die 4f-Schale, hat nur geringe oder keine Auswirkungen auf die chemischen Eigenschaften dieser Elemente. Alle sind dem Lanthan (La) recht ähnlich und könnten im Periodensystem genau den gleichen Platz einnehmen wie La. Die Lanthanoidelemente sind einander so ähnlich, dass spezielle Techniken erforderlich sind, um sie zu trennen. Daher konnten bis in die 1870er Jahre nicht einmal annähernd reine Proben von den meisten von ihnen hergestellt werden. Auf das Element Actinium (Ac) folgt eine Reihe von Atomen, bei denen die 5f-Unterschale besetzt ist. Die Actinoide sind Ac etwas weniger ähnlich als die Lanthanoide La, da bei Th, Pa und U einige Ausnahmen von der üblichen Reihenfolge der Füllungsorbitale auftreten (Tabelle \(\PageIndex{1}\) ).
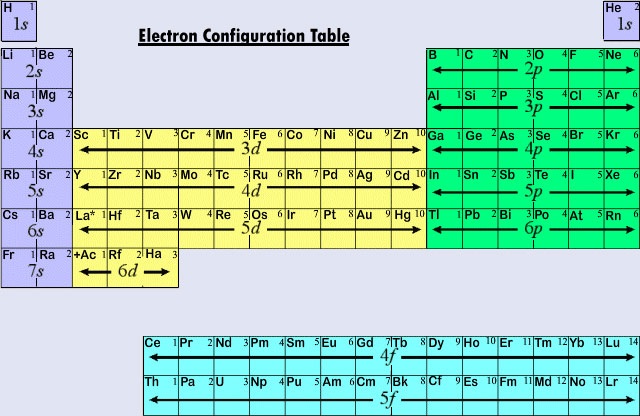
Da sich die Lanthanoide und die meisten Actinoide chemisch so verhalten, als ob sie in die Gruppe IIIB des Periodensystems gehören würden (wo Lu und Lr zu finden sind), sind beide Gruppen vom Rest der Tabelle getrennt und in einem Block darunter angeordnet. Zusammengenommen werden die Lanthanoide und Actinoide als innere Übergangselemente bezeichnet, weil die f-Unterschalen, die gefüllt werden, so tief in der übrigen elektronischen Struktur ihrer Atome liegen.
Abbildung \(\PageIndex{2}\) fasst die Art der Unterschale zusammen, in der das Unterscheidungselektron für Atome von Elementen in verschiedenen Regionen des Periodensystems zu finden ist. Diese zusammenfassende Information macht es relativ einfach, das Periodensystem zu benutzen, um Elektronenkonfigurationen zu erhalten, wie das folgende Beispiel zeigt.
Beispiel \(\PageIndex{1}\): Elektronenkonfiguration
Ermitteln Sie die Elektronenkonfiguration für (a) Nb; (b) Pr.
Lösung
a) Nb, das Element mit der Nummer 41, befindet sich in der fünften Periode und in einem Bereich des Periodensystems, in dem eine d-Unterschale gefüllt ist (die zweite Übergangsreihe). Bewegt man sich im Periodensystem rückwärts (zu niedrigeren Ordnungszahlen hin), so ist das nächste Edelgas Kr, und so verwenden wir den Kr-Kern:
Nb _____
Das nächste Element nach 36K ist 37Rb, in dem die 5s-Unterschale gefüllt ist. Geht man noch einen Platz weiter nach rechts, kommt man zu 38Sr, das ein 5s2-Paar hat. Bis jetzt haben wir Nb _____ 5s2 für die Nb-Konfiguration. Wir bewegen uns nun weiter nach rechts in den 4d-Unterschalenbereich des Periodensystems und zählen über drei Stellen (Y, Zr, Nb), um Nb zu erreichen. Die Gesamtelektronenkonfiguration ist also Nb 4d35s2 (Man beachte, dass die Hauptquantenzahl der d-Unterschale 4 ist – eine weniger als die Zahl der Periode. Wenn man sich die Tabelle der Elektronenkonfigurationen anschaut, sollte man auch beachten, dass Nb eine Ausnahme von den typischen Orbitalbesetzungsregeln ist). b) Ein ähnliches Verfahren wird für Pr, Element Nummer 59, angewandt. Wenn man in der Tabelle zurückgeht, ist das nächstgelegene Edelgas Xe, so dass wir den Xe-Kern verwenden. Zählt man wieder vorwärts, so entsprechen Cs und Ba dem 6s2. Dann entsprechen La, Ce und Pr drei weiteren Elektronen in der 4f-Unterschale. Die Konfiguration ist also Pr…4f36s2
Ein weiterer Punkt muss über die Beziehung zwischen der Elektronenkonfiguration und dem Periodensystem hervorgehoben werden. Die Atome der Elemente in der gleichen vertikalen Spalte der Tabelle haben ähnliche Elektronenkonfigurationen. Betrachten wir zum Beispiel die Erdalkalielemente (Gruppe IIA). Unter Anwendung unserer Regeln zur Ableitung von Elektronenkonfigurationen (Beispiel 1) ergibt sich
| Element | Elektronenkonfiguration | Lewis-Diagramm |
|---|---|---|
| Be | 2s2 | Be: |
| Mg | 3s2 | Mg: |
| Ca | 4s2 | Ca: |
| Sr | 5s2 | Sr: |
| Ba | 6s2 | Ba: |
| Ra | 7s2 | Ra: |
Die bereits erwähnten Ähnlichkeiten im chemischen Verhalten und in der Wertigkeit dieser Elemente korrelieren also mit den Ähnlichkeiten in ihren äußersten Elektronenwolken. Solche Ähnlichkeiten erklären den Erfolg von Mendelejews Vorhersagen über die Eigenschaften der unentdeckten Elemente.
Beitragende und Zuschreibungen
-
Ed Vitz (Kutztown University), John W. Moore (UW-Madison), Justin Shorb (Hope College), Xavier Prat-Resina (University of Minnesota Rochester), Tim Wendorff, und Adam Hahn.
