\
Abhängig von den Säure-Base-Eigenschaften der Ionen, aus denen es besteht, kann sich ein Salz in Wasser auflösen und eine neutrale Lösung, eine basische Lösung oder eine saure Lösung erzeugen.
Wenn sich ein Salz wie \(NaCl\) in Wasser auflöst, entstehen \(Na^+_{(aq)}\) und \(Cl^-_{(aq)}\) Ionen. Unter Verwendung eines Lewis-Ansatzes kann das \(Na^+\)-Ion als Säure betrachtet werden, da es ein Elektronenpaarakzeptor ist, obwohl seine geringe Ladung und sein relativ großer Radius es zu einer sehr schwachen Säure machen. Das \(Cl^-\)-Ion ist die konjugierte Base der starken Säure \(HCl\), hat also praktisch keinen basischen Charakter. Folglich hat das Lösen von \(NaCl\) in Wasser keine Auswirkung auf den \(pH\) einer Lösung, und die Lösung bleibt neutral.
Lassen Sie uns nun dieses Verhalten mit dem Verhalten von wässrigen Lösungen von Kaliumcyanid und Natriumacetat vergleichen. Auch hier haben die Kationen (\(K^+\) und \(Na^+\)) im Wesentlichen keinen sauren Charakter, aber die Anionen (\(CN^-\) und \(CH_3CO_2^-\)) sind schwache Basen, die mit Wasser reagieren können, weil sie die konjugierten Basen der schwachen Säuren \(HCN\) bzw. Essigsäure sind.
\
\
Beide Reaktionen verlaufen, wie geschrieben, sehr weit rechts, weil die Bildung des schwächeren Säure-Basen-Paares bevorzugt wird. Sowohl \(HCN\) als auch Essigsäure sind stärkere Säuren als Wasser, und Hydroxid ist eine stärkere Base als Acetat oder Cyanid, so dass in beiden Fällen das Gleichgewicht links liegt. Nichtsdestotrotz erzeugt jede dieser Reaktionen genügend Hydroxidionen, um eine basische Lösung zu erzeugen. So beträgt beispielsweise der \(pH\) einer 0,1 M Lösung von Natriumacetat oder Kaliumcyanid bei 25°C 8,8 bzw. 11,1. Aus der Tabelle \(\PageIndex{1}\) und der Abbildung \(\PageIndex{1}\) geht hervor, dass \(CN^-\) eine stärkere Base ist (\(pK_b = 4,79\)) als Acetat (\(pK_b = 9.24\)), was damit übereinstimmt, dass \(KCN\) bei gleicher Konzentration eine basischere Lösung als Natriumacetat ergibt.
Im Gegensatz dazu sollte die konjugierte Säure einer schwachen Base eine schwache Säure sein (Gleichung \(\ref{16.2}\)). Zum Beispiel sind Ammoniumchlorid und Pyridiniumchlorid Salze, die durch Reaktion von Ammoniak bzw. Pyridin mit \(HCl\) hergestellt werden. Wie Sie bereits wissen, ist das Chloridion eine so schwache Base, dass es nicht mit Wasser reagiert. Im Gegensatz dazu sind die Kationen der beiden Salze schwache Säuren, die mit Wasser wie folgt reagieren:
\
\
Gleichung \(\ref{16.2}\) zeigt, dass \(H_3O^+\) eine stärkere Säure ist als \(NH_4^+\) oder \(C_5H_5NH^+\), und umgekehrt sind Ammoniak und Pyridin beide stärkere Basen als Wasser. Das Gleichgewicht wird daher in beiden Fällen weit links liegen und das schwächere Säure-Base-Paar begünstigen. Die durch die Reaktionen erzeugte \(H_3O^+\)-Konzentration ist jedoch groß genug, um den \(pH\) der Lösung erheblich zu senken: Der \(pH\) einer 0,10 M Lösung von Ammoniumchlorid oder Pyridiniumchlorid bei 25°C beträgt 5,13 bzw. 3,12. Dies stimmt mit den Angaben in Abbildung 16.2 überein und deutet darauf hin, dass das Pyridinium-Ion saurer ist als das Ammonium-Ion.
Was geschieht mit wässrigen Lösungen eines Salzes wie Ammoniumacetat, bei dem sowohl das Kation als auch das Anion getrennt mit Wasser reagieren können, um eine Säure bzw. eine Base zu bilden? Gemäß Abbildung 16.10 senkt das Ammoniumion den \(pH\), während das Acetat-Ion gemäß Gleichung \(\ref{16.3}\) den \(pH\) erhöht. Dieser besondere Fall ist insofern ungewöhnlich, als das Kation eine ebenso starke Säure wie das Anion eine Base ist (pKa ≈ pKb). Folglich heben sich die beiden Effekte auf, und die Lösung bleibt neutral. Bei Salzen, bei denen das Kation eine stärkere Säure ist als das Anion eine Base, hat die endgültige Lösung einen \(pH\) < 7,00. Umgekehrt, wenn das Kation eine schwächere Säure ist als das Anion eine Base, hat die Endlösung einen \(pH\) > 7,00.
Lösungen von einfachen Salzen von Metallionen können auch sauer sein, obwohl ein Metallion nicht direkt ein Proton an Wasser abgeben kann, um \(H_3O^+\) zu erzeugen. Stattdessen kann ein Metallion als Lewis-Säure fungieren und mit Wasser, einer Lewis-Base, in Wechselwirkung treten, indem es sich mit einem einsamen Elektronenpaar am Sauerstoffatom koordiniert und ein hydratisiertes Metallion bildet (Teil (a) in Abbildung \(\PageIndex{1}\)). Ein mit einem Metallion koordiniertes Wassermolekül ist aus zwei Gründen saurer als ein freies Wassermolekül. Erstens machen es abstoßende elektrostatische Wechselwirkungen zwischen dem positiv geladenen Metallion und den teilweise positiv geladenen Wasserstoffatomen des koordinierten Wassermoleküls dem koordinierten Wasser leichter, ein Proton zu verlieren.
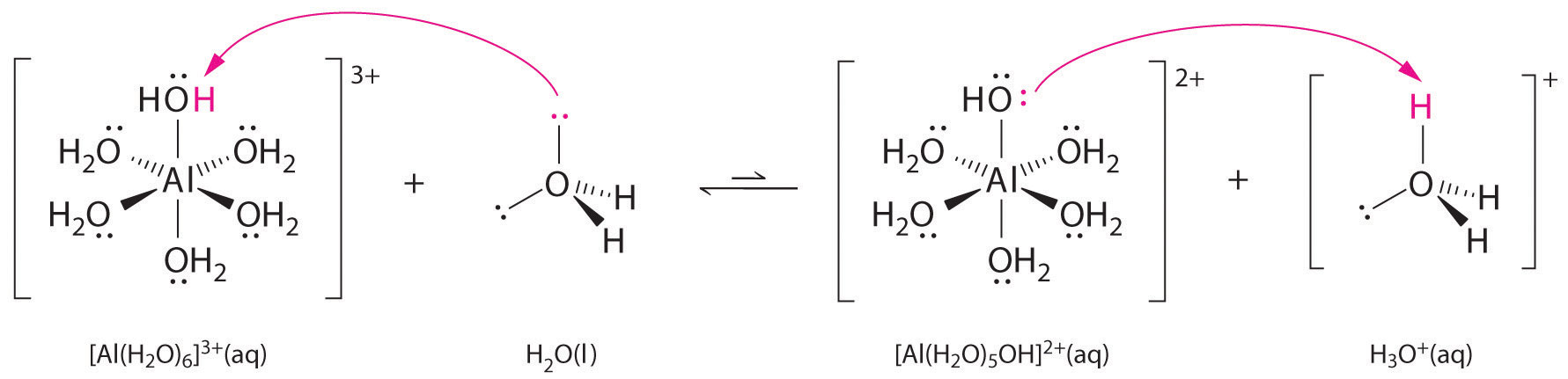
Zweitens zieht die positive Ladung des \(Al^{3+}\)-Ions Elektronendichte von den Sauerstoffatomen der Wassermoleküle an, wodurch die Elektronendichte in den \(\ce{O-H}\)-Bindungen abnimmt, wie in Teil (b) in Abbildung \(\PageIndex{1}\) gezeigt. Bei geringerer Elektronendichte zwischen den \(O\)-Atomen und den H-Atomen sind die \(\ce{O-H}\)-Bindungen schwächer als in einem freien \(H_2O\)-Molekül, wodurch es leichter ist, ein \(H^+\)-Ion zu verlieren.
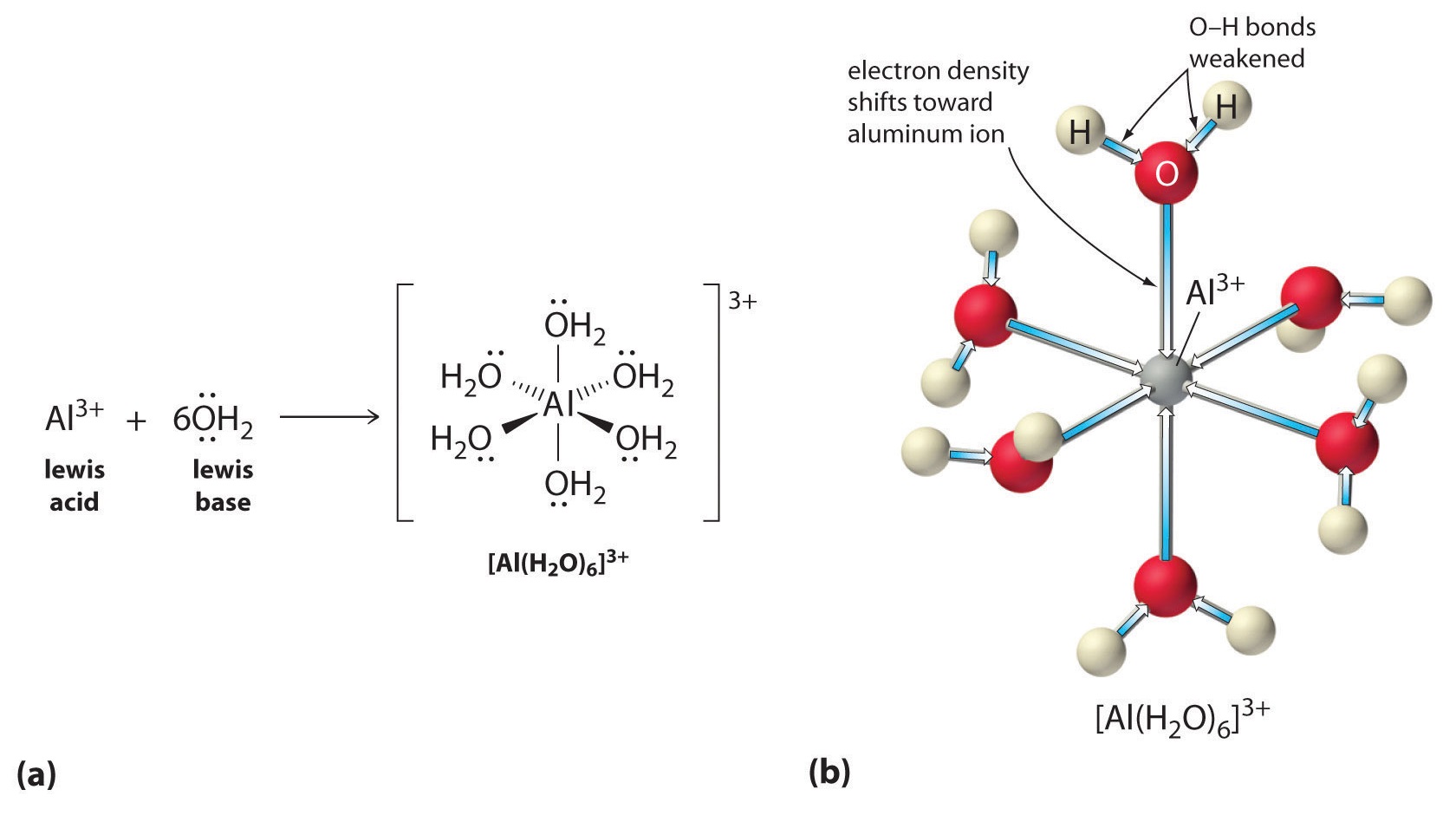
Abbildung \(\PageIndex{1}\): Wirkung eines Metallions auf den Säuregrad von Wasser (a) Die Reaktion des Metallions \(Al^{3+}\) mit Wasser unter Bildung des hydratisierten Metallions ist ein Beispiel für eine Lewis-Säure-Base-Reaktion. (b) Die positive Ladung des Aluminiumions zieht die Elektronendichte von den Sauerstoffatomen an, wodurch sich die Elektronendichte von den O-H-Bindungen weg verschiebt. Die Abnahme der Elektronendichte schwächt die O-H-Bindungen in den Wassermolekülen und macht es ihnen leichter, ein Proton zu verlieren.
Das Ausmaß dieses Effekts hängt von den folgenden beiden Faktoren ab (Abbildung \(\PageIndex{2}\)):
- Die Ladung des Metallions. Ein zweiwertiges Ion (\(M^{2+}\)) wirkt sich etwa doppelt so stark auf die Elektronendichte in einem koordinierten Wassermolekül aus wie ein einwertiges Ion (\(M^+\)) mit demselben Radius.
- Der Radius des Metallions. Für Metallionen mit gleicher Ladung gilt: Je kleiner das Ion ist, desto kürzer ist der innere Kernabstand zum Sauerstoffatom des Wassermoleküls und desto größer ist die Wirkung des Metalls auf die Elektronendichteverteilung im Wassermolekül.
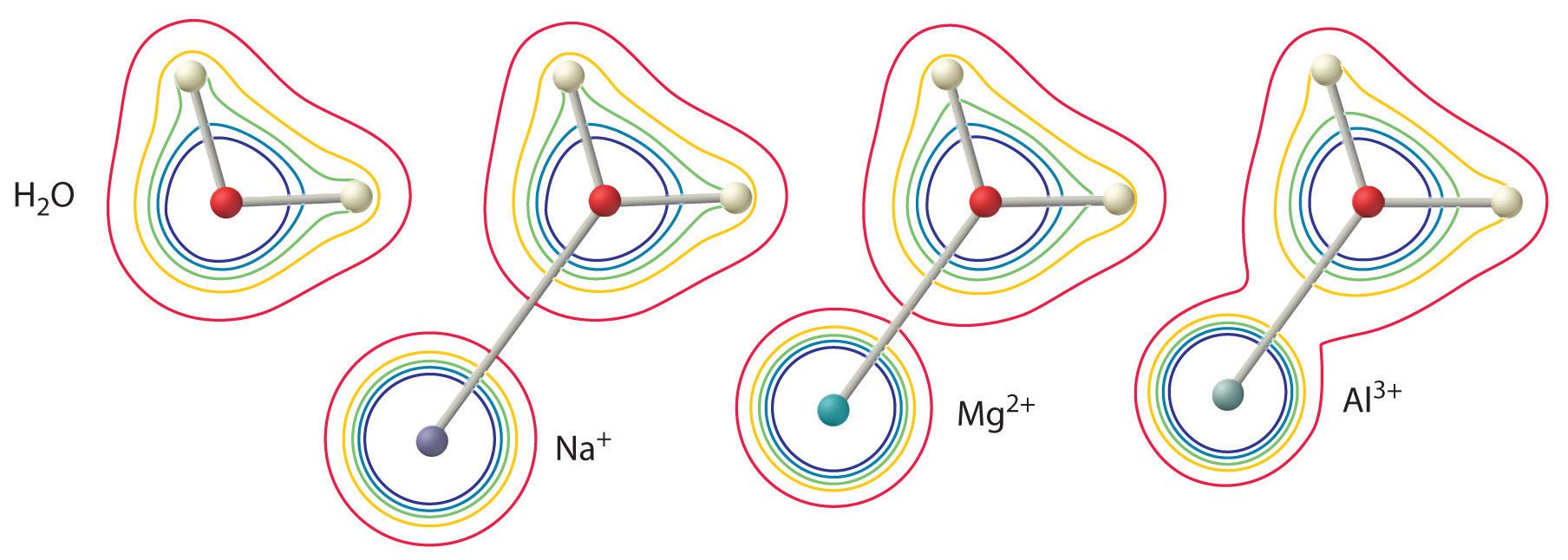
Abbildung \(\PageIndex{2}\): Der Einfluss der Ladung und des Radius eines Metallions auf die Acidität eines koordinierten Wassermoleküls. Die Konturen zeigen die Elektronendichte an den O- und H-Atomen sowohl in einem freien Wassermolekül (links) als auch in Wassermolekülen, die an \(Na^+\), \(Mg^{2+}\) und \(Al^{3+}\) Ionen koordiniert sind. Diese Konturenkarten zeigen, dass das kleinste, am stärksten geladene Metallion (\(Al^{3+}\)) die größte Abnahme der Elektronendichte der O-H-Bindungen des Wassermoleküls verursacht. Aufgrund dieses Effekts nimmt die Azidität hydratisierter Metallionen zu, wenn die Ladung des Metallions zunimmt und sein Radius abnimmt.
Daher sind wässrige Lösungen kleiner, hochgeladener Metallionen, wie \(Al^{3+}\) und \(Fe^{3+}\), sauer:
\^{3+}_{(aq)} \rightleftharpoons ^{2+}_{(aq)}+H^+_{(aq)} \label{16.36}\]
Das \(^{3+}\)-Ion hat einen \(pK_a\) von 5,0 und ist damit eine fast ebenso starke Säure wie Essigsäure. Aufgrund der beiden zuvor beschriebenen Faktoren ist der wichtigste Parameter für die Vorhersage der Wirkung eines Metallions auf den Säuregrad koordinierter Wassermoleküle das Verhältnis von Ladung zu Radius des Metallions. Eine Reihe von Metallionenpaaren, die im Periodensystem auf einer diagonalen Linie liegen, wie z. B. \(Li^+\) und \(Mg^{2+}\) oder \(Ca^{2+}\) und \(Y^{3+}\), haben unterschiedliche Größen und Ladungen, aber ein ähnliches Verhältnis von Ladung zu Radius. Daher haben diese Metallionenpaare ähnliche Auswirkungen auf den Säuregrad koordinierter Wassermoleküle, und sie weisen oft auch andere signifikante Ähnlichkeiten in der Chemie auf.
Lösungen kleiner, hochgeladener Metallionen in Wasser sind sauer.
Reaktionen wie die in diesem Abschnitt besprochenen, bei denen ein Salz mit Wasser reagiert und eine saure oder basische Lösung ergibt, werden oft als Hydrolysereaktionen bezeichnet. Die Verwendung eines separaten Namens für diese Art von Reaktion ist unglücklich, weil sie suggeriert, dass sie irgendwie anders sind. Tatsächlich sind Hydrolysereaktionen nur Säure-Base-Reaktionen, bei denen die Säure ein Kation oder die Base ein Anion ist; sie gehorchen den gleichen Prinzipien und Regeln wie alle anderen Säure-Base-Reaktionen.
Eine Hydrolysereaktion ist eine Säure-Base-Reaktion.
Beispiel \(\PageIndex{1}\)
Bestimmen Sie, ob wässrige Lösungen dieser Verbindungen sauer, basisch oder neutral sind.
- \(KNO_3\)
- \(CrBr_3 cdot H_2O\)
- \(Na_2SO_4\)
Gegeben: Verbindung
Gefragt: Acidität oder Basizität der wässrigen Lösung
Strategie:
- Bewerte die Säure-Base-Eigenschaften des Kations und des Anions. Wenn das Kation eine schwache Lewis-Säure ist, wird es den \(pH\) der Lösung nicht beeinflussen. Wenn das Kation jedoch die konjugierte Säure einer schwachen Base oder ein relativ stark geladenes Metallkation ist, wird es mit Wasser reagieren und eine saure Lösung erzeugen.
- Wenn das Anion die konjugierte Base einer starken Säure ist, wird es den \(pH\) der Lösung nicht beeinflussen. Wenn das Anion jedoch die konjugierte Base einer schwachen Säure ist, wird die Lösung basisch sein.
Lösung:
a
- Das \(K^+\)-Kation hat eine kleine positive Ladung (+1) und einen relativ großen Radius (weil es in der vierten Reihe des Periodensystems steht), daher ist es eine sehr schwache Lewis-Säure.
- Das \(NO_3-\)-Anion ist die konjugierte Base einer starken Säure, hat also praktisch keinen basischen Charakter (Tabelle 16.1). Daher reagieren weder das Kation noch das Anion mit Wasser unter Bildung von \(H^+\) oder \(OH^-\), und die Lösung ist neutral.
b.
- Das \(Cr^{3+}\)-Ion ist ein relativ stark geladenes Metallkation, das sich ähnlich wie das \(Al^{3+}\)-Ion verhalten und den \(^{3+}\)-Komplex bilden sollte, der sich wie eine schwache Säure verhalten wird: \^{3+}_{(aq)} \ce{ <=>>} Cr(H_2O)_5(OH)]^{2+}_{(aq)} + H^+_{(aq)}
- Das \(Br^-\)-Anion ist eine sehr schwache Base (es ist die konjugierte Base der starken Säure \(HBr\)), daher beeinflusst es den \(pH\) der Lösung nicht. Daher wird die Lösung sauer sein.
c.
- Das \(Na^+\)-Ion ist wie das \(K^+\)-Ion eine sehr schwache Säure, daher sollte es den Säuregrad der Lösung nicht beeinflussen.
- Im Gegensatz dazu ist \(SO_4^{2-}\) die konjugierte Base von \(HSO_4^-\), das eine schwache Säure ist. Daher reagiert das \(SO_4^{2-}\)-Ion mit Wasser wie in Abbildung 16.6 gezeigt zu einer leicht basischen Lösung.
Übung \(\PageIndex{1}\)
Vorhersagen, ob wässrige Lösungen der folgenden Stoffe sauer, basisch oder neutral sind.
- \(KI\)
- \(Mg(ClO_4)_2\)
- \(NaHS\)
Antwort:
- neutral
- sauer
- basisch (durch die Reaktion von \(HS^-\) mit Wasser zu \(H_2S\) und \(OH^-\))
Zusammenfassung
Ein Salz kann sich in Wasser lösen und eine neutrale, eine basische oder eine saure Lösung, je nachdem, ob es die konjugierte Base einer schwachen Säure als Anion (\(A^-\)), die konjugierte Säure einer schwachen Base als Kation (\(BH^+\)) oder beides enthält. Salze, die kleine, stark geladene Metallionen enthalten, bilden in Wasser saure Lösungen. Die Reaktion eines Salzes mit Wasser zur Bildung einer sauren oder basischen Lösung wird als Hydrolysereaktion bezeichnet.
