Lernziele
- Beschreiben Sie die Komponenten, die an einer Muskelkontraktion beteiligt sind
- Erläutern Sie, wie Muskeln kontrahieren und entspannen
- Beschreiben Sie das Gleitfadenmodell der Muskelkontraktion
Die Abfolge der Ereignisse, die zur Kontraktion einer einzelnen Muskelfaser führen, beginnt mit einem Signal – dem Neurotransmitter, ACh – von dem motorischen Neuron, das diese Faser innerviert. Die lokale Membran der Faser depolarisiert sich, wenn positiv geladene Natriumionen (Na+) eindringen, was ein Aktionspotenzial auslöst, das sich auf den Rest der Membran ausbreitet, einschließlich der T-Röhrchen, die sich depolarisieren. Dadurch wird die Freisetzung von Kalziumionen (Ca++) aus den Speichern im sarkoplasmatischen Retikulum (SR) ausgelöst. Das Ca++ leitet dann die Kontraktion ein, die durch ATP aufrechterhalten wird (Abbildung 1). Solange Ca++-Ionen im Sarkoplasma verbleiben, um sich an Troponin zu binden, das die Aktin-Bindungsstellen „unabgeschirmt“ hält, und solange ATP verfügbar ist, um den Kreuzbrücken-Zyklus und das Ziehen der Aktin-Stränge durch Myosin anzutreiben, verkürzt sich die Muskelfaser weiter bis zu einer anatomischen Grenze.

Abbildung 1. Kontraktion einer Muskelfaser. Es bildet sich eine Querbrücke zwischen Aktin und den Myosinköpfen, die die Kontraktion auslöst. Solange Ca++-Ionen im Sarkoplasma verbleiben, um sich an Troponin zu binden, und solange ATP zur Verfügung steht, verkürzt sich die Muskelfaser weiter.
Die Muskelkontraktion endet in der Regel, wenn die Signalübertragung vom Motoneuron endet, wodurch das Sarkolemm und die T-Tubuli repolarisiert und die spannungsgesteuerten Kalziumkanäle im SR geschlossen werden. Daraufhin werden Ca++-Ionen zurück in den SR gepumpt, was das Tropomyosin veranlasst, die Bindungsstellen an den Aktinsträngen wieder abzuschirmen (oder neu zu bedecken). Ein Muskel kann auch aufhören zu kontrahieren, wenn ihm das ATP ausgeht und er ermüdet (Abbildung 2).

Abbildung 2. Relaxation einer Muskelfaser. Ca++-Ionen werden zurück in den SR gepumpt, was das Tropomyosin veranlasst, die Bindungsstellen an den Aktinsträngen wieder abzuschirmen. Ein Muskel kann auch aufhören, sich zusammenzuziehen, wenn ihm das ATP ausgeht und er ermüdet.
Die molekularen Vorgänge der Muskelfaserverkürzung finden innerhalb der Sarkomere der Faser statt (siehe Abbildung 3). Die Kontraktion einer quergestreiften Muskelfaser erfolgt, indem sich die Sarkomere, die linear in den Myofibrillen angeordnet sind, verkürzen, wenn die Myosinköpfe an den Aktinfilamenten ziehen.
Der Bereich, in dem sich dicke und dünne Filamente überlappen, hat ein dichtes Erscheinungsbild, da zwischen den Filamenten wenig Platz ist. Dieser Bereich, in dem sich dünne und dicke Filamente überlappen, ist für die Muskelkontraktion sehr wichtig, da hier die Bewegung der Filamente beginnt. Die dünnen Filamente, die an ihren Enden durch die Z-Scheiben verankert sind, erstrecken sich nicht vollständig in den zentralen Bereich, der nur dicke Filamente enthält, die an ihren Basen an einer Stelle verankert sind, die M-Linie genannt wird. Eine Myofibrille besteht aus vielen Sarkomeren, die entlang ihrer Länge verlaufen; daher ziehen sich Myofibrillen und Muskelzellen zusammen, wenn sich die Sarkomere zusammenziehen.
Das Modell der gleitenden Filamente bei der Kontraktion
Auf das Signal eines Motoneurons hin zieht sich eine Skelettmuskelfaser zusammen, indem die dünnen Filamente gezogen werden und dann an den dicken Filamenten innerhalb der Sarkomere der Faser vorbeigleiten. Dieser Vorgang wird als Gleitfilamentmodell der Muskelkontraktion bezeichnet (Abbildung 3). Das Gleiten kann nur stattfinden, wenn Myosin-Bindungsstellen auf den Aktinfilamenten durch eine Reihe von Schritten freigelegt werden, die mit dem Eintritt von Ca++ in das Sarkoplasma beginnen.

Abbildung 3. Das Modell der gleitenden Filamente bei der Muskelkontraktion. Wenn sich ein Sarkomer zusammenzieht, rücken die Z-Linien näher zusammen, und das I-Band wird kleiner. Das A-Band bleibt in seiner Breite gleich. Bei voller Kontraktion überlappen sich die dünnen und dicken Filamente.
Tropomyosin ist ein Protein, das sich um die Ketten des Aktinfilaments windet und die Myosin-Bindungsstellen abdeckt, um zu verhindern, dass Aktin an Myosin bindet. Tropomyosin bindet sich an Troponin, um einen Troponin-Tropomyosin-Komplex zu bilden. Der Troponin-Tropomyosin-Komplex verhindert, dass die Myosin-„Köpfe“ an die aktiven Stellen auf den Aktin-Mikrofilamenten binden. Troponin hat auch eine Bindungsstelle für Ca++-Ionen.
Um die Muskelkontraktion einzuleiten, muss Tropomyosin die Myosin-Bindungsstelle auf einem Aktinfilament freilegen, um die Bildung von Querbrücken zwischen den Aktin- und Myosin-Mikrofilamenten zu ermöglichen. Der erste Schritt im Kontraktionsprozess besteht darin, dass Ca++ an Troponin bindet, so dass Tropomyosin von den Bindungsstellen auf den Aktinsträngen weggleiten kann. Dies ermöglicht es den Myosinköpfen, sich an diese freigelegten Bindungsstellen zu binden und Querbrücken zu bilden. Die dünnen Filamente werden dann von den Myosinköpfen gezogen, um an den dicken Filamenten vorbei zur Mitte des Sarkomers zu gleiten. Jeder Kopf kann jedoch nur eine sehr kurze Strecke ziehen, bevor er sein Limit erreicht hat und „neu gespannt“ werden muss, bevor er wieder ziehen kann, ein Schritt, für den ATP benötigt wird.
ATP und Muskelkontraktion
Damit die dünnen Filamente während der Muskelkontraktion weiterhin an den dicken Filamenten vorbeigleiten können, müssen die Myosinköpfe das Aktin an den Bindungsstellen ziehen, sich ablösen, neu spannen, sich an weiteren Bindungsstellen anlagern, ziehen, ablösen, neu spannen, usw. Diese wiederholte Bewegung wird als Kreuzbrückenzyklus bezeichnet. Diese Bewegung der Myosinköpfe ist vergleichbar mit den Rudern, die eine Person beim Rudern eines Bootes benutzt: Die Ruder (die Myosinköpfe) ziehen, werden aus dem Wasser gehoben (abgetrennt), neu positioniert (wieder eingeklinkt) und dann wieder eingetaucht, um zu ziehen (Abbildung 4). Jeder Zyklus erfordert Energie, und die Aktion der Myosinköpfe in den Sarkomeren, die wiederholt an den dünnen Filamenten ziehen, erfordert ebenfalls Energie, die durch ATP bereitgestellt wird.
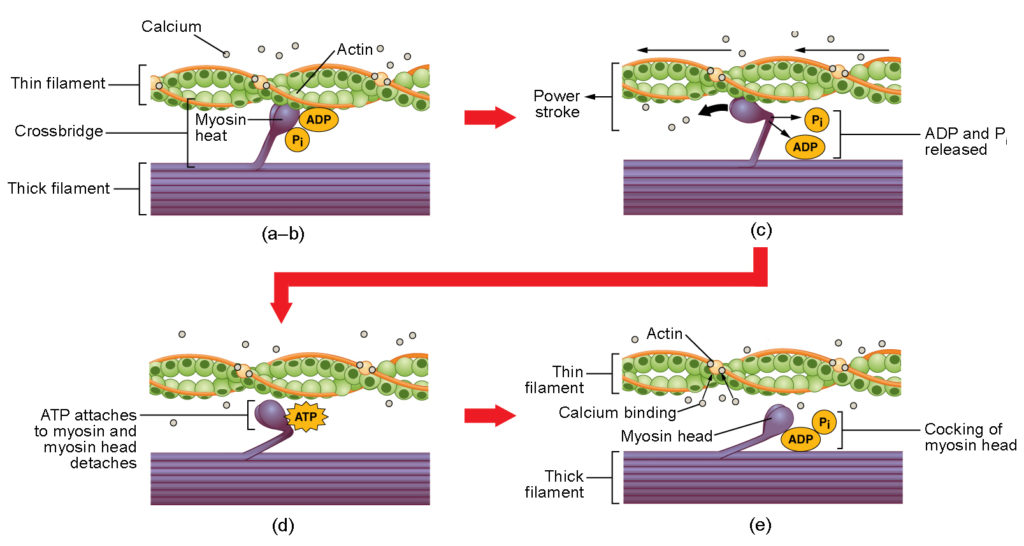
Abbildung 4. Skelettmuskelkontraktion. (a) Die aktive Stelle am Aktin wird durch die Bindung von Kalzium an Troponin freigelegt. (b) Der Myosinkopf wird vom Aktin angezogen, und das Myosin bindet das Aktin an seiner Aktin-Bindungsstelle und bildet die Querbrücke. (c) Während des Kraftstoßes wird das im vorherigen Kontraktionszyklus erzeugte Phosphat freigesetzt. Dies führt dazu, dass sich der Myosinkopf zur Mitte des Sarkomers hin dreht, woraufhin das gebundene ADP und die Phosphatgruppe freigesetzt werden. (d) Ein neues ATP-Molekül bindet sich an den Myosinkopf, wodurch sich die Querbrücke ablöst. (e) Der Myosinkopf hydrolysiert ATP zu ADP und Phosphat, wodurch das Myosin in die gespannte Position zurückkehrt.
Die Bildung der Querbrücke erfolgt, wenn sich der Myosinkopf an das Aktin anlagert, während Adenosindiphosphat (ADP) und anorganisches Phosphat (Pi) noch an Myosin gebunden sind (Abbildung 4a,b). Anschließend wird Pi freigesetzt, wodurch das Myosin eine stärkere Bindung an das Aktin eingeht, woraufhin sich der Myosinkopf in Richtung der M-Linie bewegt und das Aktin mit sich zieht. Während das Aktin gezogen wird, bewegen sich die Filamente etwa 10 nm in Richtung der M-Linie. Diese Bewegung wird als Power Stroke bezeichnet, da die Bewegung des dünnen Filaments in diesem Schritt erfolgt (Abbildung 4c). In Abwesenheit von ATP löst sich der Myosinkopf nicht vom Aktin.
Ein Teil des Myosinkopfes haftet an der Bindungsstelle auf dem Aktin, aber der Kopf hat eine weitere Bindungsstelle für ATP. Die ATP-Bindung führt dazu, dass sich der Myosinkopf vom Aktin ablöst (Abbildung 4d). Danach wird ATP durch die intrinsische ATPase-Aktivität des Myosins in ADP und Pi umgewandelt. Die bei der ATP-Hydrolyse freigesetzte Energie verändert den Winkel des Myosinkopfes in eine gekrümmte Position (Abbildung 4e). Der Myosinkopf befindet sich nun in einer Position, in der er sich weiter bewegen kann.
Wenn der Myosinkopf geneigt ist, befindet sich Myosin in einer energiereichen Konfiguration. Diese Energie wird verbraucht, während sich der Myosinkopf durch den Krafthub bewegt, und am Ende des Krafthubs befindet sich der Myosinkopf in einer energiearmen Position. Nach dem Krafthub wird ADP freigesetzt; die gebildete Querbrücke ist jedoch noch vorhanden, und Aktin und Myosin sind aneinander gebunden. Solange ATP verfügbar ist, kann es sich leicht an Myosin anlagern, der Kreuzbrückenzyklus kann sich wiederholen, und die Muskelkontraktion kann fortgesetzt werden.
Beachten Sie, dass jedes dicke Filament aus etwa 300 Myosinmolekülen mehrere Myosinköpfe hat, und dass sich während der Muskelkontraktion ständig viele Kreuzbrücken bilden und brechen. Multipliziert man dies mit allen Sarkomeren in einer Myofibrille, allen Myofibrillen in einer Muskelfaser und allen Muskelfasern in einem Skelettmuskel, wird verständlich, warum so viel Energie (ATP) benötigt wird, um die Skelettmuskeln am Laufen zu halten. Tatsächlich ist es der ATP-Verlust, der zu der Totenstarre führt, die kurz nach dem Tod eines Menschen zu beobachten ist. Da keine weitere ATP-Produktion möglich ist, steht kein ATP zur Verfügung, damit sich die Myosinköpfe von den Aktinbindungsstellen lösen können, so dass die Querbrücken an Ort und Stelle bleiben und die Steifheit der Skelettmuskeln verursachen.
Quellen von ATP
ATP liefert die Energie für die Muskelkontraktion. Neben seiner direkten Rolle im Kreuzbrückenzyklus liefert ATP auch die Energie für die Ca++-Pumpen mit aktivem Transport im SR. Die Muskelkontraktion kann ohne ausreichende Mengen an ATP nicht stattfinden. Die im Muskel gespeicherte ATP-Menge ist sehr gering und reicht nur aus, um Kontraktionen im Umfang von einigen Sekunden durchzuführen. Da es abgebaut wird, muss ATP daher schnell regeneriert und ersetzt werden, um eine anhaltende Kontraktion zu ermöglichen. Es gibt drei Mechanismen, mit denen ATP regeneriert werden kann: Kreatinphosphat-Stoffwechsel, anaerobe Glykolyse, Fermentation und aerobe Atmung.
Kreatinphosphat ist ein Molekül, das Energie in seinen Phosphatbindungen speichern kann. In einem ruhenden Muskel überträgt überschüssiges ATP seine Energie auf Kreatin, wobei ADP und Kreatinphosphat entstehen. Dies dient als Energiereserve, aus der schnell mehr ATP erzeugt werden kann. Wenn der Muskel zu kontrahieren beginnt und Energie benötigt, überträgt Kreatinphosphat sein Phosphat zurück auf ADP und bildet ATP und Kreatin. Diese Reaktion wird durch das Enzym Kreatinkinase katalysiert und läuft sehr schnell ab, so dass das aus Kreatinphosphat gewonnene ATP die ersten Sekunden der Muskelkontraktion versorgt. Kreatinphosphat kann jedoch nur etwa 15 Sekunden lang Energie liefern, dann muss eine andere Energiequelle genutzt werden (Abbildung 5).

Abbildung 5. Muskelstoffwechsel. In einem ruhenden Muskel wird ein Teil des ATP gespeichert. Wenn die Kontraktion beginnt, wird es in Sekundenschnelle verbraucht. Etwa 15 Sekunden lang wird mehr ATP aus Kreatinphosphat erzeugt.
Wenn das durch Kreatinphosphat erzeugte ATP erschöpft ist, wenden sich die Muskeln der Glykolyse als ATP-Quelle zu. Die Glykolyse ist ein anaerober (nicht sauerstoffabhängiger) Prozess, bei dem Glukose (Zucker) abgebaut wird, um ATP zu erzeugen; die Glykolyse kann jedoch nicht so schnell ATP erzeugen wie Kreatinphosphat. Die Umstellung auf Glykolyse führt daher zu einer langsameren ATP-Verfügbarkeit für den Muskel. Der in der Glykolyse verwendete Zucker kann durch Blutzucker oder durch den Abbau von im Muskel gespeichertem Glykogen bereitgestellt werden. Beim Abbau eines Glukosemoleküls entstehen zwei ATP und zwei Moleküle Brenztraubensäure, die in der aeroben Atmung verwendet oder bei niedrigem Sauerstoffgehalt in Milchsäure umgewandelt werden können (Abbildung 6).

Abbildung 6. Glykolyse und aerobe Atmung. Jedes Glukosemolekül erzeugt zwei ATP und zwei Moleküle Brenztraubensäure, die in der aeroben Atmung verwendet oder in Milchsäure umgewandelt werden können. Wenn kein Sauerstoff zur Verfügung steht, wird die Brenztraubensäure in Milchsäure umgewandelt, die zur Muskelermüdung beitragen kann. Dies geschieht bei anstrengender körperlicher Betätigung, wenn hohe Energiemengen benötigt werden, aber der Sauerstoff nicht in ausreichendem Maße an die Muskeln abgegeben werden kann.
Wenn Sauerstoff verfügbar ist, wird Brenztraubensäure in der aeroben Atmung verwendet. Ist jedoch kein Sauerstoff verfügbar, wird Brenztraubensäure in Milchsäure umgewandelt, die zur Muskelermüdung beitragen kann. Diese Umwandlung ermöglicht das Recycling des Enzyms NAD+ aus NADH, das für die Fortsetzung der Glykolyse erforderlich ist. Dies geschieht bei anstrengender körperlicher Betätigung, wenn große Mengen an Energie benötigt werden, die Muskeln aber nicht ausreichend mit Sauerstoff versorgt werden können. Die Glykolyse selbst kann nicht sehr lange aufrechterhalten werden (ca. 1 Minute Muskelaktivität), aber sie ist nützlich, um kurze Leistungsschübe mit hoher Intensität zu ermöglichen. Das liegt daran, dass die Glykolyse die Glukose nicht sehr effizient verwertet und einen Nettogewinn von zwei ATP pro Glukosemolekül und das Endprodukt Milchsäure erzeugt, die zur Muskelermüdung beitragen kann, wenn sie sich ansammelt.
Aerobische Atmung ist der Abbau von Glukose oder anderen Nährstoffen in Gegenwart von Sauerstoff (O2), um Kohlendioxid, Wasser und ATP zu erzeugen. Etwa 95 Prozent des ATP, das für ruhende oder mäßig aktive Muskeln benötigt wird, wird durch aerobe Atmung bereitgestellt, die in den Mitochondrien stattfindet. Zu den Ausgangsstoffen für die aerobe Atmung gehören die im Blutkreislauf zirkulierende Glukose, Brenztraubensäure und Fettsäuren. Die aerobe Atmung ist wesentlich effizienter als die anaerobe Glykolyse, da sie etwa 36 ATPs pro Glukosemolekül erzeugt, im Gegensatz zu vier bei der Glykolyse. Die aerobe Atmung kann jedoch ohne eine ständige O2-Versorgung des Skelettmuskels nicht aufrechterhalten werden und ist viel langsamer (Abbildung 7). Um dies zu kompensieren, speichern die Muskeln kleine Mengen überschüssigen Sauerstoffs in Proteinen, die als Myoglobin bezeichnet werden, was effizientere Muskelkontraktionen und geringere Ermüdung ermöglicht. Aerobes Training erhöht auch die Effizienz des Kreislaufsystems, so dass die Muskeln länger mit O2 versorgt werden können.

Abbildung 7. Zelluläre Atmung. Aerobe Atmung ist der Abbau von Glukose in Gegenwart von Sauerstoff (O2), um Kohlendioxid, Wasser und ATP zu erzeugen. Ungefähr 95 Prozent des ATP, das für ruhende oder mäßig aktive Muskeln benötigt wird, wird durch aerobe Atmung bereitgestellt, die in den Mitochondrien stattfindet.
Muskelermüdung tritt auf, wenn ein Muskel sich nicht mehr als Reaktion auf Signale des Nervensystems zusammenziehen kann. Die genauen Ursachen der Muskelermüdung sind nicht vollständig bekannt, obwohl bestimmte Faktoren mit der verminderten Muskelkontraktion, die während der Ermüdung auftritt, in Verbindung gebracht wurden. ATP wird für eine normale Muskelkontraktion benötigt, und wenn die ATP-Reserven abnehmen, kann die Muskelfunktion nachlassen. Dies kann eher bei kurzen, intensiven Muskelleistungen der Fall sein als bei anhaltenden, weniger intensiven Anstrengungen. Die Ansammlung von Milchsäure kann den intrazellulären pH-Wert senken, was die Enzym- und Proteinaktivität beeinträchtigt. Ein Ungleichgewicht der Na+- und K+-Spiegel als Folge der Membrandepolarisation kann den Ca++-Abfluss aus dem SR stören. Lang anhaltende körperliche Betätigung kann den SR und das Sarkolemm schädigen, was zu einer gestörten Ca++-Regulierung führt.
Intensive Muskelaktivität führt zu einer Sauerstoffschuld, d. h. zu der Menge an Sauerstoff, die benötigt wird, um das während der Muskelkontraktion ohne Sauerstoff produzierte ATP zu kompensieren. Sauerstoff wird benötigt, um den ATP- und Kreatinphosphatspiegel wiederherzustellen, Milchsäure in Brenztraubensäure umzuwandeln und in der Leber Milchsäure in Glukose oder Glykogen umzuwandeln. Auch andere Systeme, die während des Trainings genutzt werden, benötigen Sauerstoff, und alle diese Prozesse zusammen führen zu der erhöhten Atemfrequenz, die nach dem Training auftritt. Bis die Sauerstoffschuld beglichen ist, ist die Sauerstoffaufnahme erhöht, auch nachdem die Übung beendet wurde.
Entspannung eines Skelettmuskels
Die Entspannung der Skelettmuskelfasern und schließlich des Skelettmuskels beginnt mit dem Motoneuron, das aufhört, sein chemisches Signal, ACh, in die Synapse am NMJ freizusetzen. Die Muskelfaser repolarisiert sich, wodurch die Tore im SR, in denen Ca++ freigesetzt wurde, geschlossen werden. ATP-getriebene Pumpen befördern Ca++ aus dem Sarkoplasma zurück in den SR. Dies führt dazu, dass die Aktin-Bindungsstellen an den dünnen Filamenten „wieder abgeschirmt“ werden. Ohne die Fähigkeit, Querbrücken zwischen den dünnen und dicken Filamenten zu bilden, verliert die Muskelfaser ihre Spannung und entspannt sich.
Muskelkraft
Die Anzahl der Skelettmuskelfasern in einem bestimmten Muskel ist genetisch festgelegt und ändert sich nicht. Die Muskelkraft steht in direktem Zusammenhang mit der Anzahl der Myofibrillen und Sarkomere in jeder Faser. Faktoren wie Hormone und Stress (und künstliche anabole Steroide), die auf den Muskel einwirken, können die Produktion von Sarkomeren und Myofibrillen in den Muskelfasern erhöhen, eine Veränderung, die als Hypertrophie bezeichnet wird und zu einer Zunahme von Masse und Volumen eines Skelettmuskels führt. Umgekehrt führt eine geringere Beanspruchung eines Skelettmuskels zu einer Atrophie, bei der die Anzahl der Sarkomere und Myofibrillen schwindet (nicht aber die Anzahl der Muskelfasern). Es ist üblich, dass eine Gliedmaße in einem Gipsverband atrophierte Muskeln aufweist, wenn der Gips abgenommen wird, und bei bestimmten Krankheiten, wie z. B. Kinderlähmung, treten atrophierte Muskeln auf.
Störungen des Muskelsystems
Duchenne-Muskeldystrophie (DMD) ist eine fortschreitende Schwächung der Skelettmuskeln. Sie ist eine von mehreren Krankheiten, die unter dem Begriff „Muskeldystrophie“ zusammengefasst werden. DMD wird durch einen Mangel an dem Protein Dystrophin verursacht, das den dünnen Filamenten der Myofibrillen hilft, sich an das Sarkolemma zu binden. Ohne ausreichendes Dystrophin reißt bei Muskelkontraktionen das Sarkolemm ein, was zu einem Einstrom von Ca++ und damit zu Zellschäden und zum Abbau der Muskelfasern führt. Im Laufe der Zeit, wenn sich die Muskelschäden häufen, geht Muskelmasse verloren, und es kommt zu größeren Funktionseinschränkungen.
DMD ist eine Erbkrankheit, die durch ein abnormales X-Chromosom verursacht wird. Sie betrifft hauptsächlich Männer und wird in der Regel in der frühen Kindheit diagnostiziert. DMD äußert sich in der Regel zunächst in Form von Gleichgewichts- und Bewegungsproblemen und geht dann in eine Gehunfähigkeit über. Die Krankheit schreitet im Körper von den unteren Extremitäten bis zum Oberkörper fort, wo sie die für die Atmung und den Kreislauf zuständigen Muskeln beeinträchtigt. Sie führt schließlich zum Tod durch Atemversagen, und die Betroffenen werden in der Regel nicht älter als 20 Jahre.
Da DMD durch eine Mutation in dem Gen verursacht wird, das für Dystrophin kodiert, dachte man, dass die Einführung gesunder Myoblasten in die Patienten eine wirksame Behandlung sein könnte. Myoblasten sind die embryonalen Zellen, die für die Muskelentwicklung verantwortlich sind, und im Idealfall würden sie gesunde Gene tragen, die das für eine normale Muskelkontraktion benötigte Dystrophin produzieren können. Dieser Ansatz ist beim Menschen weitgehend erfolglos geblieben. Ein neuerer Ansatz besteht darin, die Produktion von Utrophin im Muskel anzukurbeln, einem dem Dystrophin ähnlichen Protein, das die Rolle des Dystrophins übernehmen und Zellschäden verhindern könnte.
Selbsttestfragen
Machen Sie das folgende Quiz, um zu überprüfen, ob Sie Muskelfaserkontraktion und -entspannung verstanden haben:
