A: AMINOSÄUREN
BIOCHEMISTRIE – DR. JAKUBOWSKI
Letztes Update: 27.02.16
Lernziele/Zielsetzungen für Kapitel 2A: Nach dem Unterricht und dieser Lektüre sind die Schüler in der Lage
- die Ladung von Aminosäureseitenketten mit Hilfe der Henderson-Hasselbach-Gleichung und der ungefähren Ladung bei einem gegebenen pH-Wert anzugeben
- die Mechanismen für die Reaktion der nukleophilen Seitenketten Lys und Cys mit gängigen chemischen Modifizierungsmitteln zu zeichnen und die Produkte zu identifizieren und dieses Verständnis auf Reaktionen von His auszuweiten.
- Zeichnen Sie Mechanismen für Disulfidaustauschreaktionen für Sulfhydrylate und verwenden Sie diese und Oxidationszahlen, um Redoxreaktionen von Cystein/Cystin zu erklären.
A7. Cystinchemie
Zwei Cysteinseitenketten können in einem Protein kovalent interagieren und ein Disulfid bilden. So wie HOOH (Wasserstoffperoxid) stärker oxidiert ist als HOH (O in H2O2 hat die Oxidationszahl 1-, während das O in H2O eine Oxidationszahl von 2- hat), ist RSSR die oxidierte Form (S Oxidationszahl 1-) und RSH die reduzierte Form (S Oxidationszahl 2-) der Thiole. Die Oxidationszahlen sind analog, da O und S beide zur Gruppe 6 des Periodensystems gehören und beide elektronegativer sind als C.
Ein kurzer Überblick über Redoxreaktionen und Oxidationszahlen.
Abbildung: DISULFID – CYSTINE – REAKTIONEN
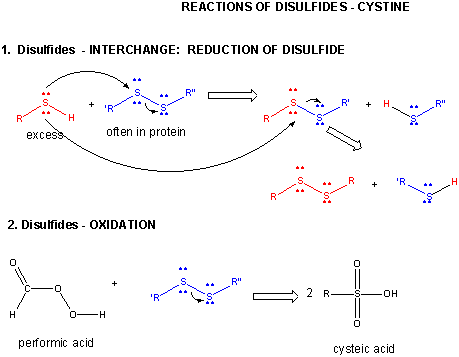
Wenn sich ein Protein faltet, können sich zwei Cys-Seitenketten einander nähern und eine Disulfidbindung innerhalb der Kette bilden. Ebenso können sich zwei Cys-Seitenketten auf getrennten Proteinen einander nähern und ein Interketten-Disulfid bilden. Solche Disulfide müssen gespalten und die Ketten getrennt werden, bevor die Sequenz des Proteins analysiert werden kann. Das Disulfid im Protein kann durch Reduktionsmittel wie beta-Mercaptoethanol, Dithiothreitol, Tris-(2-carboxyethyl)-phosphin (TCEP) oder Oxidationsmittel gespalten werden, die das Disulfid weiter oxidieren, um die Zystensäuren zu trennen.
Abbildung: Disulfid-Oxidationsmittel – b-Mercaptoethanol, Dithiothreitol und Phosphine
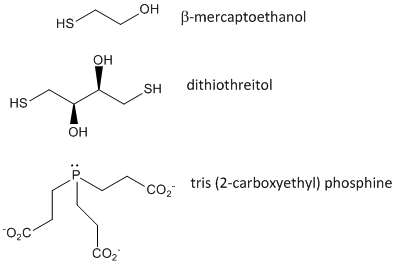
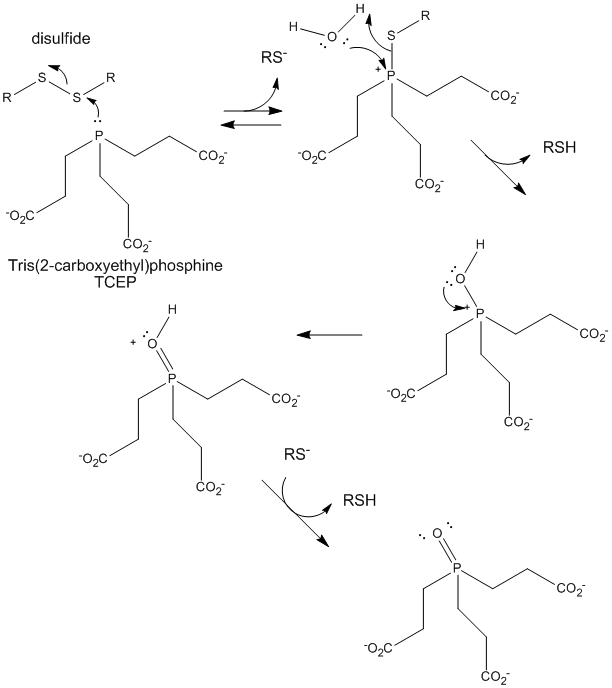
Abbildung: TCEP-Reduktion von Disulfiden
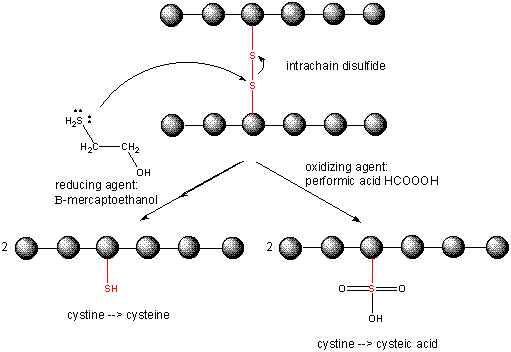
Das Innere der Zellen wird durch das Vorhandensein vieler „reduzierender“ Stoffe, wie dem Tripeptid g-glu-cys-gly (Glutathion), in einer reduzierten Umgebung gehalten. Daher enthalten intrazelluläre Proteine in der Regel keine Disulfide, die in extrazellulären Proteinen (z. B. im Blut) oder in bestimmten Organellen wie dem endoplasmatischen Retikulum und dem mitochondrialen Intermembranraum reichlich vorhanden sind, wo Disulfidec eingeführt werden können.
Abbildung:
Spaltung von Disulfidbindungen in Proteinen
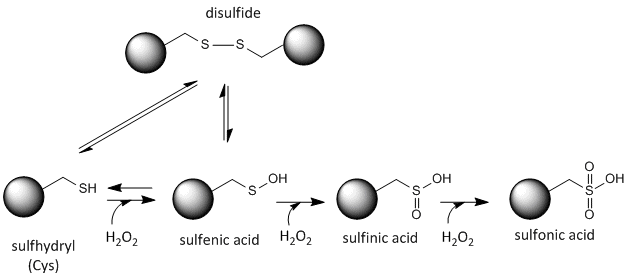
Cystein-Redox-Chemie
Der Schwefel in Cystein ist redox-aktiv und kann daher in einer Vielzahl von Zuständen vorliegen, die von der lokalen Redox-Umgebung und dem Vorhandensein von Oxidations- und Reduktionsmitteln abhängen. Ein starkes Oxidationsmittel, das in Zellen hergestellt werden kann, ist Wasserstoffperoxid, das zu drastischeren und irreversiblen chemischen Veränderungen an den Cys-Seitenketten führen kann. Wenn ein reaktives Cys für die Proteinfunktion wichtig ist, kann die Funktion des Proteins (manchmal reversibel, manchmal irreversibel) mit verschiedenen Oxidationsmitteln moduliert werden, wie in der folgenden Abbildung dargestellt.
Abbildung:Redox-Zustand von Cystein
Navigation
Zurück zuKapitel 2A: Aminosäureabschnitte
Zurück zuBiochemie Online-Inhaltsverzeichnis
Archivierte Version des vollständigenKapitels 2A: Aminosäuren
