LERNZIELE
- Beschreiben Sie die Energie von kovalenten und ionischen Bindungen Bildung und Bruch von kovalenten und ionischen Bindungen
- Verwenden Sie die durchschnittlichen Energien kovalenter Bindungen, um die Reaktionsenthalpien zu schätzen
Die Stärke einer Bindung beschreibt, wie stark jedes Atom mit einem anderen Atom verbunden ist, und wie viel Energie daher erforderlich ist, um die Bindung zwischen den beiden Atomen zu brechen.
Es ist wichtig, sich daran zu erinnern, dass Energie zugeführt werden muss, um chemische Bindungen zu brechen (ein endothermer Prozess), während die Bildung chemischer Bindungen Energie freisetzt (ein exothermer Prozess). Im Fall von ![]() ist die kovalente Bindung sehr stark; eine große Menge an Energie, 436 kJ, muss zugeführt werden, um die Bindungen in einem Mol Wasserstoffmoleküle zu brechen und die Atome zu trennen:
ist die kovalente Bindung sehr stark; eine große Menge an Energie, 436 kJ, muss zugeführt werden, um die Bindungen in einem Mol Wasserstoffmoleküle zu brechen und die Atome zu trennen:
![]()
Umgekehrt wird die gleiche Energiemenge freigesetzt, wenn sich aus zwei Molen H-Atomen ein Mol ![]() Moleküle bilden:
Moleküle bilden:
![]()
Bindungsstärke: Kovalente Bindungen
Stabile Moleküle existieren, weil kovalente Bindungen die Atome zusammenhalten. Die Stärke einer kovalenten Bindung wird anhand der Energie gemessen, die erforderlich ist, um sie zu brechen, d. h. die Energie, die erforderlich ist, um die gebundenen Atome zu trennen. Jedes Paar gebundener Atome zu trennen, erfordert Energie. Je stärker eine Bindung ist, desto mehr Energie ist erforderlich, um sie zu brechen.
Die Energie, die erforderlich ist, um eine bestimmte kovalente Bindung in einem Mol gasförmiger Moleküle zu brechen, wird Bindungsenergie oder Bindungsdissoziationsenergie genannt. Die Bindungsenergie für ein zweiatomiges Molekül, ![]() , ist definiert als die Standard-Enthalpieänderung für die endotherme Reaktion:
, ist definiert als die Standard-Enthalpieänderung für die endotherme Reaktion:
![]()
Zum Beispiel ist die Bindungsenergie der reinen kovalenten H-H-Bindung, ![]() , 436 kJ pro Mol der gebrochenen H-H-Bindungen:
, 436 kJ pro Mol der gebrochenen H-H-Bindungen:
![]()
Moleküle mit drei oder mehr Atomen haben zwei oder mehr Bindungen. Die Summe aller Bindungsenergien in einem solchen Molekül ist gleich der Standard-Enthalpieänderung für die endotherme Reaktion, die alle Bindungen im Molekül bricht. Zum Beispiel ist die Summe der vier C-H-Bindungsenergien in ![]() , 1660 kJ, gleich der Standard-Enthalpieänderung der Reaktion:
, 1660 kJ, gleich der Standard-Enthalpieänderung der Reaktion:

Die durchschnittliche C-H-Bindungsenergie, ![]() , beträgt 1660/4 = 415 kJ/mol, da pro Mol der Reaktion vier Mol C-H-Bindungen gebrochen werden. Obwohl die vier C-H-Bindungen im ursprünglichen Molekül äquivalent sind, benötigen sie nicht alle die gleiche Energie zum Brechen; sobald die erste Bindung gebrochen ist (wofür 439 kJ/mol erforderlich sind), sind die übrigen Bindungen leichter zu brechen. Der Wert von 415 kJ/mol ist ein Durchschnittswert, nicht der genaue Wert, der zum Brechen einer Bindung erforderlich ist.
, beträgt 1660/4 = 415 kJ/mol, da pro Mol der Reaktion vier Mol C-H-Bindungen gebrochen werden. Obwohl die vier C-H-Bindungen im ursprünglichen Molekül äquivalent sind, benötigen sie nicht alle die gleiche Energie zum Brechen; sobald die erste Bindung gebrochen ist (wofür 439 kJ/mol erforderlich sind), sind die übrigen Bindungen leichter zu brechen. Der Wert von 415 kJ/mol ist ein Durchschnittswert, nicht der genaue Wert, der zum Brechen einer Bindung erforderlich ist.
Die Stärke einer Bindung zwischen zwei Atomen nimmt mit der Anzahl der Elektronenpaare in der Bindung zu. Mit zunehmender Bindungsstärke nimmt im Allgemeinen die Bindungslänge ab. So sind Dreifachbindungen stärker und kürzer als Doppelbindungen zwischen denselben beiden Atomen; ebenso sind Doppelbindungen stärker und kürzer als Einfachbindungen zwischen denselben beiden Atomen. In der folgenden Tabelle sind die durchschnittlichen Bindungsenergien für einige häufige Bindungen aufgeführt, und die folgende Tabelle enthält einen Vergleich der Bindungslängen und Bindungsstärken für einige häufige Bindungen. Wenn sich ein Atom an verschiedene Atome in einer Gruppe bindet, nimmt die Bindungsstärke in der Regel ab, je weiter man sich in der Gruppe nach unten bewegt. Zum Beispiel: ![]() ist 439 kJ/mol,
ist 439 kJ/mol, ![]() liegt bei 330 kJ/mol, und
liegt bei 330 kJ/mol, und ![]() liegt bei 275 kJ/mol.
liegt bei 275 kJ/mol.
| Bindungsenergie (kJ/mol) | |||||||
|---|---|---|---|---|---|---|---|
| Bindung | Bindungsenergie | Bindung | Bindungsenergie | Bindung | Bindungsenergie | ||
| 436 | 260 | 255 | |||||
| 415 | 330 | 235 | |||||
| 390 | 275 | 230 | |||||
| 464 | 240 | 215 | |||||
| 569 | 160 | 225 | |||||
| 395 | 418 | 359 | |||||
| 320 | 946 | 290 | |||||
| 340 | 200 | 215 | |||||
| 432 | 270 | 215 | |||||
| 370 | 210 | 230 | |||||
| 295 | 200 | 330 | |||||
| 345 | 245 | 270 | |||||
| 611 | 140 | 215 | |||||
| 837 | 498 | 215 | |||||
| 290 | 160 | 250 | |||||
| 615 | 370 | 215 | |||||
| 891 | 350 | 243 | |||||
| 350 | 205 | 220 | |||||
| 741 | 200 | 210 | |||||
| 1080 | 160 | 190 | |||||
| 439 | 540 | 180 | |||||
| 360 | 489 | 150 | |||||
| 265 | 285 | ||||||
| Durchschnittliche Bindungslängen und Bindungsenergien für einige Häufige Bindungen | ||
|---|---|---|
| Bindung | Bindungslänge (Å) | Bindungsenergie (kJ/mol) |
| 1,54 | 345 | |
| 1,34 | 611 | |
| 1,20 | 837 | |
| 1.43 | 290 | |
| 1.38 | 615 | |
| 1,16 | 891 | |
| 1.43 | 350 | |
| 1,23 | 741 | |
| 1,13 | 1080 | |
Die Bindungsenergie ist die Differenz zwischen dem Energieminimum (das im Bindungsabstand auftritt) und der Energie der beiden getrennten Atome. Dies ist die Menge an Energie, die bei der Bildung der Bindung freigesetzt wird. Umgekehrt wird die gleiche Energiemenge benötigt, um die Bindung zu brechen. Für das in der obigen Tabelle dargestellte ![]() Molekül hat das System bei einem Bindungsabstand von 74 pm eine um 7,24 × 10-19 J geringere Energie als die beiden getrennten Wasserstoffatome. Dies mag wie eine kleine Zahl erscheinen. Wie wir jedoch später noch genauer erfahren werden, werden Bindungsenergien oft auf einer Pro-Mol-Basis diskutiert. So benötigt man beispielsweise 7,24 × 10-19 J, um eine H-H-Bindung zu brechen, aber 4,36 × 105 J, um 1 Mol H-H-Bindungen zu brechen. Ein Vergleich einiger Bindungslängen und -energien ist in den obigen Tabellen dargestellt. Viele dieser Bindungen sind in einer Vielzahl von Molekülen zu finden, und diese Tabelle enthält Durchschnittswerte. Zum Beispiel erfordert das Brechen der ersten C-H-Bindung in
Molekül hat das System bei einem Bindungsabstand von 74 pm eine um 7,24 × 10-19 J geringere Energie als die beiden getrennten Wasserstoffatome. Dies mag wie eine kleine Zahl erscheinen. Wie wir jedoch später noch genauer erfahren werden, werden Bindungsenergien oft auf einer Pro-Mol-Basis diskutiert. So benötigt man beispielsweise 7,24 × 10-19 J, um eine H-H-Bindung zu brechen, aber 4,36 × 105 J, um 1 Mol H-H-Bindungen zu brechen. Ein Vergleich einiger Bindungslängen und -energien ist in den obigen Tabellen dargestellt. Viele dieser Bindungen sind in einer Vielzahl von Molekülen zu finden, und diese Tabelle enthält Durchschnittswerte. Zum Beispiel erfordert das Brechen der ersten C-H-Bindung in ![]() 439,3 kJ/mol, während das Brechen der ersten C-H-Bindung in
439,3 kJ/mol, während das Brechen der ersten C-H-Bindung in ![]() (ein üblicher Farbverdünner) 375.5 kJ/mol.
(ein üblicher Farbverdünner) 375.5 kJ/mol.
Wie aus den obigen Tabellen ersichtlich, beträgt eine durchschnittliche Kohlenstoff-Kohlenstoff-Einfachbindung 347 kJ/mol, während bei einer Kohlenstoff-Kohlenstoff-Doppelbindung die ![]() -Bindung die Bindungsstärke um 267 kJ/mol erhöht. Die Hinzufügung einer zusätzlichen
-Bindung die Bindungsstärke um 267 kJ/mol erhöht. Die Hinzufügung einer zusätzlichen ![]() -Bindung bewirkt einen weiteren Anstieg um 225 kJ/mol. Ein ähnliches Muster ist zu erkennen, wenn wir andere
-Bindung bewirkt einen weiteren Anstieg um 225 kJ/mol. Ein ähnliches Muster ist zu erkennen, wenn wir andere ![]() – und
– und ![]() -Bindungen vergleichen. So ist jede einzelne
-Bindungen vergleichen. So ist jede einzelne ![]() -Bindung im Allgemeinen schwächer als eine entsprechende
-Bindung im Allgemeinen schwächer als eine entsprechende ![]() -Bindung zwischen denselben beiden Atomen. Bei einer
-Bindung zwischen denselben beiden Atomen. Bei einer ![]() -Bindung gibt es ein größeres Maß an Orbitalüberlappung als bei einer
-Bindung gibt es ein größeres Maß an Orbitalüberlappung als bei einer ![]() -Bindung.
-Bindung.
Wir können Bindungsenergien verwenden, um ungefähre Enthalpieänderungen für Reaktionen zu berechnen, für die keine Bildungsenthalpien verfügbar sind. Durch solche Berechnungen lässt sich auch feststellen, ob eine Reaktion exotherm oder endotherm ist. Eine exotherme Reaktion (ΔH negativ, erzeugte Wärme) liegt vor, wenn die Bindungen in den Produkten stärker sind als die Bindungen in den Reaktanten. Eine endotherme Reaktion (ΔH positiv, aufgenommene Wärme) entsteht, wenn die Bindungen in den Produkten schwächer sind als die in den Reaktanden.
Die Enthalpieänderung ΔH für eine chemische Reaktion ist ungefähr gleich der Summe der Energie, die zum Aufbrechen aller Bindungen in den Reaktanden erforderlich ist (Energie „in“, positives Vorzeichen) plus der Energie, die freigesetzt wird, wenn alle Bindungen in den Produkten gebildet werden (Energie „out“, negatives Vorzeichen). Dies kann mathematisch folgendermaßen ausgedrückt werden:
![]()
In diesem Ausdruck bedeutet das Symbol ![]() „die Summe von“ und D steht für die Bindungsenergie in Kilojoule pro Mol, die immer eine positive Zahl ist. Die Bindungsenergie wird aus einer Tabelle entnommen und hängt davon ab, ob es sich bei der jeweiligen Bindung um eine Einfach-, Doppel- oder Dreifachbindung handelt. Bei der Berechnung von Enthalpien auf diese Weise ist es daher wichtig, dass wir die Bindungen in allen Reaktanten und Produkten berücksichtigen. Da es sich bei den D-Werten in der Regel um Durchschnittswerte für einen Bindungstyp in vielen verschiedenen Molekülen handelt, liefert diese Berechnung eine grobe Schätzung und keinen genauen Wert für die Reaktionsenthalpie.
„die Summe von“ und D steht für die Bindungsenergie in Kilojoule pro Mol, die immer eine positive Zahl ist. Die Bindungsenergie wird aus einer Tabelle entnommen und hängt davon ab, ob es sich bei der jeweiligen Bindung um eine Einfach-, Doppel- oder Dreifachbindung handelt. Bei der Berechnung von Enthalpien auf diese Weise ist es daher wichtig, dass wir die Bindungen in allen Reaktanten und Produkten berücksichtigen. Da es sich bei den D-Werten in der Regel um Durchschnittswerte für einen Bindungstyp in vielen verschiedenen Molekülen handelt, liefert diese Berechnung eine grobe Schätzung und keinen genauen Wert für die Reaktionsenthalpie.
Betrachten Sie die folgende Reaktion:
![]()
oder
![]()
Zur Bildung von zwei Molen ![]() zu bilden, müssen ein Mol H-H-Bindungen und ein Mol Cl-Cl-Bindungen gebrochen werden. Die zum Brechen dieser Bindungen erforderliche Energie ist die Summe der Bindungsenergie der H-H-Bindung (436 kJ/mol) und der Cl-Cl-Bindung (243 kJ/mol). Während der Reaktion werden zwei Mole von H-Cl-Bindungen gebildet (Bindungsenergie = 432 kJ/mol), wodurch 2 × 432 kJ oder 864 kJ freigesetzt werden. Da die Bindungen in den Produkten stärker sind als die in den Reaktanden, setzt die Reaktion mehr Energie frei als sie verbraucht:
zu bilden, müssen ein Mol H-H-Bindungen und ein Mol Cl-Cl-Bindungen gebrochen werden. Die zum Brechen dieser Bindungen erforderliche Energie ist die Summe der Bindungsenergie der H-H-Bindung (436 kJ/mol) und der Cl-Cl-Bindung (243 kJ/mol). Während der Reaktion werden zwei Mole von H-Cl-Bindungen gebildet (Bindungsenergie = 432 kJ/mol), wodurch 2 × 432 kJ oder 864 kJ freigesetzt werden. Da die Bindungen in den Produkten stärker sind als die in den Reaktanden, setzt die Reaktion mehr Energie frei als sie verbraucht:
Diese überschüssige Energie wird als Wärme freigesetzt, so dass die Reaktion exotherm ist. Anhang G enthält einen Wert für die molare Standardbildungsenthalpie von ![]() ,
, ![]() , von -92,307 kJ/mol. Das Doppelte dieses Wertes ist -184,6 kJ, was gut mit der zuvor erhaltenen Antwort für die Bildung von zwei Molen HCl übereinstimmt.
, von -92,307 kJ/mol. Das Doppelte dieses Wertes ist -184,6 kJ, was gut mit der zuvor erhaltenen Antwort für die Bildung von zwei Molen HCl übereinstimmt.
BEISPIEL
Using Bond Energies to Calculate Approximate Enthalpy Changes
Methanol, ![]() , kann ein hervorragender alternativer Kraftstoff sein. Bei der Hochtemperaturreaktion von Wasserdampf und Kohlenstoff entsteht ein Gemisch aus den Gasen Kohlenmonoxid,
, kann ein hervorragender alternativer Kraftstoff sein. Bei der Hochtemperaturreaktion von Wasserdampf und Kohlenstoff entsteht ein Gemisch aus den Gasen Kohlenmonoxid, ![]() , und Wasserstoff,
, und Wasserstoff, ![]() , aus dem Methanol hergestellt werden kann. Berechnen Sie anhand der Bindungsenergien in den obigen Tabellen die ungefähre Enthalpieänderung ΔH für diese Reaktion:
, aus dem Methanol hergestellt werden kann. Berechnen Sie anhand der Bindungsenergien in den obigen Tabellen die ungefähre Enthalpieänderung ΔH für diese Reaktion:
![]()
Lösung
Zunächst müssen wir die Lewis-Strukturen der Reaktanten und der Produkte schreiben:

Daraus geht hervor, dass ΔH für diese Reaktion die Energie umfasst, die zum Brechen einer C-O-Dreifachbindung und zweier H-H-Einfachbindungen erforderlich ist, sowie die Energie, die durch die Bildung von drei C-H-Einfachbindungen, einer C-O-Einfachbindung und einer O-H-Einfachbindung entsteht. Wir können dies wie folgt ausdrücken:
Unter Verwendung der Bindungsenergiewerte in der Tabelle, erhalten wir:
Wir können diesen Wert mit dem Wert vergleichen, der auf der Grundlage der ![]() -Daten aus Anhang G berechnet wurde:
-Daten aus Anhang G berechnet wurde:
Man beachte, dass zwischen den mit den beiden verschiedenen Methoden berechneten Werten eine ziemlich große Lücke besteht. Dies liegt daran, dass die D-Werte der Durchschnitt verschiedener Bindungsstärken sind und daher oft nur grob mit anderen Daten übereinstimmen.
Check Your Learning
Ethylalkohol, ![]() , war eine der ersten organischen Chemikalien, die von Menschen bewusst synthetisiert wurden. Er wird in der Industrie vielfach verwendet und ist der in alkoholischen Getränken enthaltene Alkohol. Er kann durch die Fermentation von Zucker gewonnen oder durch die Hydratation von Ethylen in der folgenden Reaktion synthetisiert werden:
, war eine der ersten organischen Chemikalien, die von Menschen bewusst synthetisiert wurden. Er wird in der Industrie vielfach verwendet und ist der in alkoholischen Getränken enthaltene Alkohol. Er kann durch die Fermentation von Zucker gewonnen oder durch die Hydratation von Ethylen in der folgenden Reaktion synthetisiert werden:

Berechnen Sie unter Verwendung der Bindungsenergien in der Tabelle die ungefähre Enthalpieänderung ΔH für diese Reaktion.
-35 kJ
Ionische Bindungsstärke und Gitterenergie
Eine ionische Verbindung ist aufgrund der elektrostatischen Anziehung zwischen ihren positiven und negativen Ionen stabil. Die Gitterenergie einer Verbindung ist ein Maß für die Stärke dieser Anziehung. Die Gitterenergie (ΔHlattice) einer ionischen Verbindung ist definiert als die Energie, die erforderlich ist, um ein Mol des Feststoffs in seine gasförmigen Ionen zu zerlegen. Für den ionischen Feststoff MX ist die Gitterenergie die Enthalpieänderung des Prozesses:
![]()
Beachten Sie, dass wir die Konvention verwenden, bei der der ionische Feststoff in Ionen zerlegt wird, so dass unsere Gitterenergien endotherm (positive Werte) sind. Einige Texte verwenden die gleiche, aber entgegengesetzte Konvention und definieren die Gitterenergie als die Energie, die freigesetzt wird, wenn sich einzelne Ionen zu einem Gitter verbinden, und geben negative (exotherme) Werte an. Wenn Sie also in einem anderen Nachschlagewerk nach Gitterenergien suchen, sollten Sie unbedingt überprüfen, welche Definition verwendet wird. In beiden Fällen weist ein größerer Wert für die Gitterenergie auf eine stabilere ionische Verbindung hin. Für Natriumchlorid gilt: ![]() . Es sind also 769 kJ erforderlich, um ein Mol des festen
. Es sind also 769 kJ erforderlich, um ein Mol des festen ![]() in gasförmige
in gasförmige ![]() und
und ![]() Ionen zu trennen. Wenn je ein Mol der gasförmigen
Ionen zu trennen. Wenn je ein Mol der gasförmigen ![]() und
und ![]() Ionen den Feststoff
Ionen den Feststoff ![]() , werden 769 kJ Wärme freigesetzt.
, werden 769 kJ Wärme freigesetzt.
Die Gitterenergie ![]() eines Ionenkristalls lässt sich durch die folgende Gleichung ausdrücken (abgeleitet vom Coulombschen Gesetz, das die Kräfte zwischen elektrischen Ladungen regelt):
eines Ionenkristalls lässt sich durch die folgende Gleichung ausdrücken (abgeleitet vom Coulombschen Gesetz, das die Kräfte zwischen elektrischen Ladungen regelt):
![]()
wobei C eine Konstante ist, die von der Art der Kristallstruktur abhängt; Z+ und Z- sind die Ladungen der Ionen; und Ro ist der interionische Abstand (die Summe der Radien der positiven und negativen Ionen). Die Gitterenergie eines Ionenkristalls nimmt also schnell zu, wenn die Ladungen der Ionen zunehmen und die Größe der Ionen abnimmt. Wenn alle anderen Parameter konstant gehalten werden, vervierfacht sich die Gitterenergie mit der Verdoppelung der Ladung von Kation und Anion. Zum Beispiel ist die Gitterenergie von ![]() (Z+ und Z- = 1) 1023 kJ/mol, während die von
(Z+ und Z- = 1) 1023 kJ/mol, während die von ![]() (Z+ und Z- = 2) 3900 kJ/mol beträgt (Ro ist fast gleich – ca. 200 pm für beide Verbindungen).
(Z+ und Z- = 2) 3900 kJ/mol beträgt (Ro ist fast gleich – ca. 200 pm für beide Verbindungen).
Unterschiedliche Abstände zwischen den Atomen führen zu unterschiedlichen Gitterenergien. Wir können zum Beispiel die Gitterenergie von ![]() (2957 kJ/mol) mit der von
(2957 kJ/mol) mit der von ![]() (2327 kJ/mol) vergleichen, um die Auswirkungen der geringeren Ionengröße von F- im Vergleich zu I- auf die Gitterenergie zu beobachten.
(2327 kJ/mol) vergleichen, um die Auswirkungen der geringeren Ionengröße von F- im Vergleich zu I- auf die Gitterenergie zu beobachten.
BEISPIEL
Vergleiche der Gitterenergie
Der Edelstein Rubin ist Aluminiumoxid, ![]() , das Spuren von
, das Spuren von ![]() enthält. Die Verbindung
enthält. Die Verbindung ![]() wird bei der Herstellung einiger Halbleitergeräte verwendet. Welche hat die größere Gitterenergie,
wird bei der Herstellung einiger Halbleitergeräte verwendet. Welche hat die größere Gitterenergie, ![]() oder
oder ![]() ?
?
Lösung
In diesen beiden ionischen Verbindungen sind die Ladungen Z+ und Z- gleich, so dass der Unterschied in der Gitterenergie von Ro abhängt. Das ![]() Ion ist kleiner als das
Ion ist kleiner als das ![]() -Ion. Somit hätte
-Ion. Somit hätte ![]() einen kürzeren interionischen Abstand als
einen kürzeren interionischen Abstand als ![]() , und
, und ![]() hätte die größere Gitterenergie.
hätte die größere Gitterenergie.
Check Your Learning
Zinkoxid, ![]() , ist ein sehr wirksames Sonnenschutzmittel. Wie würde die Gitterenergie von
, ist ein sehr wirksames Sonnenschutzmittel. Wie würde die Gitterenergie von ![]() im Vergleich zu der von
im Vergleich zu der von ![]() ?
?
KEY TAKEAWAYS
Die Stärke einer kovalenten Bindung wird anhand ihrer Bindungsdissoziationsenergie gemessen, d. h. der Energiemenge, die erforderlich ist, um diese bestimmte Bindung in einem Mol Molekül zu brechen. Mehrfachbindungen sind stärker als Einfachbindungen zwischen denselben Atomen. Die Enthalpie einer Reaktion kann auf der Grundlage der zum Aufbrechen von Bindungen erforderlichen Energie und der bei der Bildung neuer Bindungen freigesetzten Energie geschätzt werden. Bei Ionenbindungen ist die Gitterenergie die Energie, die erforderlich ist, um ein Mol einer Verbindung in ihre Ionen in der Gasphase zu zerlegen. Die Gitterenergie steigt für Ionen mit höheren Ladungen und kürzeren Abständen zwischen den Ionen.
- Bindungsenergie für ein zweiatomiges Molekül:
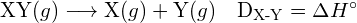
- Enthalpieänderung:

- Gitterenergie für einen festen MX:
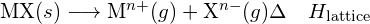
- Gitterenergie für einen ionischen Kristall:
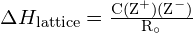
ENDE DER KAPITEL-ÜBUNGEN
- Welche Bindung in jedem der folgenden Bindungspaare ist die stärkste? (a)
 oder
oder 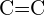 (b)
(b) 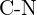 oder
oder 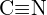 (c)
(c) 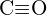 oder
oder 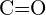 (d)
(d) 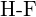 oder
oder 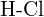 (e)
(e) 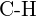 oder
oder 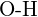 (f)
(f) 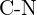 oder
oder 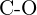
- Bestimmen Sie unter Verwendung der Bindungsenergien in der Tabelle die ungefähre Enthalpieänderung für jede der folgenden Reaktionen: (a)
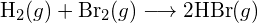 (b)
(b) 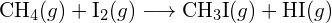 (c)
(c) 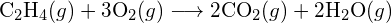 (a) -114 kJ; (b) 30 kJ; (c) -1055 kJ
(a) -114 kJ; (b) 30 kJ; (c) -1055 kJ - Bestimmen Sie anhand der Bindungsenergien in der Tabelle die ungefähre Enthalpieänderung für jede der folgenden Reaktionen: (a)
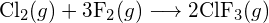 (b)
(b) 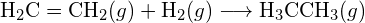 (c)
(c) 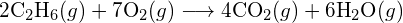
- Zeichne eine Kurve, die die Energie eines Systems mit H- und Cl-Atomen in unterschiedlichen Abständen beschreibt. Ermitteln Sie anschließend das Energieminimum dieser Kurve auf zwei Arten.(a) Berechnen Sie anhand der in den Tabellen angegebenen Bindungsenergie die Energie für eine einzelne
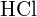 Bindung zu berechnen (Hinweis: Wie viele Bindungen sind in einem Mol?).(b) Benutze die Reaktionsenthalpie und die Bindungsenergien für H2 und Cl2, um die Energie für ein Mol
Bindung zu berechnen (Hinweis: Wie viele Bindungen sind in einem Mol?).(b) Benutze die Reaktionsenthalpie und die Bindungsenergien für H2 und Cl2, um die Energie für ein Mol 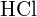 Bindungen.
Bindungen.
Erkläre, warum Bindungen bei bestimmten mittleren Bindungsabständen auftreten, anstatt dass sich die Atome unendlich nahe kommen.
Der bestimmte mittlere Bindungsabstand ist der Abstand mit der geringsten Energie. Bei Abständen, die kleiner als der Bindungsabstand sind, stoßen sich die positiven Ladungen der beiden Kerne ab, und die Gesamtenergie nimmt zu. - Wenn ein Molekül zwei verschiedene Strukturen bilden kann, ist die Struktur mit den stärkeren Bindungen normalerweise die stabilere Form. Benutze die Bindungsenergien, um die richtige Struktur des Hydroxylaminmoleküls vorherzusagen:
 Die größere Bindungsenergie ist in der Abbildung links zu sehen. Sie ist die stabilere Form.
Die größere Bindungsenergie ist in der Abbildung links zu sehen. Sie ist die stabilere Form. - Wie ist die Bindungsenergie von
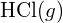 unterscheidet sich von der Standardbildungsenthalpie von
unterscheidet sich von der Standardbildungsenthalpie von 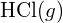 ?
? - Zeigen Sie unter Verwendung der Standardbildungsenthalpie-Daten in Anhang G, wie die Standardbildungsenthalpie von
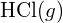 zur Bestimmung der Bindungsenergie verwendet werden kann.
zur Bestimmung der Bindungsenergie verwendet werden kann.
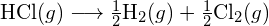
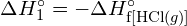
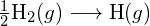
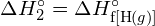
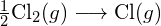
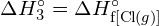
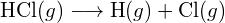
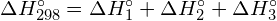
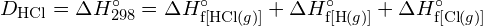
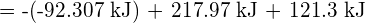
- Berechnen Sie unter Verwendung der Standardbildungsenthalpie-Daten in Anhang G die Bindungsenergie der Kohlenstoff-Schwefel-Doppelbindung in
 .
. - Bestimmen Sie unter Verwendung der Standardbildungsenthalpie-Daten in Anlage G, welche Bindung stärker ist: die S-F-Bindung in
 oder in
oder in 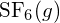 ?
Die S-F-Bindung in
?
Die S-F-Bindung in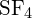 ist stärker.
ist stärker. - Bestimmen Sie unter Verwendung der Standardbildungsenthalpie-Daten in Anhang G, welche Bindung stärker ist: die P-Cl-Bindung in
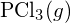 oder in
oder in 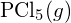 ?
? - Vervollständige die folgende Lewis-Struktur, indem du Bindungen (nicht Atome) hinzufügst, und gib dann die längste Bindung an:

 Die C-C-Einfachbindungen sind am längsten.
Die C-C-Einfachbindungen sind am längsten. - Berechnen Sie anhand der Bindungsenergie einen ungefähren Wert für ΔH für die folgende Reaktion. Welche ist die stabilere Form von
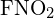 ?
?
- Beantworte die folgenden Fragen mit Hilfe der Prinzipien der Atomstruktur:1 (a) Der Radius des Ca-Atoms beträgt 197 pm; der Radius des
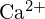 -Ions beträgt 99 pm. Begründen Sie die Differenz. (b) Die Gitterenergie von
-Ions beträgt 99 pm. Begründen Sie die Differenz. (b) Die Gitterenergie von 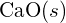 ist -3460 kJ/mol; die Gitterenergie von
ist -3460 kJ/mol; die Gitterenergie von 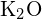 ist -2240 kJ/mol. Erläutern Sie die Differenz. (c) Erläutern Sie angesichts dieser Ionisationswerte den Unterschied zwischen Ca und K in Bezug auf ihre erste und zweite Ionisationsenergie.
ist -2240 kJ/mol. Erläutern Sie die Differenz. (c) Erläutern Sie angesichts dieser Ionisationswerte den Unterschied zwischen Ca und K in Bezug auf ihre erste und zweite Ionisationsenergie.
Element Erste Ionisierungsenergie (kJ/mol) Zweite Ionisierungsenergie (kJ/mol) K 419 3050 Ca 590 1140 (d) Die erste Ionisierungsenergie von Mg ist 738 kJ/mol und die von Al ist 578 kJ/mol. Begründen Sie diesen Unterschied.
(a) Wenn zwei Elektronen aus der Valenzschale entfernt werden, verliert der Ca-Radius das äußerste Energieniveau und fällt auf das niedrigere n = 3-Niveau zurück, das einen viel kleineren Radius hat.(b) Die +2-Ladung von Calcium zieht den Sauerstoff im Vergleich zu K viel näher heran und erhöht dadurch die Gitterenergie im Vergleich zu einem weniger geladenen Ion.
(c) Die Entfernung des 4s-Elektrons in Ca erfordert mehr Energie als die Entfernung des 4s-Elektrons in K wegen der stärkeren Anziehung des Kerns und der zusätzlichen Energie, die erforderlich ist, um die Paarung der Elektronen aufzubrechen. Die zweite Ionisierungsenergie für K erfordert, dass ein Elektron aus einem niedrigeren Energieniveau entfernt wird, wo die Anziehungskraft des Kerns für das Elektron viel stärker ist. Darüber hinaus ist Energie erforderlich, um zwei Elektronen in einem vollen Orbital zu entpaaren. Bei Ca erfordert das zweite Ionisierungspotenzial nur die Entfernung eines einsamen Elektrons im exponierten äußeren Energieniveau.
(d) Bei Al ist das entfernte Elektron relativ ungeschützt und ungepaart in einem p-Orbital. Die höhere Energie für Mg spiegelt hauptsächlich die Unpaarung des 2s-Elektrons wider.
- Für welche der folgenden Substanzen ist die geringste Energie erforderlich, um ein Mol des Festkörpers in getrennte Ionen umzuwandeln? (a)
 (b)
(b) 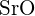 (c)
(c) 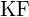 (d)
(d) 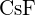 (e)
(e) 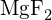 (d)
(d) - Die Reaktion eines Metalls,
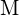 , mit einem Halogen,
, mit einem Halogen, 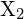 , verläuft durch eine exotherme Reaktion, wie sie in dieser Gleichung angegeben ist:
, verläuft durch eine exotherme Reaktion, wie sie in dieser Gleichung angegeben ist: 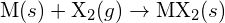 . Geben Sie für jede der folgenden Möglichkeiten an, bei welcher die Reaktion exothermer ist. Begründen Sie Ihre Antworten. (a) ein großer Radius vs. ein kleiner Radius für
. Geben Sie für jede der folgenden Möglichkeiten an, bei welcher die Reaktion exothermer ist. Begründen Sie Ihre Antworten. (a) ein großer Radius vs. ein kleiner Radius für 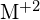 (b) eine hohe Ionisierungsenergie vs. eine niedrige Ionisierungsenergie für
(b) eine hohe Ionisierungsenergie vs. eine niedrige Ionisierungsenergie für 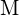 (c) eine zunehmende Bindungsenergie für das Halogen (d) eine abnehmende Elektronenaffinität für das Halogen (e) eine zunehmende Größe des durch das Halogen gebildeten Anions
(c) eine zunehmende Bindungsenergie für das Halogen (d) eine abnehmende Elektronenaffinität für das Halogen (e) eine zunehmende Größe des durch das Halogen gebildeten Anions - Die Gitterenergie von
 beträgt 1023 kJ/mol, und der Li-F-Abstand beträgt 201 pm.
beträgt 1023 kJ/mol, und der Li-F-Abstand beträgt 201 pm.  kristallisiert in der gleichen Struktur wie
kristallisiert in der gleichen Struktur wie  , jedoch mit einem Mg-O-Abstand von 205 pm. Welcher der folgenden Werte entspricht am ehesten der Gitterenergie von
, jedoch mit einem Mg-O-Abstand von 205 pm. Welcher der folgenden Werte entspricht am ehesten der Gitterenergie von  : 256 kJ/mol, 512 kJ/mol, 1023 kJ/mol, 2046 kJ/mol oder 4008 kJ/mol? Begründen Sie Ihre Wahl.
4008 kJ/mol; beide Ionen in
: 256 kJ/mol, 512 kJ/mol, 1023 kJ/mol, 2046 kJ/mol oder 4008 kJ/mol? Begründen Sie Ihre Wahl.
4008 kJ/mol; beide Ionen in haben die doppelte Ladung wie die Ionen in
haben die doppelte Ladung wie die Ionen in  ; die Bindungslänge ist sehr ähnlich und beide haben die gleiche Struktur; eine Vervierfachung der Energie wird aufgrund der Gleichung für die Gitterenergie
; die Bindungslänge ist sehr ähnlich und beide haben die gleiche Struktur; eine Vervierfachung der Energie wird aufgrund der Gleichung für die Gitterenergie - erwartet. Welche Verbindung in jedem der folgenden Paare hat die größere Gitterenergie? Hinweis:
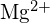 und
und 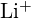 haben ähnliche Radien;
haben ähnliche Radien; 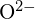 und
und 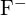 haben ähnliche Radien. Begründe deine Wahl. (a)
haben ähnliche Radien. Begründe deine Wahl. (a)  oder
oder 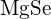 (b)
(b)  oder
oder  (c)
(c) 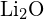 oder
oder 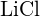 (d)
(d) 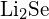 oder
oder 
- Welche Verbindung in jedem der folgenden Paare hat die größere Gitterenergie? Hinweis:
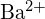 und
und 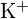 haben ähnliche Radien;
haben ähnliche Radien; 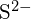 und
und 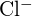 haben ähnliche Radien. Begründen Sie Ihre Wahl. (a)
haben ähnliche Radien. Begründen Sie Ihre Wahl. (a) 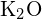 oder
oder 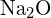 (b)
(b) 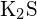 oder
oder  (c)
(c) 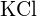 oder
oder  (d)
(d)  oder
oder 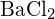 (a)
(a)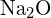 ;
; 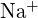 hat einen kleineren Radius als
hat einen kleineren Radius als 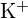 ; (b)
; (b)  ;
; 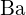 hat eine größere Ladung als
hat eine größere Ladung als 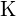 ; (c)
; (c)  ;
; 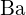 und
und 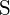 haben größere Ladungen; (d)
haben größere Ladungen; (d)  ;
; 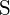 hat eine größere Ladung
hat eine größere Ladung - Welche der folgenden Verbindungen benötigt die meiste Energie, um ein Mol des Feststoffs in einzelne Ionen umzuwandeln? (a)
 (b)
(b) 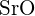 (c)
(c) 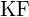 (d)
(d) 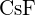 (e)
(e) 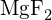
- Welche der folgenden Verbindungen benötigt die meiste Energie, um ein Mol des Feststoffs in einzelne Ionen umzuwandeln? (a)
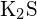 (b)
(b) 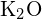 (c)
(c) 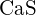 (d)
(d) 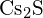 (e)
(e) 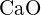 (e)
(e)
Fußnoten
- 1 Diese Frage stammt aus der Chemistry Advanced Placement Examination und wird mit Genehmigung des Educational Testing Service verwendet.
Glossar
Bindungsenergie (auch, Bindungsdissoziationsenergie) Energie, die erforderlich ist, um eine kovalente Bindung in einer gasförmigen Substanz zu brechen Gitterenergie (ΔHlattice) Energie, die erforderlich ist, um ein Mol eines ionischen Festkörpers in seine Bestandteile zu trennen gasförmige Ionen
Energie, die erforderlich ist, um ein Mol eines ionischen Feststoffs in seine Bestandteile zu zerlegen gasförmige Ionen
