Beschreibung
Fruchtkörper: 8-30 cm Durchmesser, fleischig, anfangs weiß, mit zunehmendem Alter hellbraun oder gelblich, von der schmalen Basis entspringen einige Hauptäste, jeder Hauptast treibt zahlreiche kleinere Äste, an denen dichte und dicht gedrängte Stacheln in Reihen hängen.
Stacheln: zylindrisch, an der Spitze spitz, 0,5 – 1,5 cm lang.
Sporenabdruck: weiß.
Sporen: farblos, glatt, ellipsoid bis subglobös, amyloid, hyalin, 5-8 x 4,5-6 µm.
Lebensraum: einzeln oder in Büscheln, meist auf toten Laubbäumen; saprobisch; Spätsommer und Herbst; häufig.
Geruch: undeutlich.
Essbarkeit: essbar.
Bioaktive Verbindungen
Eine frühe Studie über Polysaccharide, die aus diesem Pilz isoliert wurden, ergab, dass es sich um ein lineares Molekül handelt, das nur α-1,4 glucosidische Bindungen enthält. Außerdem unterscheidet sich das Polysaccharid von dem höherer Pflanzen dadurch, dass es nur aus kurzkettigen Amylosemolekülen (32 bis 45 Glukoseeinheiten lang) besteht, während die Polysaccharide in Pflanzen je nach Art Kettenlängen von mehreren tausend aufweisen können (McCracken und Dodd, 1971).
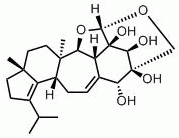
Experimente mit radioaktiv markierter Glukose deuten darauf hin, dass das D-Xylosid Herical, das aus Kulturen von H. coralloides isoliert wurde, vermutlich ein Vorläufer bei der Synthese von Cyathane-Skelett-Molekülen ist, einschließlich Erinacin E, das weiter unten behandelt wird. Herical ist dafür bekannt, dass es ein breites Spektrum von Pilzen und Bakterien hemmt und zytotoxische und hämolytische Eigenschaften aufweist (Anke et al., 2002).
Medizinische Eigenschaften
Nematizide Aktivität
Ein nematizides Fettsäuregemisch wurde aus Kulturen von H. coralloides gewonnen. Dieses Gemisch, das hauptsächlich Linol-, Öl- und Palmitinsäure enthielt, zeigte toxische Wirkungen gegenüber Caenorhabditis elegans (Stadler et al., 1994).
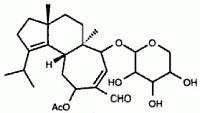
Im Jahr 1998 isolierte eine Forschungsgruppe von Pfizer Erinacin E (siehe Struktur unten) aus der Fermentationsbrühe von H. coralloides (Saito et al., 1998). Erinacin E ist ein hochselektiver Agonist am κ-Opiodrezeptor (IC50 von 0,8 µM im Vergleich zur Bindung an den µ-Opiodrezeptor, IC50 von >200 mM). Dieses Molekül wurde früher aus den Fruchtkörpern von H. erinaceum isoliert, wo es sich als starker Stimulator der Nervenwachstumsfaktorsynthese erwies (Kawagishi et al., 1996). Stimulatoren der Nervenwachstumsfaktorsynthese werden als potenzielle Arzneimittel für degenerative neuronale Erkrankungen wie die Alzheimer-Krankheit und die Regeneration peripherer Nerven untersucht (Yamada et al., 1997). Vor kurzem wurde über die Totalsynthese von Erinacin E berichtet (Watanabe und Nakada, 2008).
Links
Pilzexperte
Pilze aus Polen
Pilze auf Holz
Anke T, Rabe U, Schu P, Eizenhofer T, Schrage M, Steglich W.
Studien zur Biosynthese von Diterpenoiden vom Striatal-Typ und zur biologischen Aktivität von Hericium.
Z Naturforsch C. 2002 57(3-4):263-71.
Ginns J.
Hericium coralloides N. amer auct (Hericium americanum sp nov) und die europäischen Hericium alpestre und Hericium coralloides.
Mycotaxon. 1984 20(1):39-43.
Hallenberg N.
Hericium coralloides und Hericium coralloides (Basidiomyceten) in Europa.
Mycotaxon. 1983 18(1):181-9.
Kawagishi H, Shimada A, Hosokawa S, Mori H, Sakamoto H, Ishiguro Y, Sakemi S, Bordner J, Kojima N, Furukawa S.
Erinacine E, F und G, Stimulatoren der Nervenwachstumsfaktor (NGF)-Synthese, aus den Myzelien von Hericium erinaceum.
Tetra Lett. 1996 37(41):7399-402.
McCracken DA, Dodd JL.
Molecular structure of starch-type polysaccharides from Hericium ramosum and Hericium coralloides.
Science. 1971 174(7):419.
Pubmed
Saito T, Aoki F, Hirai H, Inagaki T, Matsunaga Y, Sakakibara T, Sakemi S, Suzuki Y, Watanabe S, Suga O, Sujaku T, Smogowicz AA, Truesdell SJ, Wong JW, Nagahisa A, Kojima Y, Kojima N.
Erinacin E als Kappa-Opioidrezeptor-Agonist und seine neuen Analoga aus einem Basidiomyceten, Hericium ramosum.
J Antibiot. 1998 51(11):983-90.
Pubmed
Stadler M, Mayer A, Anke H, Sterner O.
Fettsäuren und andere Verbindungen mit nematizider Wirkung aus Kulturen von Basidiomyceten.
Planta Med. 1994 60(2):128-32.
Pubmed
Watanabe H, Nakada M.
Biomimetische Totalsynthese von (-)-Erinacin E
J Am Chem Soc. 2008 130(4):1150-1.
Yamada K, Nitta A, Hasegawa T, Fuji K, Hiramatsu M, Kameyama T, Furukawa Y, Hayashi K, Nabeshima T.
Oral aktive NGF-Synthesestimulatoren: potentielle Therapeutika bei der Alzheimer-Krankheit.
Behav Brain Res. 1997 83(1-2):117-22.
Pubmed
