Autor: Amelie Stahlbuhk
zurück zu Sulfat
Dieser Artikel wird demnächst veröffentlicht.
Abstract
Die verschiedenen hydratisierten Formen von Magnesiumsulfat und das Verhalten hinsichtlich Löslichkeit und Hygroskopizität werden vorgestellt.
Hydratisierte Formen
Kieserit MgSO4-H2O
Sanderit MgSO4-2H2O
Starkeyit MgSO4-4H2O
Pentahydrit MgSO4-5H2O
Hexahydrit MgSO4-6H2O
Epsomit MgSO4-7H2O
Meridianiit MgSO4-11H2O
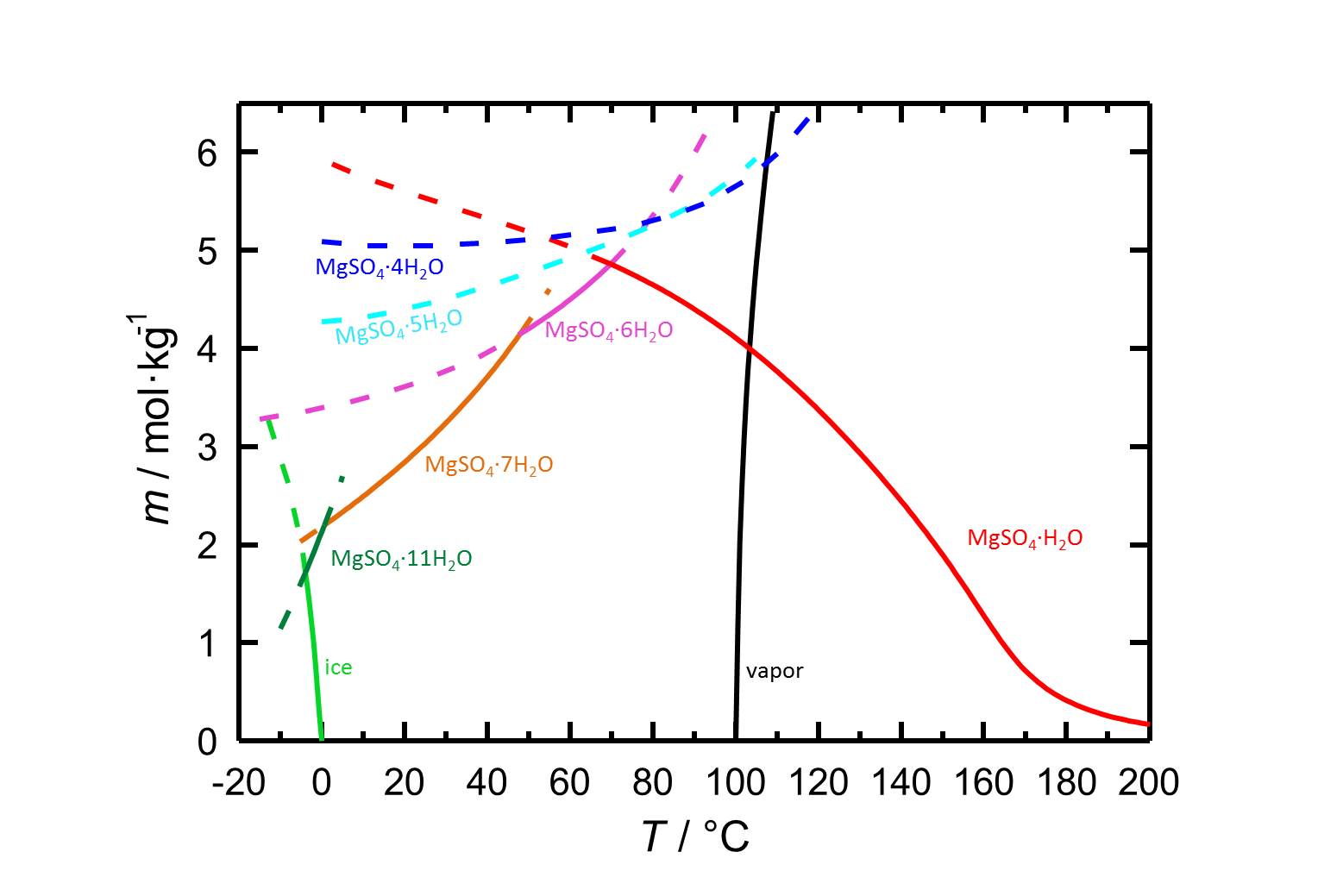
Löslichkeit
Wie in Tabelle 1 gezeigt wird, sind die verschiedenen hydratisierten Formen von Magnesiumsulfat leicht lösliche Salze, was zu einer hohen Mobilität der Salze in porösen Materialien führt.
| Hydratisierte Form | Löslichkeit bei 20°C |
| Kieserit | 5.60 |
| Starkeyit | 5.04 |
| Pentahydrit | 4.40 |
| Hexahydrit | 3.61 |
| Epsomit | 2.84 |
Durch die verschiedenen hydratisierten Formen von Magnesiumsulfat mit stabilen und metastabilen Gleichgewichten enthält das Löslichkeitsdiagramm des Systems MgSO4-H2O mehr Informationen als Diagramme von Salzen mit weniger oder auch ohne hydratisierte Formen. Bei der Temperaturabhängigkeit der Löslichkeit ist es möglich, dass Temperaturänderungen mit einer Hydratation oder einer Dehydratation einer betrachteten Phase einhergehen.
Author: Steiger, Michael; Linnow, Kirsten; Ehrhardt, Dorothee; Rohde, Mandy
 .
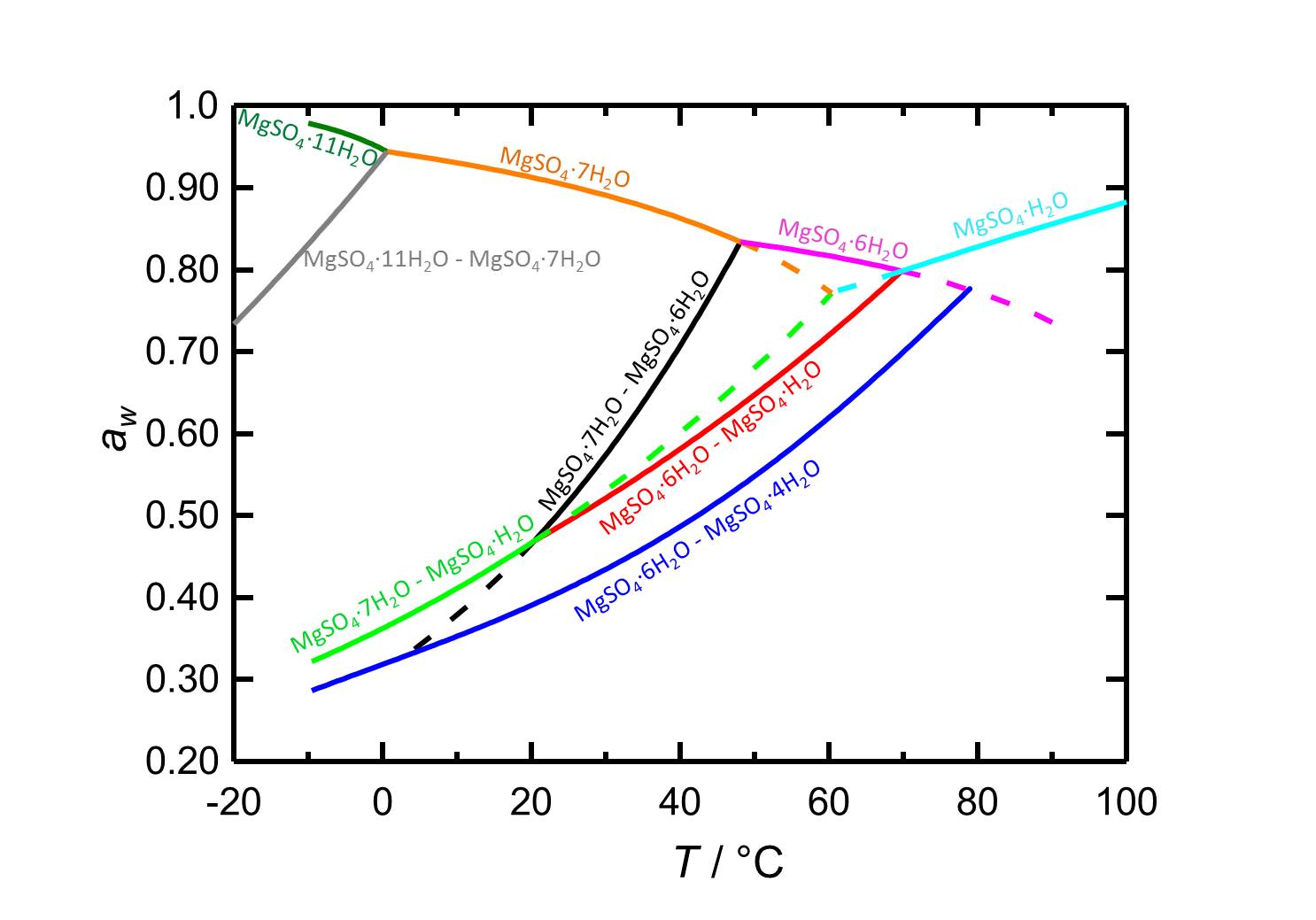
.Hygroskopizität
Im System MgSO4-H2O können Änderungen der Temperatur oder der relativen Luftfeuchtigkeit zu Hydratations-/Dehydratations- oder Deliqueszenz/Kristallisationsprozessen führen. Bei 20 °C ist Epsomit die vorliegende kristalline Phase, wenn die relative Luftfeuchtigkeit unter seiner Zerfließungsfeuchte von 91,3 % liegt. Wenn die relative Luftfeuchtigkeit Werte unter 47 % erreicht, setzt die Dehydratisierung zu niedrigeren Hydratisierungsgraden ein, wie sie in den Kurven der Gleichgewichtsfeuchten in Abbildung 2 dargestellt ist.
| Phasenübergang | Deliqueszenz oder Gleichgewichtsfeuchte bei 20°C |
| Bittersalzlösung | 91,3 % |
| Bittersalz-Hexahydrit | 46.6 % |
| Epsomit-Kieserit | 46.7 % |
| Hexahydrit-Starkeyit | 39.1 % |
begleitet von einer Hydratation oder einer Dehydratation einer betrachteten Phase.
Author: Steiger, Michael; Linnow, Kirsten; Ehrhardt, Dorothee; Rohde, Mandy
 .
.Im Temperaturbereich von -10 bis 100 °C liegen die Zerfallsfeuchten der vorliegenden hydratisierten Formen (abhängig von der Temperatur) immer über 80 % r.F., damit gehören die Salze nicht zu den hygroskopischen Salzen.
Weblinks
Literatur
| Mainusch, Nils (2001): Erstellung einer Materialsammlung zur qualitativen Bestimmung bauschädlicher Salze für Fachleute der Restaurierung, Diplomarbeit, HAWK Hochschule für angewandte Wissenschaft und Kunst Hildesheim/Holzminden/Göttingen, file:Diplomarbeit Nils Mainusch.pdf |   |
|
| Stark, Jochen; Stürmer, Sylvia (1996): Bauschädliche Salze, Bauhaus-Univ. Weimar |  |
|
| Steiger, Michael; Linnow, Kirsten; Ehrhardt, Dorothee; Rohde, Mandy (2011): Zersetzungsreaktionen von Magnesiumsulfathydraten und Phasengleichgewichte in den Systemen MgSO4-H2O und Na+-Mg2+-Cl–SO42–H2O mit Implikationen für den Mars. Geochimica et Cosmochimica Act, 75 (12), 3600-3626, 10.1016/j.gca.2011.03.038, |  |
