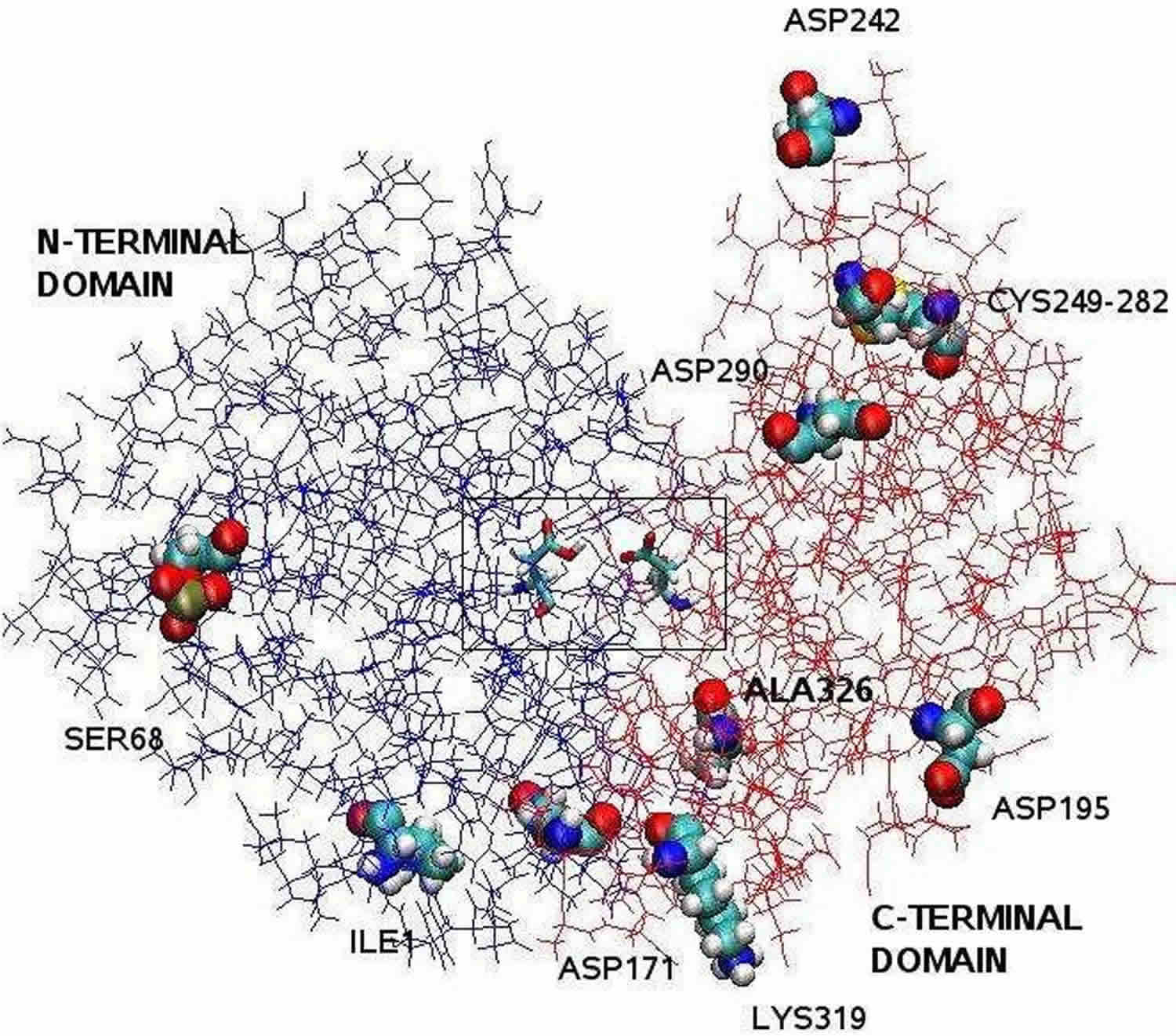
 Fußnote: Die durch Röntgenkristallographie aufgeklärte Pepsinstruktur ist bilobal mit einem großen Spalt im aktiven Zentrum zwischen den beiden Lappen. Die Reste 1 bis 175 bilden die N-terminale Domäne, während die Reste 176 bis 326 die C-terminale Domäne darstellen. Zwei Aspartate in der Mitte des Spalts, Asp32 und Asp215, fungieren als katalytische Reste. Die katalytische Stelle, bestehend aus Asp32 und Asp215, befindet sich in der Mitte des Spaltes. Die geladenen Aminosäurereste auf der Proteinoberfläche sind: Asp171, Asp195, Asp242, Asp290, Lys319, Ile1 (N-terminal), Ala326 (C-terminal). Das phosphorylierte Ser68 ist dem Lösungsmittel vollständig ausgesetzt und die Disulfidbrücke zwischen Cys 249 und Cys 282 befindet sich an der Proteinoberfläche.
Fußnote: Die durch Röntgenkristallographie aufgeklärte Pepsinstruktur ist bilobal mit einem großen Spalt im aktiven Zentrum zwischen den beiden Lappen. Die Reste 1 bis 175 bilden die N-terminale Domäne, während die Reste 176 bis 326 die C-terminale Domäne darstellen. Zwei Aspartate in der Mitte des Spalts, Asp32 und Asp215, fungieren als katalytische Reste. Die katalytische Stelle, bestehend aus Asp32 und Asp215, befindet sich in der Mitte des Spaltes. Die geladenen Aminosäurereste auf der Proteinoberfläche sind: Asp171, Asp195, Asp242, Asp290, Lys319, Ile1 (N-terminal), Ala326 (C-terminal). Das phosphorylierte Ser68 ist dem Lösungsmittel vollständig ausgesetzt und die Disulfidbrücke zwischen Cys 249 und Cys 282 befindet sich an der Proteinoberfläche.
Pepsin hat als aspartische Protease ein sehr niedriges pH-Optimum. Kondjoyan, Daudin und Santé-Lhoutellier 9) untersuchten die Verdaulichkeit von myofibrillären Proteinen und stellten eine maximale Pepsinaktivität bei einem pH-Wert um 2 fest. Pletschke, Naudé und Oelofsen 10) untersuchten die Hydrolyse von Hämoglobin durch Schweine- und Straußenpepsin und fanden ebenfalls einen optimalen pH-Wert von 2,0 für die Pepsinaktivität. Nach der Aktivierung bei einem pH-Wert <4,5 werden Pepsin-Enzyme bei einem pH-Wert über 7,0 leicht denaturiert, was die Eigenschaften von Pepsin 11) bestimmt.
Im Gegensatz zum Einfluss des pH-Werts wird die Wirkung der Ionenstärke auf die Enzymaktivität weniger häufig diskutiert. Frühere Arbeiten von Dale und White 12) zeigten, dass eine Erhöhung der Ionenstärke die Reaktionsgeschwindigkeit der immobilisierten Pankreas-Ribonuklease deutlich verringert, während Butré, Wierenga und Gruppen 13) die enzymatische Hydrolyse von Molkenproteinisolat durch Alcalase und Neutrase untersuchten und ebenfalls feststellten, dass die Anwesenheit von 0.5M NaCl die Hydrolysegeschwindigkeit verringerte.
Zwei starke natürlich vorkommende Inhibitoren von Pepsin sind bekannt: Pepstatin, ein Pentapeptid aus Streptomyces, und ein einzigartiger proteinischer Inhibitor aus Ascaris. Pepsin unterliegt auch einer Rückkopplungshemmung; ein Produkt der Proteinverdauung verlangsamt die Reaktion, indem es Pepsin hemmt 14).
Wo wird Pepsin produziert?
Die Chief-Zellen sezernieren Pepsin in Form eines inaktiven Enzymvorläufers namens Pepsinogen. Wenn Pepsinogen mit Salzsäure aus den Parietalzellen in Berührung kommt, zerfällt es rasch und bildet Pepsin 15). Pepsin leitet die Verdauung fast aller Arten von Nahrungsproteinen in Polypeptide ein. Dieses Enzym ist am aktivsten in einer sauren Umgebung, die durch die Salzsäure im Magensaft gegeben ist.
Abbildung 2. Magenzellen (Magendrüsen)
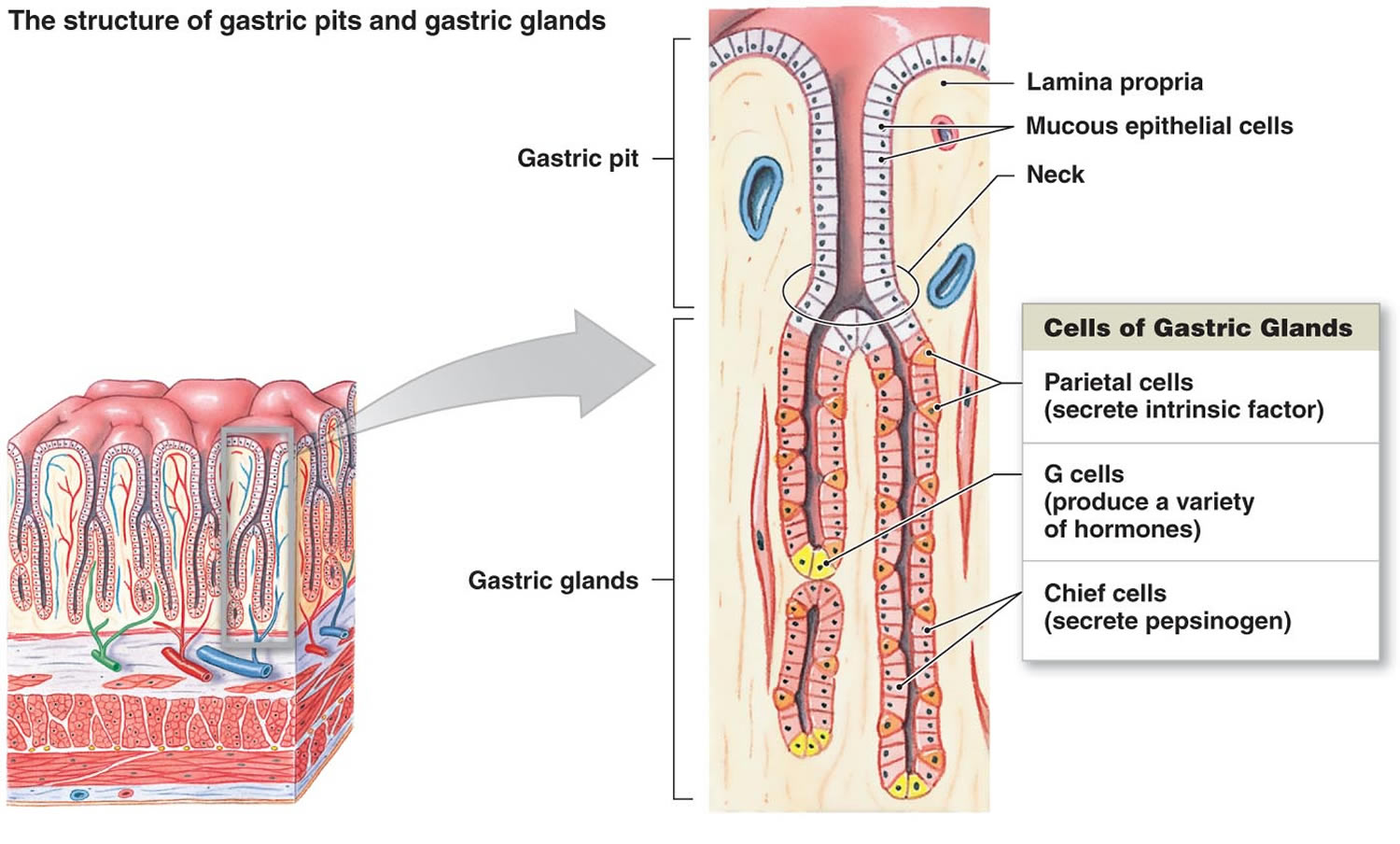 Fußnote: Auskleidung des Magens. Zu den Magendrüsen gehören Schleimzellen, Parietalzellen und Hauptzellen. Die Magenschleimhaut ist mit Magengruben übersät, die die Öffnungen der Magendrüsen sind.
Fußnote: Auskleidung des Magens. Zu den Magendrüsen gehören Schleimzellen, Parietalzellen und Hauptzellen. Die Magenschleimhaut ist mit Magengruben übersät, die die Öffnungen der Magendrüsen sind.
Was macht Pepsin?
Pepsin, das aus Pepsinogen (inaktive Form von Pepsin) in Gegenwart von Salzsäure gebildet wird, verdaut fast alle Arten von Nahrungsproteinen in Polypeptide (kleinere Proteinverbindungen). Pepsin verdaut Proteine in starker Magensäure. Pepsin ist für die Verdauung von Nahrungsmitteln in der sauren Umgebung des Magens optimiert und ist die erste Protease, auf die Nahrungsproteine im Verdauungstrakt treffen. Pepsin ist im sauren Milieu zwischen 37 °C und 42 °C am aktivsten 16).
Die Spezifität von Pepsin (d. h. die Wahrscheinlichkeit der Spaltung von Peptidbindungen durch Pepsin) wird hauptsächlich von den Aminosäureresten an den Positionen P1 und P1′ beeinflusst, während die Aminosäurereste an anderen Unterseiten ebenfalls eine Rolle spielen können. Im Allgemeinen spaltet Pepsin bevorzugt nach Phenylalanin, Leucin und Methionin, während es selten nach Histidin, Lysin, Prolin und Arginin spaltet 17). Die aromatischen Reste Tyrosin, Tryptophan und Phenylalanin werden an der Position P1′ bevorzugt. Prolin ist an den Positionen P2, P2′ und P3′ stark benachteiligt, während Histidin, Lysin und Arginin an der Position P3 benachteiligt sind. Die P4- und P4′-Positionen haben wenig Einfluss 18).
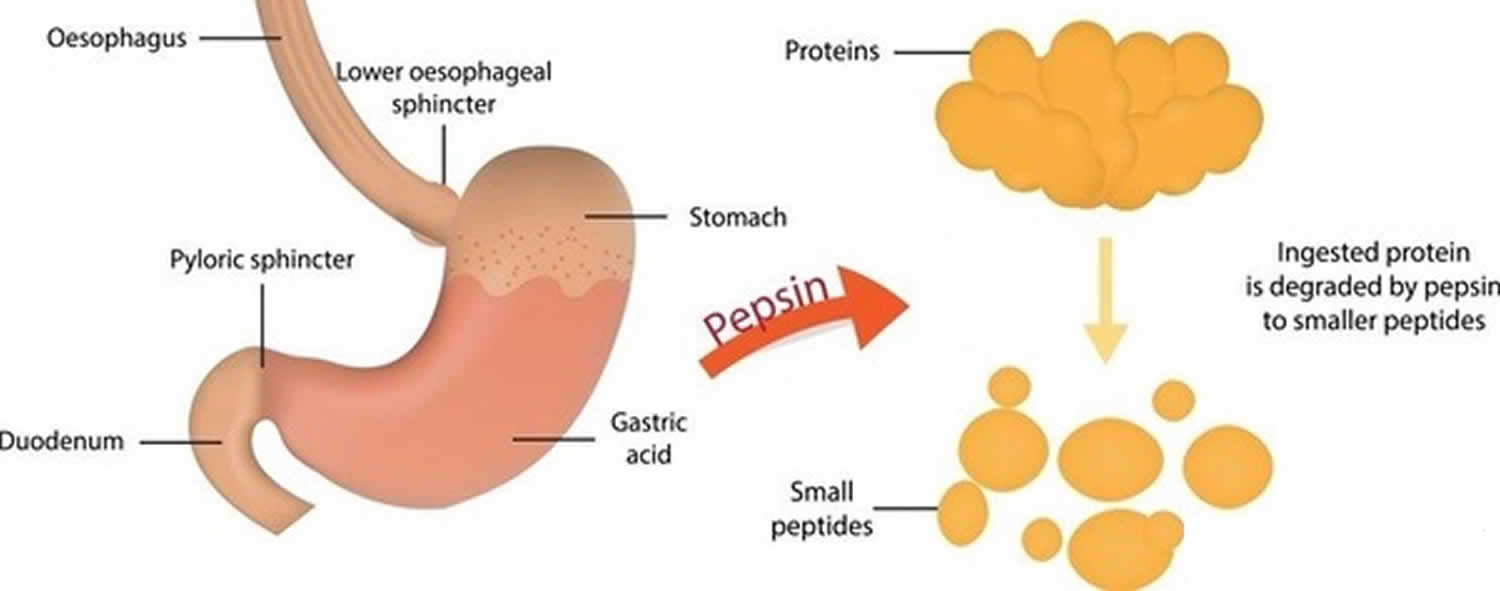
Abbildung 3. Pepsin-Funktion