Der Uteruskreislauf reagiert äußerst empfindlich auf Östrogenstimulation und reagiert mit einem Grad an Vasodilatation, der von keinem anderen Organ des Körpers auf einen anderen Stimulus erreicht wird.2 Während des Ovarialzyklus treten wiederkehrende Muster der UBF auf, die die Wirkung der Östrogensekretion und die modulierenden Effekte von Progesteron widerspiegeln. Diese zyklischen Muster zeigen sich am deutlichsten bei Tieren mit kurzen präovulatorischen Zyklusphasen wie der Kuh, der Sau und dem Mutterschaf und sind in Abbildung 1 mit den peripheren Östrogen- und Progesteronspiegeln dargestellt.3, 4, 5 Nach der Empfängnis bei diesen Tierarten ähneln die UBF-Muster denen nicht trächtiger Tiere, bis es 17 bis 28 Tage später zur Interdigitation von mütterlichem und fötalem Gewebe kommt; danach kommt es zu einem definitiven und progressiven Anstieg der UBF, der bis zur Schwangerschaft anhält. Da die Erosion der Gebärmutterschleimhaut durch den fetalen Trophoblasten bei Primaten viel früher nach der Befruchtung stattfindet, kann man davon ausgehen, dass der UBF bei diesen Tierarten früher ansteigt, obwohl solche Reaktionen noch nie beobachtet wurden. Die Gesamtmuster des gesamten UBF, des UBF pro Gewichtseinheit des Uterus und seines Inhalts, des Anteils des UBF, der die Plazenta versorgt, und des fetalen Gewichts während der Schafschwangerschaft sind in Abbildung 2 dargestellt. Der Zeitraum zwischen dem 17. und 70. Tag der Trächtigkeit ist mit den schnellsten Veränderungen von UBF und PBF verbunden und entspricht dem Zeitpunkt der endgültigen Plazentation bei dieser Tierart. Durch unvollständig verstandene Mechanismen weiten sich die Blutgefäße, die die Plazenta versorgen, in dieser Zeit zunehmend, was gleichzeitig zu einem absoluten Anstieg des gesamten UBF und zu einer Umleitung dieses Blutes von nichtplazentarem zu plazentarem Gewebe führt.* Mit der anschließenden Plazentareifung nehmen der Anteil des UBF, der die Plazenta versorgt, und die absolute Menge des PBF zu, jedoch mit Raten, die eher denen des fetalen Wachstums entsprechen; daher ist der UBF pro Gewichtseinheit des Uterus und seines Inhalts während der letzten Hälfte der Schwangerschaft im Wesentlichen konstant. Während dieser Zeit ist die aus jedem Milliliter Blut extrahierte Sauerstoffmenge konstant, und daher ist auch die pro Gewichtseinheit des graviden Uterus abgegebene Sauerstoffmenge konstant.6 Korrelative Studien bei Frauen zeigen ähnliche homöostatische Muster von 10 bis 40 Schwangerschaftswochen und einen ähnlichen Sauerstoffverbrauch (etwa 10 ml/kg).7 Da Frauen die gleiche Sauerstoffmenge bei niedrigeren UBF-Raten abgeben als das Mutterschaf (~150 gegenüber ~270 ml/kg), folgt daraus, dass die menschliche Plazenta in dieser Hinsicht effizienter ist. Daher ist für Föten mit ähnlichem Gewicht weniger absoluter UBF erforderlich, und die Schwangerschaftsbelastung des Herzens ist geringer.
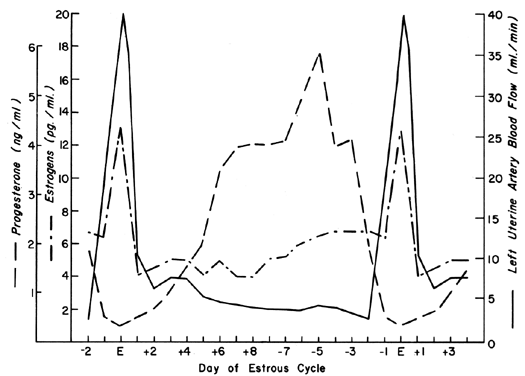 Abb. 1. Unilaterales Muster des Uterusblutflusses während des Östruszyklus bei Schafen, dargestellt mit den berichteten Serumspiegeln von Östrogenen und Progesteron (nach Greiss FC, Jr, Anderson SG: Am J Obstet Gynecol 103:629, 1969; Yuthasastrakosol P et al: J Reprod Fertil 43:57, 1975)
Abb. 1. Unilaterales Muster des Uterusblutflusses während des Östruszyklus bei Schafen, dargestellt mit den berichteten Serumspiegeln von Östrogenen und Progesteron (nach Greiss FC, Jr, Anderson SG: Am J Obstet Gynecol 103:629, 1969; Yuthasastrakosol P et al: J Reprod Fertil 43:57, 1975)
 Abb. 2. Längsschnittmuster des uterinen Blutflusses und seine Verteilung während der Schafschwangerschaft.
Abb. 2. Längsschnittmuster des uterinen Blutflusses und seine Verteilung während der Schafschwangerschaft.
Veränderungen des PBF werden durch eine ständig zunehmende Vasodilatation der Blutgefäße, die die Plazenta versorgen, im Verlauf der Trächtigkeit erreicht. Während des zweiten und dritten Trimesters kann jedoch zu keinem Zeitpunkt eine weitere akute Vasodilatation dieser Gefäße auftreten. Um eine konstante Sauerstoffzufuhr während Episoden reduzierter PBF aufrechtzuerhalten, muss daher eine erhöhte Sauerstoffextraktion stattfinden (Abb. 3). Ausgehend von den berichteten Daten scheint die Grenze der erhöhten Extraktion doppelt so hoch zu sein. Der PBF muss also um mehr als 50 % reduziert werden, bevor die Sauerstoffzufuhr beeinträchtigt wird. Bei diesen Überlegungen wird davon ausgegangen, dass die Rate des homöostatischen PBF vor der Flussreduzierung optimal war. Wir wissen jedoch, dass die homöostatischen Werte suboptimal sein können, entweder subakut, wie bei Toxämie, oder chronisch, wie bei Nephropathien. In solchen Fällen ist der Sicherheitsfaktor, d. h. der Prozentsatz, um den der PBF reduziert werden kann, bevor die Sauerstoffzufuhr beeinträchtigt wird, geringer. Dies muss immer berücksichtigt werden, wenn man die Wirkung eines akuten Reizes auf den Fötus bewertet.
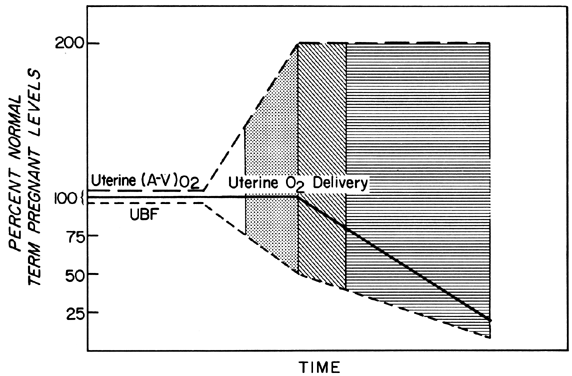 Abb. 3. Veränderungen der uterinen arteriovenösen Sauerstoffextraktion – (A-V)02 – als Reaktion auf eine Verringerung des uterinen Blutflusses in der zweiten Hälfte der Schafsträchtigkeit. Da (A-V)02 verdoppelt werden kann, wird die uterine 02-Abgabe auf einem homöostatischen Niveau gehalten, bis der uterine Blutfluss um mehr als 50 % reduziert ist. Die durchsichtigen, gepunkteten und linierten Bereiche zeigen hypothetische Grade der fetalen Reserve an, wenn sie als Funktion des optimalen plazentaren Blutflusses definiert sind, und werden verwendet, um ähnliche Grade der fetalen Reserve in den folgenden Abbildungen anzuzeigen. (Adaptiert von Huckabee WE, Metcalfe J, Prystowsky H et al: Blood flow and oxygen consumption of the pregnant uterus. Physiol 200:274, 1961.)
Abb. 3. Veränderungen der uterinen arteriovenösen Sauerstoffextraktion – (A-V)02 – als Reaktion auf eine Verringerung des uterinen Blutflusses in der zweiten Hälfte der Schafsträchtigkeit. Da (A-V)02 verdoppelt werden kann, wird die uterine 02-Abgabe auf einem homöostatischen Niveau gehalten, bis der uterine Blutfluss um mehr als 50 % reduziert ist. Die durchsichtigen, gepunkteten und linierten Bereiche zeigen hypothetische Grade der fetalen Reserve an, wenn sie als Funktion des optimalen plazentaren Blutflusses definiert sind, und werden verwendet, um ähnliche Grade der fetalen Reserve in den folgenden Abbildungen anzuzeigen. (Adaptiert von Huckabee WE, Metcalfe J, Prystowsky H et al: Blood flow and oxygen consumption of the pregnant uterus. Physiol 200:274, 1961.)
*Beim Menschen und bei subhumanen Primaten verlieren die spiralförmigen Arteriolen, die den Intervillarraum versorgen werden (etwa eine pro Plazenta-Kotyledon), ihre Kapillarverbindungen und weiten sich infolge des Ersatzes der Gefäßwände durch Trophoblasten um das Zehnfache. Dieser Prozess kann sich bis zur oder unterhalb der myoendometrialen Verbindung erstrecken und die Spiralarteriolen buchstäblich in Spiralarterien verwandeln. Das Blut, das durch diese veränderten Blutgefäße in den Intervillarraum fließt, umfasst die PBF.
Beim Schaf sind im nichtschwangeren Zustand mehrere diskrete Bereiche des Endometriums vorhanden, die Karunkel genannt werden. Während der Schwangerschaft kommt es in diesen Karunkeln zu einer Verzahnung von fetalem und mütterlichem Gewebe, die sich zu einzelnen Keimblättern der Plazenta vergrößern. Das Blut, das in diese Bereiche fließt, bildet zusammen die PBF. Obwohl sich die arteriellen Blutgefäße der Keimblätter erheblich erweitern, enthalten sie keine trophoblastischen Elemente, der mütterlich-fötale Transfer erfolgt über eine kapillar-kapillare Schnittstelle, und es ist kein intervillärer Raum vorhanden.
Dynamische Reaktionen des Uteruskreislaufs
Die Blutgefäße des nicht schwangeren Uterus reagieren ähnlich wie die jedes anderen muskulären Organs, mit Ausnahme ihrer einzigartigen Reaktivität auf östrogene Stimulation, ihrer Reaktion auf lokale Anästhetika und möglicherweise ihrer Reaktion auf Prostaglandine (Tabelle 1). Während der Schwangerschaft erweitern sich die Blutgefäße, die die Plazenta versorgen, allmählich und erreichen einen Zustand, in dem nur noch eine minimale oder gar keine akute Erweiterung mehr stattfinden kann.24 Daher sind Reize, die im nichtschwangeren Uterus eine Gefäßerweiterung hervorrufen, nach der endgültigen Plazentation unwirksam. Die Plazentagefäße behalten jedoch ihre Fähigkeit zur Vasokonstriktion wie im nichtschwangeren Zustand. Da die PBF etwa 80 % bis 90 % der gesamten UBF in der Termingeschwangerschaft ausmacht, werden die gesamten vaskulären Reaktionen des Uterus als die der Plazentagefäße erscheinen. Dieser Punkt wird oft falsch interpretiert, und man muss bedenken, dass die Antworten der nichtplazentaren Gefäße die gleichen sind, ob eine Schwangerschaft vorliegt oder nicht.
TABELLE 1. Reaktionen des nichtschwangeren uterinen Gefäßsystems*
|
Vasokonstriktion |
Vasodilatation |
|
α-Adrenergische Stimulation |
β-Adrenergische Stimulation |
|
(Dopamin, Epinephrin, |
(Isoproterenol, Epinephrin)8,9,16 |
|
Norepinephrin)8,9,10 |
Acetylcholin und Parasympathomimetika23 |
|
Sympathomimetika Wirkstoffe11 |
Adenosine17 |
|
(vasopressorische Medikamente) |
Bradykinin17,18 |
|
Hypoxämie (schwer)12 |
Cyanid19 |
|
Lokalanästhetika |
Östrogene Substanzen |
|
(intra-arterielle Verabreichung)13,14 |
(verzögerte, aber anhaltende Wirkung)2 |
|
Nikotin |
Glucosamin |
|
(α-adrenerge Mediation)15 |
(? osmotische Wirkung)21 |
|
Hypoxämie (mild)12 |
|
|
Ischämie19 |
|
|
Nitroglycerin19 |
|
|
Prostaglandine E1, E2, und I18,22 |
|
|
Vasoaktives intestinales Polypeptid20 |
* Die ausgeprägte Dilatation der Blutgefäße, die die Plazenta versorgen, und die überwiegende Verteilung des uterinen Blutflusses auf die Plazenta machen die graviden Reaktionen zunichte; Daher sind die Auswirkungen von gefäßerweiternden Reizen während der Schwangerschaft umstritten. Bei Tests sind die Gefäßreaktionen außerhalb der Plazenta ähnlich wie bei Nichtschwangeren.
Die hämochoriale Struktur der menschlichen Plazenta fügt einen einzigartigen Faktor zu den Faktoren hinzu, die normalerweise den Blutfluss in anderen Gefäßbetten kontrollieren. Das heißt, das Blut durchquert die Spiralarterien, um in den sumpfartigen Intervillarraum zu gelangen, die fetalen Zotten zu durchbluten und dann über zahlreiche Sammelvenen in der Basalplatte in den allgemeinen Kreislauf zurückzukehren. Das Blut verlässt also die normalen Gefäßkanäle, um in einem neuen extravaskulären Raum zu zirkulieren, der der Gebärmutter für die Dauer der Schwangerschaft aufgepfropft wurde. Da der Intervillarraum innerhalb der Gebärmutterhöhle liegt und die Plazenta eine flexible Struktur ist, wird der durch das kontrahierende Myometrium erzeugte Druck gleichermaßen auf die Amnionhöhle und den Intervillarraum übertragen. Somit kann ein Faktor, der nicht der üblichen Gefäßkontrolle unterliegt, nämlich die Aktivität des Myometriums, den Druck im Intervillarraum verändern und den PBF durch seine Auswirkungen auf den Perfusionsdruck beeinflussen. Eine schematische Darstellung des Blutflusses zu den nicht-plazentaren Geweben und zu einem einzelnen Keimblatt ist in Abbildung 4 zu sehen, zusammen mit den Formeln, die für die Steuerung der einzelnen Faktoren relevant sind. Es sei darauf hingewiesen, dass es sich bei diesen Formeln lediglich um Anwendungen des Ohm’schen Gesetzes auf diese individuellen kardiovaskulären Situationen handelt.
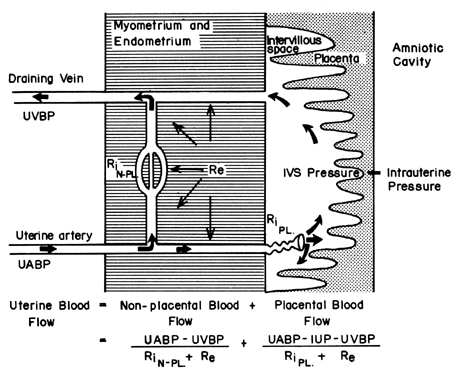 Abbildung 4. Nichtplazentarer und plazentarer Kreislauf und die Faktoren, die jeden der beiden Kreisläufe im Uterus des Primaten beeinflussen. Die Beziehung zwischen diesen Faktoren und dem Verteilungsblutfluss ist in der nebenstehenden Gleichung definiert. UABP, uteriner arterieller Blutdruck; UVBP, uteriner venöser Blutdruck; Re, extrinsischer Gefäßwiderstand; RiN-PL und RiPL, intrinsischer Gefäßwiderstand, verursacht durch die Reaktivität der nichtplazentaren bzw. plazentaren Arteriolen.(Aus Greiss FC, Jr: MCV/Q, 8:52, 1972.)
Abbildung 4. Nichtplazentarer und plazentarer Kreislauf und die Faktoren, die jeden der beiden Kreisläufe im Uterus des Primaten beeinflussen. Die Beziehung zwischen diesen Faktoren und dem Verteilungsblutfluss ist in der nebenstehenden Gleichung definiert. UABP, uteriner arterieller Blutdruck; UVBP, uteriner venöser Blutdruck; Re, extrinsischer Gefäßwiderstand; RiN-PL und RiPL, intrinsischer Gefäßwiderstand, verursacht durch die Reaktivität der nichtplazentaren bzw. plazentaren Arteriolen.(Aus Greiss FC, Jr: MCV/Q, 8:52, 1972.)
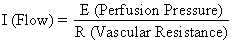
Der Perfusionsdruck, der die nichtplazentaren Gewebe mit Blut versorgt, ist die Differenz zwischen dem arteriellen und dem venösen Blutdruck im Uterus. Der Perfusionsdruck, der den Intervillarraum mit Blut versorgt, ist jedoch die Differenz zwischen dem arteriellen Blutdruck im Uterus und dem Druck im Intervillarraum. Letzterer wird am besten durch den Fruchtwasserdruck (IUP) approximiert. In einem muskulären Organ umfassen die Widerstandsfaktoren den Widerstand, der sich aus der Reaktivität der glatten Gefäßmuskulatur ergibt (intrinsischer Widerstand (Ri)), und den Druck, der auf die Blutgefäße ausgeübt wird, während sie das kontrahierende Myometrium durchqueren (extrinsischer Widerstand (Re)). Es sollte also klar sein, dass Uteruskontraktionen den PBF durch zwei Mechanismen beeinflussen können: durch die Erhöhung des Re und durch die Verringerung des Perfusionsdrucks der Plazenta.
In der klinischen Praxis sind drei Hauptmerkmale der Plazenta-Gefäßkontrolle wichtig. Dazu gehören die Beziehung zwischen Perfusionsdruck und Fluss, die Reaktionen der Spiralarterien auf vasoaktive Stimuli und die Auswirkungen der myometrialen Kontraktionen. Darüber hinaus müssen die besonderen Wirkungen lokaler Anästhetika berücksichtigt werden.
Druck-Fluss-Beziehung
Wenn man die Veränderungen des UBF als Folge der Verringerung des Perfusionsdrucks während der Myom-Trial-Ruhe beobachtet, kann man eine geradlinige Beziehung mit einer Steigung von eins entwickeln (Abb. 5). Dies spiegelt die stark dilatierte Natur des Plazentagefäßsystems wider und zeigt, dass der PBF fast im gleichen Verhältnis wie der Perfusionsdruck abnimmt. Da der uterine Venendruck unter den meisten Umständen ziemlich konstant ist, können Änderungen des systemischen Blutdrucks (MBP) zur Annäherung an die PBF-Änderungen verwendet werden. Das heißt, dass ein 25-prozentiger Abfall des mittleren arteriellen Drucks eine 25-prozentige Abnahme des PBF verursachen würde. Solche Messungen sollten jedoch in der seitlichen Dekubitus-Position durchgeführt werden, da der Druck des graviden Uterus auf die Aorta allein den Blutdruck im Beckenbereich nachweislich unter den in der Arteria brachialis beobachteten Wert senkt.
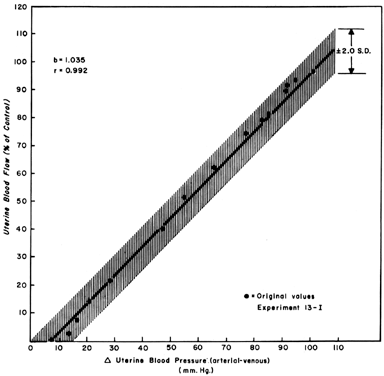 Abb. 5. Druck-Fluss-Regressionslinie, ermittelt aus gepoolten proportionalen Daten bei trächtigen Mutterschafen. Da die Beziehung linear ist, variiert der uterine Blutfluss mit und proportional zu jeder Änderung des Perfusionsdrucks (aus Greiss FC, Jr: Am J Obstet Gynecol 96:41, 1966.)
Abb. 5. Druck-Fluss-Regressionslinie, ermittelt aus gepoolten proportionalen Daten bei trächtigen Mutterschafen. Da die Beziehung linear ist, variiert der uterine Blutfluss mit und proportional zu jeder Änderung des Perfusionsdrucks (aus Greiss FC, Jr: Am J Obstet Gynecol 96:41, 1966.)
Reaktionen auf vasoaktive Stimuli
Da die Spiralarterien im Ruhezustand eine maximale Dilatation erreichen, haben gefäßerweiternde Mittel oder Stimuli nur eine geringe oder gar keine Wirkung, obwohl Rezeptoren für solche Mittel vorhanden sind. Die glatte Muskulatur dieser Gefäße reagiert jedoch äußerst empfindlich auf vasokonstriktorische Wirkstoffe oder Reize, und zwar stärker als die meisten anderen peripheren Gefäßbetten (Abb. 6). Das bedeutet, dass, obwohl der MPB als Reaktion auf die Stimulation durch ein peripher wirkendes vasopressorisches Medikament wie Phenylephrin ansteigen kann, der proportionale Anstieg des plazentaren Gefäßwiderstands (Ri) SO viel größer ist, dass der Nettoeffekt eine deutliche Abnahme des PBF ist. Solche Unterschiede in der Empfindlichkeit gegenüber Vasokonstriktoren müssen bei der Indikation für ein vasopressorisches Medikament berücksichtigt werden. Die Verwendung eines eher zentral wirkenden Medikaments wie Ephedrin führt, obwohl es eine geringe Plazenta-Vasokonstriktion verursacht, zu einer proportional größeren Verbesserung des MBP bei einem absoluten Anstieg des PBF.
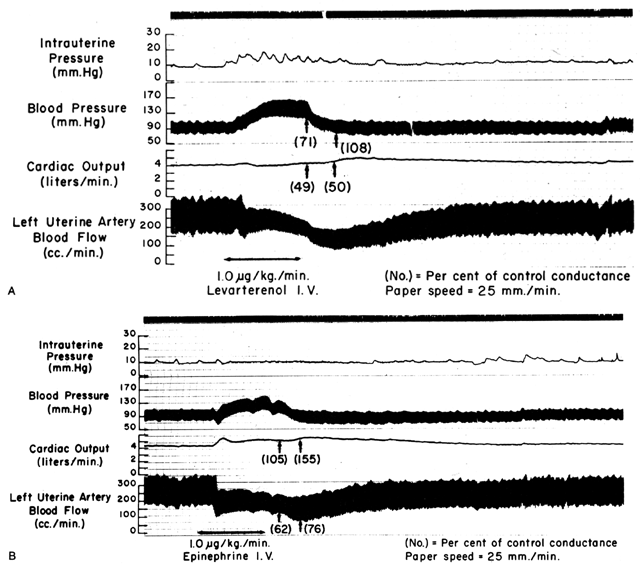 Abb. 6. Originalaufnahmen, die die Auswirkungen von intravenösem (A) Levarterenol (Noradrenalin) und (B) Epinephrin auf den mütterlichen Blutdruck, das Herzzeitvolumen und die uterine Durchblutung während der Schafschwangerschaft zeigen. Die proportionalen Veränderungen gegenüber den Kontrollwerten des systemischen und uterinen Leitwerts (dem Kehrwert des Widerstands) sind in Klammern angegeben. Man beachte, dass die Abnahme des uterinen Leitwerts (Anstieg des Widerstands) die Abnahme des systemischen Leitwerts bei anderen Wirkstoffen übersteigt. (Aus Greiss FC, Jr.: Obstet Gynecol 21:295, 1963. Mit freundlicher Genehmigung von Harper & Row, Publishers.)
Abb. 6. Originalaufnahmen, die die Auswirkungen von intravenösem (A) Levarterenol (Noradrenalin) und (B) Epinephrin auf den mütterlichen Blutdruck, das Herzzeitvolumen und die uterine Durchblutung während der Schafschwangerschaft zeigen. Die proportionalen Veränderungen gegenüber den Kontrollwerten des systemischen und uterinen Leitwerts (dem Kehrwert des Widerstands) sind in Klammern angegeben. Man beachte, dass die Abnahme des uterinen Leitwerts (Anstieg des Widerstands) die Abnahme des systemischen Leitwerts bei anderen Wirkstoffen übersteigt. (Aus Greiss FC, Jr.: Obstet Gynecol 21:295, 1963. Mit freundlicher Genehmigung von Harper & Row, Publishers.)
Myometriumkontraktionen
Myometriumkontraktionen wirken durch die beiden oben beschriebenen Mechanismen, die Erhöhung des Re und die Verringerung des Perfusionsdrucks, und verringern den PBF in direktem Verhältnis zur Intensität und Dauer jeder Kontraktion. Die Beziehung ist so präzise, dass eine Aufzeichnung des intrauterinen Drucks fast ein exaktes inverses Bild des PBF ist (Abb. 7). Eine Erhöhung der Kontraktionsfrequenz verringert den PBF während einer gegebenen Zeiteinheit, indem die Dauer der myometrialen Diastole verkürzt wird, also die Zeit, in der der PBF homöostatische Werte erreicht. Wenn außerdem der Interkontraktionstonus erhöht ist, wie bei einer Plazentaablösung, wird der PBF zwischen den Kontraktionen proportional reduziert. Radioangiographische Studien an Primaten und Frauen zeigen, dass während des Höhepunkts der myometrialen Kontraktionen durchschnittlicher Intensität die PBF aufhört.25 Es ist daher offensichtlich, dass die Wehen für den Fötus von Natur aus stressig sind, da die durchschnittliche Menge an PBF, die die fetalen Zotten pro Zeitspanne durchblutet, mit zunehmender Häufigkeit und Intensität der Uteruskontraktionen abnimmt.
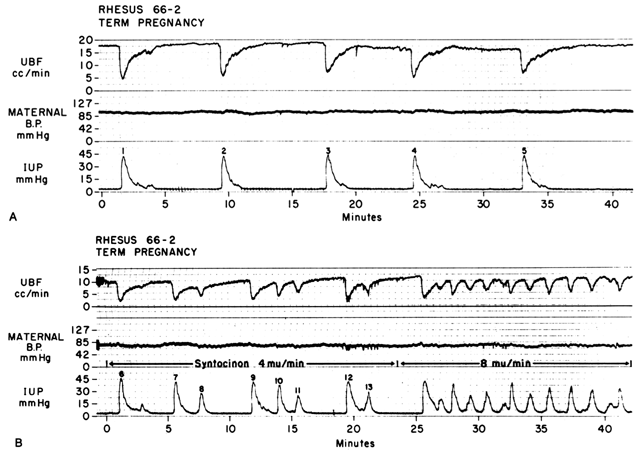 Abb. 7. A. Beziehung zwischen Uterusdurchblutung (UBF) und Uteruskontraktionen während spontaner Wehen bei einem Rhesusaffen. Man beachte die umgekehrte Bildbeziehung, den starken Abfall des UBF zu Beginn der Wehen und die langsamere Erholung des UBF von den Basalwerten. Die UBF erreichte nur während des „normalen“ Tonus wieder die Basalwerte. B. Auswirkung einer erhöhten Wehenfrequenz auf die UBF durch Oxytocin-Stimulation der in A gezeigten spontanen Wehen. Die UBF-Rate, die zwischen den Kontraktionen erreicht wird, ist abhängig von der Intensität der vorangegangenen Kontraktion und der Dauer der Phase des Normaltonus. Nach den Kontraktionen 7 und 12 war die Erholung des Flusses unvollständig, weil die nachfolgende Kontraktion ohne eine normale Tonusphase stattfand.(Aus Greiss FC, Jr, Anderson SG: Clin Obstet Gynecol 11:96, 1968. Mit freundlicher Genehmigung von Harper & Row, Publishers.)
Abb. 7. A. Beziehung zwischen Uterusdurchblutung (UBF) und Uteruskontraktionen während spontaner Wehen bei einem Rhesusaffen. Man beachte die umgekehrte Bildbeziehung, den starken Abfall des UBF zu Beginn der Wehen und die langsamere Erholung des UBF von den Basalwerten. Die UBF erreichte nur während des „normalen“ Tonus wieder die Basalwerte. B. Auswirkung einer erhöhten Wehenfrequenz auf die UBF durch Oxytocin-Stimulation der in A gezeigten spontanen Wehen. Die UBF-Rate, die zwischen den Kontraktionen erreicht wird, ist abhängig von der Intensität der vorangegangenen Kontraktion und der Dauer der Phase des Normaltonus. Nach den Kontraktionen 7 und 12 war die Erholung des Flusses unvollständig, weil die nachfolgende Kontraktion ohne eine normale Tonusphase stattfand.(Aus Greiss FC, Jr, Anderson SG: Clin Obstet Gynecol 11:96, 1968. Mit freundlicher Genehmigung von Harper & Row, Publishers.)
Lokalanästhetika
Diese Medikamente können sowohl direkt, wie nach versehentlicher intravaskulärer Injektion, als auch indirekt, als Folge der Lähmung der autonomen Nerven, die den normalen Gefäßtonus aufrechterhalten, auf das Gefäßbett wirken. In den meisten Organen haben intravaskuläre Injektionen keine signifikanten Auswirkungen auf den Gefäßwiderstand. Die Gefäße der Gebärmutter und der Plazenta reagieren jedoch auf solche Stimuli mit einer erheblichen Vasokonstriktion. Darüber hinaus wird das Myometrium durch solche Medikamente in unterschiedlichem Maße stimuliert (Abb. 8). Alleine oder zusammen vermindern diese Reaktionen den PBF. Nach einer parazervikalen Blockanästhesie, die während der Wehen verabreicht wird, kann eine verzögerte fetale Bradykardie auftreten. Die beste Hypothese zur Erklärung der fetalen Reaktion ist, dass Lokalanästhetika in die Nähe der Uterusarterien injiziert werden und dass sie aufgrund ihrer ausgezeichneten Penetranz die Arterienwände durchdringen, um ihre uterinen Wirkungen zu entfalten, die den PBF verringern und eine fetale Hypoxie verursachen.
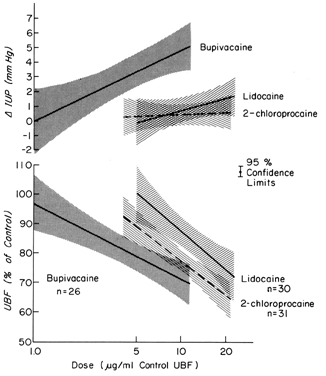 Abb. 8. Dosis-Wirkungs-Beziehungen von Lokalanästhetika, die direkt in die Uterusarterie verabreicht werden, zur uterinen vaskulären Leitfähigkeit und zum intrauterinen Druck während der Trächtigkeit von Schafen. Die effektiven Dosen liegen innerhalb der Bereiche, die bei Föten während der Bradykardie nach parazervikaler Blockanästhesie beobachtet werden (aus Fishburne JI, Jr et al: Responses of the gravid uterine vasculature to arterial levels of local anesthetic agents. Am J Obstet Gynecol 133:753, 1979. Mit freundlicher Genehmigung der C. V. Mosby Company.)
Abb. 8. Dosis-Wirkungs-Beziehungen von Lokalanästhetika, die direkt in die Uterusarterie verabreicht werden, zur uterinen vaskulären Leitfähigkeit und zum intrauterinen Druck während der Trächtigkeit von Schafen. Die effektiven Dosen liegen innerhalb der Bereiche, die bei Föten während der Bradykardie nach parazervikaler Blockanästhesie beobachtet werden (aus Fishburne JI, Jr et al: Responses of the gravid uterine vasculature to arterial levels of local anesthetic agents. Am J Obstet Gynecol 133:753, 1979. Mit freundlicher Genehmigung der C. V. Mosby Company.)
