 Open-Access-Artikel
Open-Access-Artikel Dieser Open-Access-Artikel ist lizenziert unter einer
Dieser Open-Access-Artikel ist lizenziert unter einer
Creative Commons Attribution 3.0 Unported Licence
Guoqiang Liua, Yongsan Liab, Lei Yangd, Yen Weia, Xing Wangb, Zhiming Wangc und Lei Tao *a
*a
aKey Laboratory of Bioorganic Phosphorus Chemistry & Chemical Biology (Ministry of Education), Department of Chemistry, Tsinghua University, Beijing 100084, P. R. China. E-mail: [email protected]
bThe State Key Laboratory of Chemical Resource Engineering, Beijing University of Chemical Technology, Beijing 100029, P. R. China
cCollege of Pharmaceutical Science, Zhejiang Chinese Medical University, Hangzhou, Zhejiang 311400, P. R. China
dCancer Institute & Hospital, Peking Union Medical College & Chinese Academy of Medical Science, Beijing 100021, P. R. China
Erstveröffentlichung am 27. März 2017
Polyethylenglykol (PEG)-Derivate sind in der biobezogenen Forschung weit verbreitet. Allerdings haben PEG-Oligomere (mit unterschiedlichen Molekulargewichten) oder PEG-basierte Monomere (mit unterschiedlichen Kettenendgruppen) tatsächlich unterschiedliche chemische und physikalische Eigenschaften, die zu einer potenziellen Toxizität führen können. In dieser Arbeit wurde die Zytotoxizität einer Reihe von PEG-Derivaten (Oligomere und Monomere) unter Verwendung menschlicher Gebärmutterhalskrebszellen (HeLa) und einer aus Mäusen gewonnenen Fibroblasten-Zelllinie (L929) als Modellzellen gemessen. Die meisten PEG-Oligomere sind für beide Zelltypen sicher, mit Ausnahme von Triethylenglykol (TEG), das in hohen Konzentrationen für L929-Zellen toxisch ist. Andererseits zeigten Monomere auf PEG-Basis, darunter Poly(ethylenglykol)methyletheracrylat (mPEGA) und Poly(ethylenglykol)methylethermethacrylat (mPEGMA), deutliche Zytotoxizität. In der Folge wurden diese toxischen PEG-Derivate untersucht, um die verschiedenen Mechanismen ihrer Toxizität aufzudecken. Die vorliegende Untersuchung bewertete die Zytotoxizität von PEG-Derivaten und wies auf die potenzielle Gefahr von „sicheren“ Biomaterialien hin, was eine nützliche Referenz für die Verwendung von PEG-Derivaten in der zukünftigen biomedizinischen Forschung darstellen könnte.
Einführung
Polyethylenglykol (PEG) wurde aufgrund seiner herausragenden Eigenschaften wie zufriedenstellende Sicherheit, Biokompatibilität, Hydrophilie usw. in verschiedenen medizinischen Bereichen eingesetzt. So wurde PEG beispielsweise in einigen von der Food and Drug Administration zugelassenen Abführmitteln verwendet, da es die Feuchtigkeit hervorragend zurückhält und schmiert.1-3 Ein weiteres Beispiel ist die Modifizierung von Arzneimitteln/Proteinen mit PEG (PEGylierung), die die Wasserlöslichkeit und die Umlaufhalbwertszeit von Arzneimitteln wirksam verbessern kann,4,5 was zu einer verbesserten Sicherheit und Therapiewirkung führt. Derzeit entwickelt sich die PEGylierung zu einer der attraktivsten Biotechnologien, die sowohl in der Grundlagenforschung als auch auf dem Markt große Erfolge erzielt.6-11 Inzwischen wurden viele PEG-Derivate als hervorragende Ausgangsmaterialien für die Synthese einer Reihe neuer polymerer Materialien für Bioanwendungen verwendet.12 So wurde beispielsweise ein lineares PEG als difunktionalisiertes PEG (DF-PEG) modifiziert, das zur schnellen Herstellung eines interessanten selbstheilenden Hydrogels verwendet werden kann.13,14 Einige PEG-Oligomere wurden zur Modifizierung der Oberfläche von anorganischen Nanopartikeln verwendet, um die Wasserlöslichkeit zu verbessern und die Toxizität dieser anorganischen Materialien zu verringern.15-17 Einige handelsübliche Monomere auf PEG-Basis wie Poly(ethylenglykol)methyletheracrylat (mPEGA) und Poly(ethylenglykol)methylethermethacrylat (mPEGMA) wurden zur Herstellung verzweigter Polymere für die anschließende Konjugation von Proteinen, die Selbstmontage, die Verabreichung von Arzneimitteln usw. verwendet.18-27
Obwohl PEG normalerweise als nahezu ungiftig gilt, wurden von Forschern einige unsichere Probleme von PEG mit niedrigem Molekulargewicht festgestellt. Smyth et al. berichteten über die chronische orale Toxizität von PEG-Oligomeren (Mn ∼ 200) bei Ratten,28,29 und auch bei Affen wurden nachteilige Ergebnisse beobachtet,30 was auf potenzielle Sicherheitsprobleme bei diesen „sicheren“ Materialien hindeutet. In Anbetracht der breiten Verwendung von PEG-Derivaten in der Forschung ist daher die systematische Untersuchung der Zytotoxizität dieser PEG-Oligomere und PEG-basierten Monomere notwendig und wichtig für ihre weitere Anwendung in bioverwandten Bereichen (Schema 1).
In der vorliegenden Arbeit wurde die Zytotoxizität einiger PEG-Oligomere (mit unterschiedlichen Molekulargewichten) und kommerzieller PEG-basierter Monomere (mit unterschiedlichen Kettenendgruppen) für menschliche Gebärmutterhalskrebszellen (HeLa) und eine von Mäusen abgeleitete Fibroblasten-Zelllinie (L929) untersucht. Die molekulargewichtsabhängige Zytotoxizität von PEG-Oligomeren wurde beobachtet, und die unterschiedlichen Zytotoxizitätsmechanismen von PEG-Oligomeren und PEG-basierten Monomeren wurden zum ersten Mal aufgedeckt. Diese Informationen über die Zytotoxizität von PEG-Derivaten könnten wertvolle Hinweise für die Auswahl von PEG als Ausgangsmaterial und die Entwicklung von Reinigungsrouten zur Herstellung biokompatibler PEG-basierter Materialien für weitere biomedizinische Anwendungen sein.
Materialien und Methoden
2.1 Chemikalien
Triethylenglykol (TEG, 97%, HEOWNS), PEG-400 (Mn ∼ 400, TCI), PEG-1000 (Mn ∼ 1000, Jiangsu Haitian Petrochemical Works), PEG-2000 (Mn ∼ 2000, SCRC), PEG-4000 (Mn ∼ 4000, SCRC), Poly(ethylenglykol)methyletheracrylat 480 (mPEGA-480, Mn ∼ 480, Sigma-Aldrich), Poly(ethylenglykol)methylethermethacrylat 500 (mPEGMA-500, Mn ∼ 500, Sigma-Aldrich) und Poly(ethylenglykol)methylethermethacrylat 950 (mPEGMA-950, Mn ∼ 950, Sigma-Aldrich) wurden direkt und ohne weitere Aufreinigung verwendet.
Humane Gebärmutterhalskrebszellen (HeLa) und eine von Mäusen stammende Fibroblasten-Zelllinie (L929) wurden von der American Type Culture Collection (ATCC) erworben. Dulbecco’s modified eagle medium (DMEM, Corning-Cellgro), Phosphatgepufferte Kochsalzlösung (PBS, pH ∼ 7,2-7,4, 0,01 M, Solarbio), fötales Rinderserum (FBS, Gibco), Roswell Park Memorial Institute 1640 culture medium (RPMI 1640 culture medium, Gibco), Penicillin-Streptomycin-Lösung (Gibco), Trypsin-EDTA (Gibco, 0.25%), 4-(3-(2-Methoxy-4-nitrophenyl)-2-(4-nitrophenyl)-2H-tetrazol-3-ium-5-yl)benzol-1,3-disulfonat (CCK-8, Beyotime), 2,7-Dichlordihydrofluorescein-diacetat (DCFH-DA, Beyotime), oxidiertes Glutathion (GSSG, Beyotime), Nicotinamid-Adenin-Dinukleotid-Phosphat (NADPH, Beyotime), 5,5′-Dithiobis-(2-Nitrobenzoesäure) (DTNB, Beyotime), Fluoresceindiacetat (FDA, Sigma) und Propidiumiodid (PI, 94%, Sigma) wurden wie gekauft verwendet.
2.2 Zellkultur
Die Zellkultur wurde in einem 37 °C-Inkubator mit 5% CO2 gehalten, das Kulturmedium wurde alle ein bis zwei Tage gewechselt, um das exponentielle Wachstum der Zellen aufrechtzuerhalten. HeLa-Zellen wurden aus Gebärmutterhalskrebszellen gewonnen und in DMEM-Medium kultiviert, das mit 10 % fötalem Rinderserum (FBS) und 1 % Penicillin und Streptomycin ergänzt wurde. L929-Zellen wurden von Mäusen gewonnen und in RPMI 1640-Medium kultiviert, das mit 10 % fötalem Rinderserum (FBS) und 1 % Penicillin und Streptomycin ergänzt wurde.
2.3 Zytotoxizitätsanalyse
Die Ergebnisse wurden als Mittelwert ± Standardabweichung (SD) dargestellt, und die Werte der halben maximalen Hemmkonzentration 50% (IC50) der PEG-Derivate wurden mit SPSS 15.0 berechnet.
Gemäß unseren früheren Arbeiten32,33 konnten Fluoresceindiacetat (FDA) und Propidiumiodid (PI) als schnelle und bequeme Doppelfärbemethode zur Beobachtung der Zelllebensfähigkeit verwendet werden. L929-Zellen wurden in einer 24-Well-Platte mit einer Dichte von ∼5 × 104 Zellen pro ml ausgesät. Nach der Anheftung wurden die Zellen mit PBS gewaschen und 24 Stunden lang mit unterschiedlichen Konzentrationen von PEG-Derivaten im Kulturmedium kultiviert. Anschließend wurde eine PBS-FDA-PI-Mischlösung (FDA: 3 μg mL-1; PI: 3 μg mL-1) zugegeben, und die 24-Well-Platte wurde 15 Minuten lang bei 37 °C inkubiert. Ein Fluoreszenzmikroskop (Leica Deutschland) wurde verwendet, um die lebenden und toten Zellen unter 450-490 nm bzw. 515-560 nm Bandpass-Anregungsfiltern (I3 und N2.1) zu beobachten (100 W Quecksilberlampe).
Kurz gesagt, wurden L929-Zellen in einer 24-Well-Platte ausgesät und in 0,5 mL Kulturmedium mit verschiedenen Konzentrationen von TEG (A, A′) für 1 h inkubiert (Abb. 1). Die Vertiefungen A1-A6 wurden zur Messung der Gesamtmenge an Glutathion (GSH + GSSG) verwendet, während die Vertiefungen A′1-A′6 zur Messung der Menge an oxidiertem Glutathion (GSSG) in Gegenwart von TEG verwendet wurden. Nach 1 Stunde wurden die Zellen durch Trypsin-Verdau und Zentrifugation (1000 rpm, 5 min) gesammelt. Anschließend wurde eine dreifache Menge Proteinentfernungslösung (50 mg mL-1) hinzugefügt, um die verrauschten Proteine zu entfernen. Nach drei schnellen Einfrier-/Auftauzyklen in flüssigem Stickstoff und einem 37 °C warmen Wasserbad wurde die Suspension 5 Minuten lang in den Kühlschrank (4 °C) gestellt, und die Proben des Zellüberstands wurden nach Zentrifugation (10 000 U/min, 10 min) gewonnen. Die Proben aus den Vertiefungen A1-A6 wurden für die Messung des Gesamtglutathionspiegels (GSH + GSSG) verwendet. NADPH-Lösung (0,5 mg mL-1) wurde hinzugefügt, um das gesamte Glutathion zu GSH zu reduzieren, dann wurde 5,5′-Dithiobis-(2-nitrobenzoesäure) (DTNB) verwendet, um das GSH zu oxidieren, und die veränderte Absorption bei 405 nm wurde mit einem Mikroplattenlesegerät (VICTOR™ X3 PerkinElmer 2030 Multilabel Plate Reader) aufgezeichnet.35,36 Proben aus A′1-A′6-Vertiefungen wurden zur Messung des Gehalts an oxidiertem Glutathion (GSSG) verwendet. Durch die Verwendung der GSH-Entfernerlösung blieb nur GSSG in der Probenlösung zurück. Die Proben wurden nach der gleichen Methode wie oben analysiert, um den GSSG-Gehalt zu messen. Die Gesamtmenge an Glutathion und die Menge an oxidiertem Glutathion wurden gesammelt, um den Gehalt an reduziertem Glutathion zu berechnen, während der GSH-Gehalt von Zellen in reinem Kulturmedium als Kontrolle verwendet wurde. Die Ergebnisse wurden als Mittelwert ± SD angegeben.
000 U/min, 10 min) gewonnen. Die Proben aus den Vertiefungen A1-A6 wurden für die Messung des Gesamtglutathionspiegels (GSH + GSSG) verwendet. NADPH-Lösung (0,5 mg mL-1) wurde hinzugefügt, um das gesamte Glutathion zu GSH zu reduzieren, dann wurde 5,5′-Dithiobis-(2-nitrobenzoesäure) (DTNB) verwendet, um das GSH zu oxidieren, und die veränderte Absorption bei 405 nm wurde mit einem Mikroplattenlesegerät (VICTOR™ X3 PerkinElmer 2030 Multilabel Plate Reader) aufgezeichnet.35,36 Proben aus A′1-A′6-Vertiefungen wurden zur Messung des Gehalts an oxidiertem Glutathion (GSSG) verwendet. Durch die Verwendung der GSH-Entfernerlösung blieb nur GSSG in der Probenlösung zurück. Die Proben wurden nach der gleichen Methode wie oben analysiert, um den GSSG-Gehalt zu messen. Die Gesamtmenge an Glutathion und die Menge an oxidiertem Glutathion wurden gesammelt, um den Gehalt an reduziertem Glutathion zu berechnen, während der GSH-Gehalt von Zellen in reinem Kulturmedium als Kontrolle verwendet wurde. Die Ergebnisse wurden als Mittelwert ± SD angegeben.
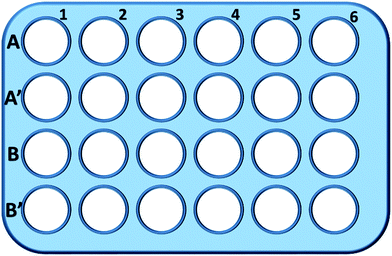
Mulden in Linie B und B′ wurden verwendet, um die Gesamtmenge an GSH bzw. GSSG in Gegenwart von mPEGA-480 durch dasselbe Verfahren zu testen.
Ergebnisse und Diskussion
3.1 Untersuchung der Zelllebensfähigkeit
Bei Verwendung der HeLa-Zelle (ein Modell für Krebszellen) (Abb. 2A) konnte die Zytotoxizität aller PEG-Oligomere bei niedrigen Konzentrationen (≤5 mg mL-1) vernachlässigt werden. Mit steigender Konzentration (≥10 mg mL-1) wurde die molekulargewichtsabhängige Zytotoxizität der PEG-Proben beobachtet. Triethylenglykol (TEG) zeigte bei einer Konzentration von über 10 mg mL-1 eine deutliche Zytotoxizität (p < 0,05; im Gegensatz zu allen anderen Oligomeren bei einer Konzentration von über 5 mg mL-1), und der IC50-Wert von TEG für HeLa-Zellen wurde mit 19,8 mg mL-1 berechnet. Andere PEG-Oligomere (Mn ∼ 400-4000) zeigten ebenfalls eine geringe Zytotoxizität.
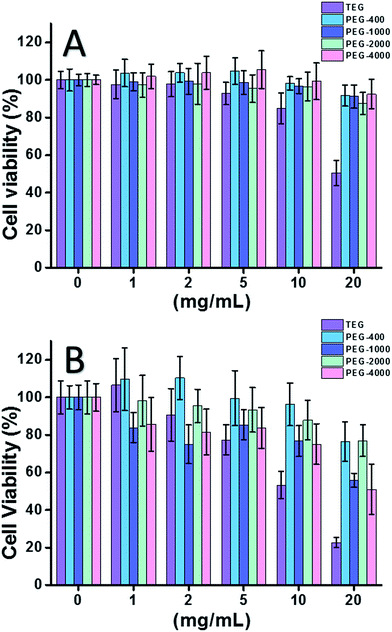
Die Zytotoxizität von PEG-Oligomeren auf L929-Zellen (ein Modell für normale Zellen) wurde ebenfalls bewertet (Abb. 2B). Die Lebensfähigkeit der Zellen nahm erwartungsgemäß mit steigender PEG-Konzentration ab. Neben TEG zeigten auch einige PEG-Oligomere (PEG-1000, PEG-4000), die für HeLa-Zellen unbedenklich sind, eine nachweisbare Zytotoxizität. Die IC50-Werte von TEG, PEG-1000 und PEG-4000 wurden mit 12,4, 22,5 bzw. 20,0 mg mL-1 für L929-Zellen berechnet, was ebenfalls auf die molekulargewichtsabhängige Zytotoxizität von PEG-Oligomeren hinweist.
Die obigen Ergebnisse deuten darauf hin, dass HeLa-Zellen aufgrund der zähen Vitalität von Krebszellen eine bessere Toleranz gegenüber PEG-Oligomeren aufweisen als L929-Zellen, und das TEG hat eine viel höhere Zytotoxizität als andere PEG-Oligomere mit höheren Molekulargewichten (p < 0,05; im Gegensatz zu jedem anderen Oligomer, wenn die Konzentration über 5 mg mL-1 liegt). Es ist festzustellen, dass die aktuelle Forschung die mäßige Zytotoxizität von PEG-1000 und PEG-4000 für L929-Zellen und die fast nicht vorhandene Zytotoxizität von PEG-400 und PEG-2000 gezeigt hat, was im Gegensatz zu dem allgemeinen Eindruck steht, dass PEG mit hohem Molekulargewicht biokompatibler sein sollten als ihre Gegenstücke mit niedrigem Molekulargewicht. Obwohl der Grund für die Zytotoxizität von PEG noch immer nicht klar ist, scheinen PEG-400 und PEG-2000 die bessere Wahl für die Herstellung biokompatibler Materialien zu sein.
Wenn mPEGMA-500 getestet wurde, nahm die Zelllebensfähigkeit sowohl von HeLa-Zellen als auch von L929-Zellen mit steigender Konzentration von mPEGMA-500 ab (Abb. 3A), und es wurde kein offensichtlicher Unterschied zwischen den beiden Zelltypen festgestellt. Die IC50-Werte von mPEGMA-500 betragen 4,7 mg mL-1 für HeLa-Zellen und 5,3 mg mL-1 für L929-Zellen nach 24-stündiger Kultur, was auf eine deutlichere Zytotoxizität von mPEGMA-500 als die oben genannten PEG-Oligomere hinweist und bedeutet, dass die Kettenendgruppen der PEG-Derivate für ihre Toxizität entscheidend sind. Als mPEGMA-950, ein anderes Methacrylat auf PEG-Basis mit derselben Kettenendgruppe, aber höherem Molekulargewicht, mit demselben Verfahren getestet wurde (Abb. 3B), wurde eine viel geringere Zytotoxizität von mPEGMA-950 für HeLa-Zellen oder L929-Zellen beobachtet (p < 0,05; wenn die Konzentration über 2 mg mL-1 liegt), die IC50-Werte von mPEGMA-950 betragen 20,8 mg mL-1 für HeLa-Zellen und 21.7 mg mL-1 für L929-Zellen nach 24-stündiger Kultur, was ebenfalls die molekulargewichtsabhängige Zytotoxizität von Methacrylat auf PEG-Basis belegt.
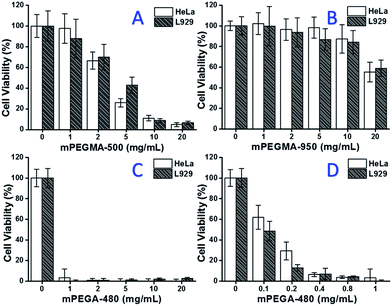
Außerdem wurde auch das PEG-basierte Acrylat mPEGA-480 getestet. Obwohl der Unterschied zwischen mPEGA-480 und mPEGMA-500 nur eine Methylgruppe am Kettenende ist, zeigte mPEGA-480 akute Zytotoxizität (Abb. 3C). Mehr als 95 % der Zellen verloren selbst bei 1 mg mL-1 mPEGA-480 im Kulturmedium ihre Lebensfähigkeit. Daher müssen zusätzliche Experimente mit niedrigeren Konzentrationen durchgeführt werden, um die Zytotoxizität zu bestimmen (Abb. 3D), und die IC50-Werte von mPEGA-480 wurden mit 0,2 mg mL-1 für HeLa-Zellen und 0,1 mg mL-1 für L929-Zellen nach 24-stündiger Kultur berechnet.
Die Zellviabilitätsexperimente bestätigten, dass sowohl die Kettenendgruppen als auch das Molekulargewicht wichtige Einflussfaktoren für die Zytotoxizität von PEG-Derivaten sind, und die PEG-basierten Monomere zeigten im Vergleich zu den PEG-Oligomeren eine deutlich stärkere Zytotoxizität.
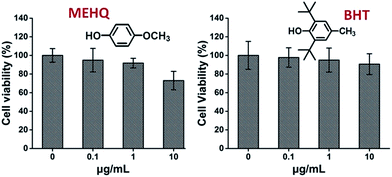
Die Zytotoxizität der Inhibitoren in den PEG-basierten Monomeren, Hydrochinonmethylether (MEHQ, 100 ppm in mPEGA) und butyliertes Hydroxytoluol (BHT, 300 ppm in mPEGMA), wurde ebenfalls untersucht (Abb. 4), und die L929-Zellen behielten eine hohe Lebensfähigkeit (≥90%) bei niedrig konzentrierten Inhibitoren (≤1 μg mL-1). Es gibt 0,1 μg mL-1 MEHQ in 1 mg mL-1 mPEGA-480 und 3 μg mL-1 BHT in 10 mg mL-1 mPEGA-500, während mPEG-480 und mPEGMA-500 bei diesen Konzentrationen offensichtliche Zytotoxizität zeigten. Somit scheinen die Spuren von Inhibitoren in PEG-basierten Monomeren einen vernachlässigbaren Einfluss auf die Zytotoxizität der Monomere zu haben.
3.2 Beobachtung der Zellmorphologie
Zur direkten Bewertung der Zytotoxizität der PEG-Derivate für L929-Zellen wurde die Beobachtung mit dem optischen Mikroskop verwendet. Die optischen Bilder von L929-Zellen, die 24 Stunden lang 20 mg mL-1 TEG und 0,1 mg mL-1 mPEGA ausgesetzt waren, sind in Abb. 5A bzw. B dargestellt.
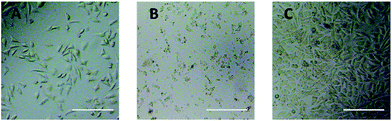
Nach der Inkubation mit 20 mg mL-1 TEG für 24 h behielten die Zellen eine ähnliche Morphologie (Abb. 5A) wie die Kontrollgruppe (Abb. 5C, Zellen in reinem Kulturmedium), aber die Zellzahl nahm drastisch ab, was auf die Zytotoxizität von TEG in hoher Konzentration hindeutet, die zum Absterben und anschließenden Ablösen der Zellen vom Boden der Mikroplatte führte. Abb. 5B zeigt die Morphologie der L929-Zellen nach Inkubation mit 0,1 mg mL-1 mPEGA-480. Fast alle Zellen verloren ihre normale Morphologie, was auf die akute Zytotoxizität von mPEGA-480 selbst bei einer so niedrigen Konzentration hindeutet.
Zusätzlich wurden die Zellen auch mit Fluorescein gefärbt. Die FDA/PI-Doppelfärbung ist ein schnelles, einfaches und gleichzeitiges Verfahren zur Beobachtung lebender und toter Zellen.43 FDA kann in die gesamte Zelle eindringen und sich in den Zellen anreichern, daher ist eine vollständige Zellmembran erforderlich, um das Austreten von Fluorescein aus der Zelle zu verhindern. Im Gegensatz dazu kann PI die intakte Zellmembran nicht durchdringen, kann aber den Kern toter Zellen anfärben, indem es die beschädigte Zellmembran durchdringt. Wie Abb. 6 zeigt, weisen L929-Zellen, die mit 20 mg mL-1 TEG inkubiert wurden, nach der FDA-Färbung (Abb. 6b) im Vergleich zur Kontrolle (Abb. 6a) weniger lebensfähige Zellen auf, und nach der PI-Färbung sind mehr tote Zellen zu beobachten (Abb. Die akute Zytotoxizität von mPEGA-480 wurde auch nach dem FDA/PI-Doppelfärbeverfahren beobachtet, wobei nach der Inkubation von Zellen mit 0,1 mg mL-1 mPEG-480 für 24 Stunden kein grünes Signal identifiziert werden konnte (Abb. 6c und c′′).
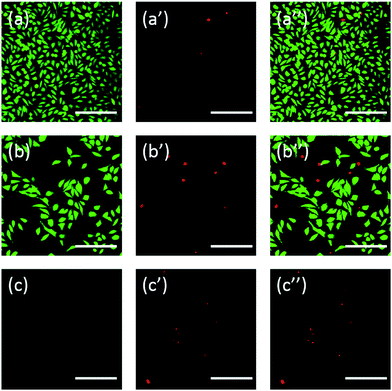
Sowohl optische als auch fluoreszierende Bilder zeigten intuitiv die Zytotoxizität dieser PEG-Derivate, was die Schlussfolgerung aus den CCK-8-Tests weiter untermauert. Es wurde festgestellt, dass mPEGA-480 durch den FDA/PI-Doppelfärbetest toxischer erschien, was darauf zurückzuführen ist, dass der FDA/PI-Doppelfärbetest die Vollständigkeit der lebenden/toten Zellmembran unterscheidet, während der CCK-8-Test die Aktivität der Dehydrogenase in den Mitochondrien nachweist, was darauf hindeutet, dass der FDA/PI-Färbetest eine hervorragende Ergänzung des CCK-8-Tests ist, um mehr Details über den Zellstatus zu liefern.
3.3 Mechanismus-Studie
Nach den Experimenten zur Zelllebensfähigkeit wurden die IC50-Werte der PEG-Oligomere und der PEG-basierten Monomere für HeLa- und L929-Zellen nach 24-stündiger Kultur berechnet und zusammengefasst (Tabelle 1), was darauf hindeutet, dass die PEG-basierten Monomere viel toxischer für die Zellen sind als die PEG-Oligomere, und das mPEGA hat die höchste Zytotoxizität. Die Bildung von ROS und der Rückgang von GSH in den Zellen, zwei Hauptmechanismen der Zytotoxizität, wurden daher analysiert, um den möglichen Grund für die Zytotoxizität zu untersuchen.
| TEG | PEG-400 | PEG-1000 | PEG-2000 | PEG-4000 | mPEGMA-500 | mPEGMA-950 | mPEGA-480 | |
|---|---|---|---|---|---|---|---|---|
| HeLa-Zellen | 19.8 | 32.5 | 36.2 | 38.2 | 29.6 | 4.7 | 20.8 | 0.2 |
| L929 Zellen | 12.4 | 24.7 | 22.5 | 28.7 | 20.0 | 5.3 | 21.7 | 0.1 |
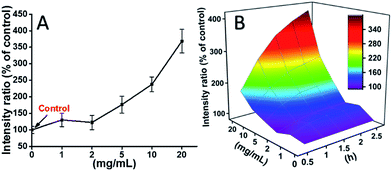
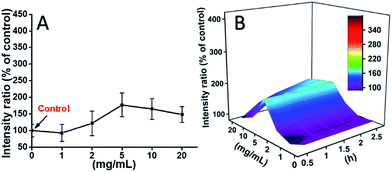
L929-Zellen wurden mit TEG inkubiert, und die ROS-Konzentrationen zu verschiedenen Zeitpunkten (0, 0,5, 1,0, 1,5, 2 Stunden) wurden entsprechend unseren früheren Berichten ermittelt und in Abb. 7 dargestellt. In Abb. 7A sind beispielsweise die ROS-Konzentrationen nach 2-stündiger Inkubation mit verschiedenen TEG-Konzentrationen dargestellt. Es ist deutlich zu sehen, dass die ROS-Konzentrationen bei niedriger TEG-Konzentration (≤2 mg mL-1) stabil bleiben, aber signifikant ansteigen, wenn die TEG-Konzentration höher als 2 mg mL-1 ist, was mit dem Ergebnis des Zellviabilitätsexperiments in Abb. 2B übereinstimmt. In ähnlicher Weise wurden die Abbildungen der ROS-Konzentration gegenüber der TEG-Konzentration zu verschiedenen Zeitpunkten gezeichnet und zu einer 3D-Karte zusammengefügt (Abb. 7B). Die maximale ROS-Konzentration wurde nach 2 Stunden mit 20 mg mL-1 TEG festgestellt, wobei die ROS-Konzentration im Vergleich zur Kontrolle (ROS-Konzentration = 100) um ca. 400 % erhöht war, was zu der hellsten Fluoreszenzintensität führte. Diese Ergebnisse deuten darauf hin, dass die Erzeugung von ROS ein möglicher Mechanismus für die Zytotoxizität von TEG ist, und dass der durch TEG induzierte hohe ROS-Spiegel der Hauptgrund für die Zellapoptose sein könnte.
Die durch mPEGA-480 nach 2 h induzierten ROS-Werte wurden ebenfalls getestet (Abb. 8A). Im Gegensatz zu TEG verursachte mPEGA keinen schnellen Anstieg der ROS in den Zellen, nur ∼170% ROS-Anstieg im Vergleich zur Kontrolle wurde als Maximum beobachtet. Die 3D-ROS-Konzentration im Vergleich zur mPEGA &-Zeit (Abb. 8B) zeigte die durch mPEGA-480 induzierte ROS-Konzentration als Welle, und der Scheitelpunkt erschien bei moderater Konzentration von mPEGA (5 mg mL-1), wobei keine signifikante ROS-Erzeugung beobachtet werden konnte, was darauf hindeutet, dass die ROS-Erzeugung nur teilweise zur Zytotoxizität von mPEGA-480 beitragen könnte.
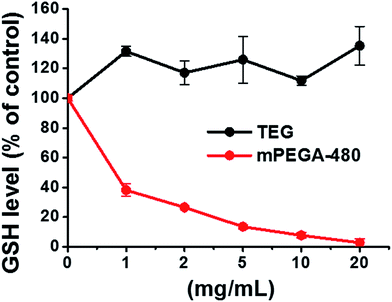
Die reduzierende Thiolgruppe in GSH ist eine wichtige Antioxidationsquelle in Organismen. Ein möglicher Mechanismus für die Zytotoxizität von mPEGA-480 wird auf die Michael-Additionsreaktion zwischen der Thiolgruppe und der Vinylbindung zurückgeführt, die zu einer Störung des intrazellulären Redox-Gleichgewichts und zur Apoptose der Zellen führt. Frühere Forschungen haben gezeigt, dass die Michael-Addition zwischen Thiol und Acrylat viel schneller abläuft als die zwischen Thiol und Methacrylat,52 was ein Grund für die unterschiedliche akute Zytotoxizität von mPEGA-480 und mPEGMA-500 sein könnte.
Schlussfolgerungen
Die Zytotoxizität von PEG-Oligomeren und Monomeren auf PEG-Basis für HeLa-Zellen und L929-Zellen wurde zum ersten Mal untersucht. Die konzentrationsabhängige Zytotoxizität von PEG-Oligomeren und PEG-basierten Monomeren wurde bestätigt und als IC50-Werte für HeLa-Zellen und L929-Zellen angegeben. PEG-400 und PEG-2000 scheinen in der aktuellen Forschung fast nicht zytotoxisch zu sein. PEG-1000, PEG-4000 und mPEGMA-950 zeigten insbesondere bei hohen Konzentrationen eine mäßige Zytotoxizität. TEG und mPEGMA-500 zeigten signifikante Zytotoxizität, und mPEGA-480 zeigte akute Zytotoxizität. Darüber hinaus beeinflussen auch die Zelltypen die Ergebnisse der Zytotoxizitätsstudie: HeLa-Zellen sind robuster als L929-Zellen, was die Verträglichkeit von PEG-Derivaten angeht. Diese Ergebnisse über die Zytotoxizität von PEG-Derivaten sind vorläufig, aber grundlegend für ihre künftige biomedizinische Anwendung; weitere Informationen über die Zellreaktion und das Verhalten gegenüber anderen PEG-Derivaten werden weiter untersucht.
Danksagung
Diese Forschung wurde von der National Science Foundation of China (21574073, 21534006) unterstützt.
- M. V. Cleveland, D. P. Flavin, R. A. Ruben, R. M. Epstein und G. E. Clark, South. Med. J., 2001, 94, 478-481 CrossRef CAS PubMed.
- J. A. DiPalma, M. V. B. Cleveland, J. McGowan und J. L. Herrera, Am. J. Gastroenterol., 2007, 102, 1436-1441 CrossRef CAS PubMed.
- B. A. Erickson, J. C. Austin, C. S. Cooper and M. A. Boyt, J. Urol., 2003, 170, 1518-1520 CrossRef CAS PubMed.
- J. L. Cleland, S. E. Builder, J. R. Swartz, M. Winkler, J. Y. Chang und D. I. C. Wang, Bio/Technology, 1992, 10, 1013-1019 CrossRef CAS PubMed.
- Z. Liu, J. T. Robinson, X. M. Sun und H. J. Dai, J. Am. Chem. Soc., 2008, 130, 10876-10877 CrossRef CAS PubMed.
- J. M. Harris and R. B. Chess, Nat. Rev. Drug Discovery, 2003, 2, 214-221 CrossRef CAS PubMed.
- F. M. Veronese und G. Pasut, Drug Discovery Today, 2005, 10, 1451-1458 CrossRef CAS PubMed.
- M. J. Roberts, M. D. Bentley und J. M. Harris, Adv. Drug Delivery Rev., 2002, 54, 459-476 CrossRef CAS PubMed.
- F. M. Veronese, Biomaterials, 2001, 22, 405-417 CrossRef CAS PubMed.
- H. Zhang, T. Zhao, P. Duffy, Y. Dong, A. Ni Annaidh, E. O’Cearbhaill and W. Wang, Adv. Healthcare Mater., 2015, 4, 2260-2268 CrossRef CAS PubMed.
- Y. Dong, Y. Qin, M. Dubaa, J. Killion, Y. Gao, T. Zhao, D. Zhou, D. Duscher, L. Geever, G. C. Gurtner and W. Wang, Polym. Chem., 2015, 6, 6182-6192 RSC.
- T. M. Allen, C. Hansen, F. Martin, C. Redemann and A. Yauyoung, Biochim. Biophys. Acta, Biomembr., 1991, 1066, 29-36 CrossRef CAS.
- Y. L. Zhang, L. Tao, S. X. Li und Y. Wei, Biomacromolecules, 2011, 12, 2894-2901 CrossRef CAS PubMed.
- Y. L. Zhang, B. Yang, L. X. Xu, X. Y. Zhang, L. Tao and Y. Wei, Acta Chim. Sin., 2013, 71, 485-492 CrossRef CAS.
- C. C. Luo, Y. H. Zhang, X. W. Zeng, Y. W. Zeng and Y. G. Wang, J. Colloid Interface Sci., 2005, 288, 444-448 CrossRef CAS PubMed.
- S. Dhar, F. X. Gu, R. Langer, O. C. Farokhzad und S. J. Lippard, Proc. Natl. Acad. Sci. U. S. A., 2008, 105, 17356-17361 CrossRef CAS PubMed.
- J. Manson, D. Kumar, B. J. Meenan und D. Dixon, Gold Bull. 2011, 44, 99-105 CrossRef CAS.
- X. Y. Zhang, C. K. Fu, L. Feng, Y. Ji, L. Tao, Q. Huang, S. X. Li and Y. Wei, Polymer, 2012, 53, 3178-3184 CrossRef CAS.
- X. Y. Zhang, J. F. Hui, B. Yang, Y. Yang, D. D. Fan, M. Y. Liu, L. Tao and Y. Wei, Polym. Chem., 2013, 4, 4120-4125 RSC.
- D. Bontempo und H. D. Maynard, J. Am. Chem. Soc., 2005, 127, 6508-6509 CrossRef CAS PubMed.
- K. L. Heredia, Z. P. Tolstyka und H. D. Maynard, Macromolecules, 2007, 40, 4772-4779 CrossRef CAS.
- H. Hussain, K. Y. Mya und C. He, Langmuir, 2008, 24, 13279-13286 CrossRef CAS PubMed.
- J. P. Magnusson, S. Bersani, S. Salmaso, C. Alexander and P. Caliceti, Bioconjugate Chem., 2010, 21, 671-678 CrossRef CAS PubMed.
- F. J. Xu, Y. L. Li, E. T. Kang and K. G. Neoh, Biomacromolecules, 2005, 6, 1759-1768 CrossRef CAS PubMed.
- L. L. Yu, L. Yao and K. Yang, J. Porous Mater., 2016, 23, 1581-1589 CrossRef CAS.
- S. Yuan, D. Wan, B. Liang, S. O. Pehkonen, Y. P. Ting, K. G. Neoh und E. T. Kang, Langmuir, 2011, 27, 2761-2774 CrossRef CAS PubMed.
- S. A, Q. Xu, D. Zhou, Y. Gao, J. M. Vasquez, U. Greiser, W. Wang, W. Liu and W. Wang, Polym. Chem., 2017, 8, 1283-1287 RSC.
- H. F. Smyth, C. P. Carpenter und C. S. Weil, J. Am. Pharm. Assoc., 1950, 39, 349-354 CrossRef CAS.
- H. F. Smyth, C. P. Carpenter und C. S. Weil, J. Am. Pharm. Assoc., 1955, 44, 27-30 CrossRef CAS.
- D. E. Prentice und S. K. Majeed, Toxicol. Lett., 1978, 2, 119-122 CrossRef CAS.
- H. Tominaga, M. Ishiyama, F. Ohseto, K. Sasamoto, T. Hamamoto, K. Suzuki und M. Watanabe, Anal. Commun. 1999, 36, 47-50 RSC.
- Y. Li, Y. Zhang, F. Shi, L. Tao, Y. Wei and X. Wang, Colloids Surf., B, 2016, 149, 168-173 CrossRef PubMed.
- B. Yang, Y. Zhang, X. Zhang, L. Tao, S. Li and Y. Wei, Polym. Chem., 2012, 3, 3235-3238 RSC.
- H. Wang und J. A. Joseph, Free Radical Biol. Med., 1999, 27, 612-616 CrossRef CAS PubMed.
- I. K. Smith, T. L. Vieweller und C. A. Thorne, Anal. Biochem. 1988, 175, 408-413 CrossRef CAS PubMed.
- I. Rahman, A. Kode und S. K. Biswas, Nat. Protoc., 2006, 1, 3159-3165 CrossRef CAS PubMed.
- R. Jevprasesphant, J. Penny, R. Jalal, D. Attwood, N. B. McKeown und A. D’Emanuele, Int. J. Pharm., 2003, 252, 263-266 CrossRef CAS PubMed.
- A. K. Gupta and S. Wells, IEEE Trans. Nanobioscience, 2004, 3, 66-73 CrossRef PubMed.
- D. Luo, K. Haverstick, N. Belcheva, E. Han und W. M. Saltzman, Macromolecules, 2002, 35, 3456-3462 CrossRef CAS.
- C. W. Chang, E. Bays, L. Tao, S. N. S. Alconcel und H. D. Maynard, Chem. Commun. 2009, 3580-3582 RSC.
- B. D. Fairbanks, P. A. Gunatillake and L. Meagher, Adv. Drug Delivery Rev., 2015, 91, 141-152 CrossRef CAS PubMed.
- T. Zhou, Y. Zhu, X. Li, X. Liu, K. W. K. Yeung, S. Wu, X. Wang, Z. Cui, X. Yang and P. K. Chu, Prog. Mater. Sci., 2016, 83, 191-235 CrossRef CAS.
- K. H. Jones and J. A. Senft, J. Histochem. Cytochem., 1985, 33, 77-79 CrossRef CAS PubMed.
- M. Hayyan, M. A. Hashim und I. M. AlNashef, Chem. Rev., 2016, 116, 3029-3085 CrossRef CAS PubMed.
- A. Lankoff, W. J. Sandberg, A. Wegierek-Ciuk, H. Lisowska, M. Refsnes, B. Sartowska, P. E. Schwarze, S. Meczynska-Wielgosz, M. Wojewodzka und M. Kruszewski, Toxicol. Lett., 2012, 208, 197-213 CrossRef CAS PubMed.
- Y. Chang, S.-T. Yang, J.-H. Liu, E. Dong, Y. Wang, A. Cao, Y. Liu and H. Wang, Toxicol. Lett., 2011, 200, 201-210 CrossRef CAS PubMed.
- X. Cai, J. Hao, X. Zhang, B. Yu, J. Ren, C. Luo, Q. Li, Q. Huang, X. Shi, W. Li und J. Liu, Toxicol. Appl. Pharmacol., 2010, 243, 27-34 CrossRef CAS PubMed.
- S. J. Park, Y. C. Park, S. W. Lee, M. S. Jeong, K.-N. Yu, H. Jung, J.-K. Lee, J. S. Kim und M.-H. Cho, Toxicol. Lett., 2011, 207, 197-203 CrossRef CAS PubMed.
- K. Pulskamp, S. Diabate and H. F. Krug, Toxicol. Lett., 2007, 168, 58-74 CrossRef CAS PubMed.
- A. M. Studer, L. K. Limbach, L. Van Duc, F. Krumeich, E. K. Athanassiou, L. C. Gerber, H. Moch and W. J. Stark, Toxicol. Lett. 2010, 197, 169-174 CrossRef CAS PubMed.
- T. Thurnherr, C. Brandenberger, K. Fischer, L. Diener, P. Manser, X. Maeder-Althaus, J.-P. Kaiser, H. F. Krug, B. Rothen-Rutishauser und P. Wick, Toxicol. Lett., 2011, 200, 176-186 CrossRef CAS PubMed.
- G. Li, R. K. Randev, A. H. Soeriyadi, G. Rees, C. Boyer, Z. Tong, T. P. Davis, C. R. Becer and D. M. Haddleton, Polym. Chem., 2010, 1, 1196-1204 RSC.
