 Artículo de acceso abierto
Artículo de acceso abierto Este artículo de acceso abierto está licenciado bajo una
Este artículo de acceso abierto está licenciado bajo una
Licencia de Atribución 3.0 de Creative Commons.0 Unported Licence
Guoqiang Liua, Yongsan Liab, Lei Yangd, Yen Weia, Xing Wangb, Zhiming Wangc y Lei Tao *a
*a
aLaboratorio Clave de Química Bioorgánica del Fósforo &Biología Química (Ministerio de Educación), Departamento de Química, Universidad de Tsinghua, Beijing 100084, R. P. China. Correo electrónico: [email protected]
bLaboratorio Estatal Clave de Ingeniería de Recursos Químicos, Universidad de Tecnología Química de Pekín, Pekín 100029, R. P. China
cCollege of Pharmaceutical Science, Zhejiang Chinese Medical University, Hangzhou, Zhejiang 311400, R. P. China
dHospital del Instituto del Cáncer &, Facultad de Medicina de la Unión de Pekín &Academia China de Ciencias Médicas, Pekín 100021, R. P. China
Publicado por primera vez el 27 de marzo de 2017
Los derivados del polietilenglicol (PEG) se han utilizado ampliamente en la investigación bio-relacionada. Sin embargo, los oligómeros de PEG (con diferentes pesos moleculares) o los monómeros basados en PEG (con diferentes grupos terminales de la cadena) realmente tienen diferentes propiedades químicas y físicas, lo que podría conducir a una potencial toxicidad. En este trabajo, se ha medido la citotoxicidad de una serie de derivados de PEG (oligómeros y monómeros) utilizando células humanas de cáncer de cuello de útero (HeLa) y una línea celular de fibroblastos derivada de ratones (L929) como células modelo. La mayoría de los oligómeros de PEG son seguros para ambos tipos de células, excepto el trietilenglicol (TEG), que es tóxico a altas concentraciones para las células L929. Por otro lado, los monómeros a base de PEG, incluidos el acrilato de éter metílico de poli(etilenglicol) (mPEGA) y el metacrilato de éter metílico de poli(etilenglicol) (mPEGMA), mostraron una citotoxicidad evidente. Posteriormente, estos derivados tóxicos del PEG se han estudiado para revelar los diferentes mecanismos de su toxicidad. Esta investigación actual evaluó la citotoxicidad de los derivados de PEG y señaló el peligro potencial de los biomateriales «seguros», lo que podría ofrecer una referencia útil para las personas que utilicen los derivados de PEG en la futura investigación biomédica.
Introducción
El polietilenglicol (PEG) se ha aplicado ampliamente en varios campos médicos debido a sus propiedades sobresalientes, como la seguridad satisfactoria, la biocompatibilidad, la hidrofilia, etc. Por ejemplo, el PEG se ha utilizado en algunos laxantes aprobados por la Administración de Alimentos y Medicamentos (FDA) debido a su excelente capacidad de retención de humedad y lubricación.1-3 En otro ejemplo, la modificación de fármacos/proteínas con PEG (PEGilación) puede mejorar eficazmente su hidrosolubilidad y la vida media de circulación de los medicamentos,4,5 lo que resulta en una mayor seguridad y efectos terapéuticos. En realidad, la PEGilación se está convirtiendo en una de las biotecnologías más atractivas y está logrando un gran éxito en la investigación fundamental y en el mercado.6-11 En la actualidad, muchos derivados del PEG se han utilizado como excelentes materiales de partida para sintetizar una serie de nuevos materiales poliméricos para bioaplicaciones.12 Por ejemplo, un PEG lineal se ha modificado como un PEG difuncionalizado (DF-PEG) que podría utilizarse para generar rápidamente un interesante hidrogel autocurativo.13,14 Algunos oligómeros de PEG se han utilizado para modificar la superficie de nanopartículas inorgánicas con el fin de mejorar la solubilidad en agua y reducir la toxicidad de esos materiales inorgánicos.15-17 Algunos monómeros comerciales a base de PEG, como el acrilato de éter metílico de poli(etilenglicol) (mPEGA) y el metacrilato de éter metílico de poli(etilenglicol) (mPEGMA), se han utilizado para preparar polímeros ramificados para la posterior conjugación de proteínas, el autoensamblaje, la administración de fármacos, etc.18-27
Aunque el PEG se considera normalmente casi no tóxico, los investigadores han observado algunos problemas de inseguridad del PEG con pesos moleculares bajos. Smyth et al. informaron de la toxicidad oral crónica del oligómero de PEG (Mn ∼ 200) en ratas,28,29 los resultados adversos también se han observado en monos,30 lo que sugiere posibles problemas de seguridad de estos materiales «seguros». Por lo tanto, teniendo en cuenta la amplia utilización de los derivados de PEG en las áreas de investigación, el estudio sistemático de la citotoxicidad de esos oligómeros de PEG y monómeros basados en PEG es necesario e importante para su posterior aplicación en los campos relacionados con la biología (Esquema 1).
En el presente trabajo, se evaluó la citotoxicidad de algunos oligómeros de PEG (con diferentes pesos moleculares) y monómeros comerciales a base de PEG (con diferentes grupos terminales de cadena) para células de cáncer de cuello de útero humano (HeLa) y una línea celular de fibroblastos derivada de ratones (L929). Se ha observado la citotoxicidad dependiente del peso molecular de los oligómeros de PEG, y se han revelado por primera vez los diferentes mecanismos de citotoxicidad de los oligómeros de PEG y los monómeros basados en PEG. Esta información sobre la citotoxicidad de los derivados del PEG podría ser una referencia valiosa para elegir el PEG como material de partida y diseñar rutas de purificación para preparar materiales biocompatibles basados en el PEG para otras aplicaciones biomédicas.
Materiales y métodos
2.1 Productos químicos
Trietilenglicol (TEG, 97%, HEOWNS), PEG-400 (Mn ∼ 400, TCI), PEG-1000 (Mn ∼ 1000, Jiangsu Haitian Petrochemical Works), PEG-2000 (Mn ∼ 2000, SCRC), PEG-4000 (Mn ∼ 4000, SCRC), poli(etilenglicol) metil éter acrilato 480 (mPEGA-480, Mn ∼ 480, Sigma-Aldrich), poli(etilenglicol) metil éter metacrilato 500 (mPEGMA-500, Mn ∼ 500, Sigma-Aldrich) y poli(etilenglicol) metil éter metacrilato 950 (mPEGMA-950, Mn ∼ 950, Sigma-Aldrich) se utilizaron directamente sin más purificación.
Las células humanas de cáncer de cuello uterino (HeLa) y una línea celular de fibroblastos derivada de ratones (L929) se adquirieron de la American type culture collection (ATCC). Se utilizó medio eagle modificado de Dulbecco (DMEM, Corning-Cellgro), solución salina tamponada con fosfato (PBS, pH ∼ 7,2-7,4, 0,01 M, Solarbio), suero bovino fetal (FBS, Gibco), medio de cultivo Roswell Park Memorial Institute 1640 (medio de cultivo RPMI 1640, Gibco), solución de penicilina-estreptomicina (Gibco), tripsina-EDTA (Gibco, 0.25%), 4-(3-(2-metoxi-4-nitrofenil)-2-(4-nitrofenil)-2H-tetrazol-3-io-5-il)benceno-1,3-disulfonato (CCK-8, Beyotime), diacetato de 2,7-diclorodihidrofluoresceína (DCFH-DA, Beyotime), glutatión oxidado (GSSG, Beyotime), nicotinamida adenina dinucleótido fosfato (NADPH, Beyotime), 5,5′-ditiobis-(ácido 2-nitrobenzoico) (DTNB, Beyotime), diacetato de fluoresceína (FDA, Sigma) y yoduro de propidio (PI, 94%, Sigma) se utilizaron tal como se compraron.
2.2 Cultivo celular
El cultivo celular se mantuvo en una incubadora a 37 °C con un 5% de CO2, el medio de cultivo se cambió cada uno o dos días para mantener el crecimiento exponencial de las células. Las células HeLa procedían de células de cáncer de cuello de útero y se cultivaron en medio DMEM suplementado con un 10% de suero fetal bovino (FBS) y un 1% de penicilina y estreptomicina. Las células L929 procedían de ratones y se cultivaron en medio RPMI 1640 suplementado con 10% de suero fetal bovino (FBS) y 1% de penicilina y estreptomicina.
2.3 Análisis de citotoxicidad
Los resultados se presentaron como media ± desviación estándar (SD), y los valores de la concentración inhibitoria media máxima 50% (IC50) de los derivados de PEG se calcularon mediante SPSS 15.0.
De acuerdo con nuestro trabajo anterior,32,33 el diacetato de fluoresceína (FDA) y el yoduro de propidio (PI) podrían utilizarse como un método de doble tinción rápido y conveniente para observar la viabilidad celular. Las células L929 se sembraron en una placa de 24 pocillos a una densidad de ∼5 × 104 células por mL. Tras la fijación, las células se lavaron con PBS y se cultivaron con diferentes concentraciones de derivados de PEG en el medio de cultivo durante 24 h. A continuación, se eliminó el medio y se lavaron las células con PBS. Posteriormente se añadió una solución mixta PBS-FDA-PI (FDA: 3 μg mL-1; PI: 3 μg mL-1) y se incubó la placa de 24 pocillos a 37 °C durante 15 min. Se utilizó un microscopio de fluorescencia (Leica Alemania) para observar las células vivas y muertas bajo filtros de excitación de paso de banda de 450-490 nm y 515-560 nm (I3 y N2.1), respectivamente (lámpara de mercurio de 100 W).
Brevemente, se sembraron células L929 en una placa de 24 pocillos y se incubaron en 0,5 mL de medio de cultivo con diferentes concentraciones de TEG (A, A′) durante 1 h (Fig. 1), los pozos A1-A6 se utilizaron para medir la cantidad total de glutatión (GSH + GSSG) mientras que los pozos A′1-A′6 se utilizaron para medir la cantidad de glutatión oxidado (GSSG) en presencia de TEG. Después de 1 h, se recogieron las células mediante digestión con tripsina y centrifugación (1000 rpm, 5 min). A continuación, se añadió una solución de eliminación de proteínas a triple volumen (50 mg mL-1) para eliminar las proteínas ruidosas. Tras tres ciclos rápidos de congelación-descongelación en nitrógeno líquido y un baño de agua a 37 °C, la suspensión se colocó en un refrigerador (4 °C) durante 5 minutos, y las muestras del sobrenadante celular se obtuvieron tras la centrifugación (10 000 rpm, 10 min). Las muestras de los pozos A1-A6 se utilizaron para medir el nivel de glutatión total (GSH + GSSG). Se añadió una solución de NADPH (0,5 mg mL-1) para reducir todo el glutatión a GSH y, a continuación, se utilizó el ácido 5,5′-ditiobis-(2-nitrobenzoico) (DTNB) para oxidar el GSH; el cambio de absorbancia a 405 nm se registró mediante un lector de microplacas (VICTOR™ X3 PerkinElmer 2030 Multilabel Plate Reader).35,36 Las muestras de los pozos de A′1-A′6 se utilizaron para medir el nivel de glutatión oxidado (GSSG). Utilizando la solución eliminadora de GSH, sólo se dejó GSSG en la solución de la muestra. Las muestras se analizaron mediante el mismo método anterior para medir el nivel de GSSG. La cantidad total de glutatión y la cantidad de glutatión oxidado se recogieron para calcular el nivel de glutatión reducido, mientras que el nivel de GSH de las células en medio de cultivo puro se utilizó como control. Los resultados se presentaron como media ± SD.
000 rpm, 10 min). Las muestras de los pozos A1-A6 se utilizaron para medir el nivel de glutatión total (GSH + GSSG). Se añadió una solución de NADPH (0,5 mg mL-1) para reducir todo el glutatión a GSH y, a continuación, se utilizó el ácido 5,5′-ditiobis-(2-nitrobenzoico) (DTNB) para oxidar el GSH; el cambio de absorbancia a 405 nm se registró mediante un lector de microplacas (VICTOR™ X3 PerkinElmer 2030 Multilabel Plate Reader).35,36 Las muestras de los pozos de A′1-A′6 se utilizaron para medir el nivel de glutatión oxidado (GSSG). Utilizando la solución eliminadora de GSH, sólo se dejó GSSG en la solución de la muestra. Las muestras se analizaron mediante el mismo método anterior para medir el nivel de GSSG. La cantidad total de glutatión y la cantidad de glutatión oxidado se recogieron para calcular el nivel de glutatión reducido, mientras que el nivel de GSH de las células en medio de cultivo puro se utilizó como control. Los resultados se presentaron como media ± SD.
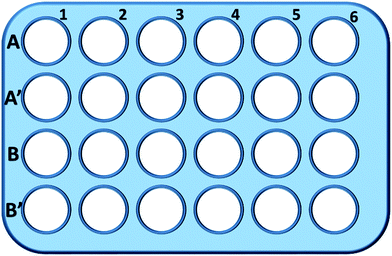
Los pocillos de la línea B y B′ se utilizaron para comprobar la cantidad total de GSH y GSSG en presencia de mPEGA-480, respectivamente, mediante el mismo procedimiento.
Resultados y discusión
3.1 Estudio de viabilidad celular
Cuando se utilizó la célula HeLa (un modelo de células cancerosas) (Fig. 2A), la citotoxicidad de todos los oligómeros de PEG a bajas concentraciones (≤5 mg mL-1) pudo despreciarse. Al aumentar la concentración (≥10 mg mL-1), se observó la citotoxicidad dependiente del peso molecular de las muestras de PEG. El trietilenglicol (TEG) mostró una citotoxicidad evidente por encima de 10 mg mL-1 (p < 0,05; contrasta con cualquier otro oligómero cuando la concentración es superior a 5 mg mL-1) y el valor IC50 del TEG para las células HeLa se calculó en 19,8 mg mL-1. Mientras tanto, otros oligómeros de PEG (Mn ∼ 400-4000) también mostraron una citotoxicidad diminuta.
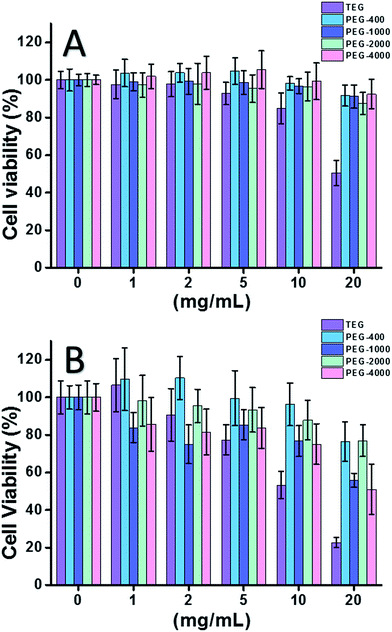
También se evaluó la citotoxicidad de los oligómeros de PEG para las células L929 (un modelo de células normales) (Fig. 2B). La viabilidad celular disminuyó con el aumento de la concentración de PEG, como era de esperar. Además del TEG, algunos oligómeros de PEG (PEG-1000, PEG-4000) que son seguros para las células HeLa también mostraron una citotoxicidad detectable, los valores IC50 del TEG, PEG-1000 y PEG-4000 se calcularon como 12,4, 22,5 y 20,0 mg mL-1 para las células L929, respectivamente, indicando también la citotoxicidad dependiente del peso molecular de los oligómeros de PEG.
Los resultados anteriores sugieren que las células HeLa tienen mejor tolerancia a los oligómeros de PEG que las células L929 debido a la tenaz vitalidad de las células cancerosas, y el TEG tiene una citotoxicidad mucho mayor que otros oligómeros de PEG con pesos moleculares más altos (p < 0,05; contraste con cualquier otro oligómero cuando la concentración es superior a 5 mg mL-1). Se observa que la investigación actual demostró la citotoxicidad moderada del PEG-1000 y el PEG-4000 para las células L929, y la casi nula citotoxicidad del PEG-400 y el PEG-2000, lo que difiere de la impresión común de que los PEG de alto peso molecular deberían ser más biocompatibles que sus homólogos de bajo peso molecular. Aunque la razón de la citotoxicidad del PEG todavía no está clara, el PEG-400 y el PEG-2000 parecen ser las mejores opciones para sintetizar materiales biocompatibles.
Cuando se probó mPEGMA-500, la viabilidad celular tanto de las células HeLa como de las L929 disminuyó con el aumento de la concentración de mPEGMA-500 (Fig. 3A), y no se observó ninguna diferencia aparente entre los dos tipos de células. Los valores IC50 de mPEGMA-500 son de 4,7 mg mL-1 para las células HeLa, y de 5,3 mg mL-1 para las células L929 después de 24 horas de cultivo, lo que indica una citotoxicidad más significativa de mPEGMA-500 que de los oligómeros de PEG antes mencionados, e implica que los grupos finales de la cadena de los derivados de PEG son cruciales para su toxicidad. Cuando se probó mPEGMA-950, otro metacrilato basado en PEG con el mismo grupo final de cadena pero con mayor peso molecular, mediante el mismo procedimiento (Fig. 3B), se observó una citotoxicidad mucho menor de mPEGMA-950 para las células HeLa o las células L929 (p < 0,05; cuando la concentración es superior a 2 mg mL-1), los valores de IC50 de mPEGMA-950 son 20,8 mg mL-1 para las células HeLa, y 21.7 mg mL-1 para las células L929 después de 24 horas de cultivo, lo que también demuestra la citotoxicidad dependiente del peso molecular del metacrilato basado en PEG.
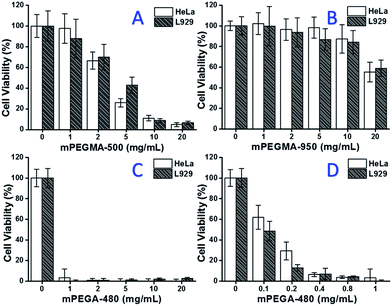
Además, también se probó el acrilato a base de PEG mPEGA-480. Aunque la diferencia entre el mPEGA-480 y el mPEGMA-500 es sólo un grupo metilo en el extremo de la cadena, el mPEGA-480 mostró una citotoxicidad aguda (Fig. 3C). Más del 95% de las células perdieron viabilidad incluso con 1 mg mL-1 de mPEGA-480 en el medio de cultivo. Por lo tanto, hay que realizar experimentos adicionales con concentraciones más bajas para determinar su citotoxicidad (Fig. 3D), y los valores IC50 de mPEGA-480 se calcularon como 0,2 mg mL-1 para las células HeLa y 0,1 mg mL-1 para las células L929 después de 24 h de cultivo.
Los experimentos de viabilidad celular confirmaron que tanto los grupos terminales de la cadena como el peso molecular son elementos de influencia importantes para la citotoxicidad de los derivados de PEG, y los monómeros basados en PEG mostraron una citotoxicidad mucho más notable en comparación con los oligómeros de PEG.
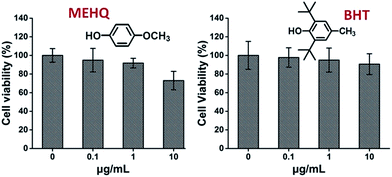
Mientras tanto, también se evaluó la citotoxicidad de los inhibidores de los monómeros basados en PEG, el éter metílico de hidroquinona (MEHQ, 100 ppm en mPEGA) y el hidroxitolueno butilado (BHT, 300 ppm en mPEGMA) (Fig. 4), y las células L929 mantuvieron una alta viabilidad (≥90%) a inhibidores de baja concentración (≤1 μg mL-1). Hay 0,1 μg mL-1 de MEHQ en 1 mg mL-1 de mPEGA-480, y 3 μg mL-1 de BHT en 10 mg mL-1 de mPEGA-500, mientras que el mPEG-480 y el mPEGMA-500 demostraron una citotoxicidad evidente a esas concentraciones. Por lo tanto, las trazas de inhibidores en los monómeros a base de PEG parecían tener una influencia insignificante en la citotoxicidad de los monómeros.
3.2 Observación de la morfología celular
La observación con microscopio óptico se utilizó para evaluar directamente la citotoxicidad de los derivados de PEG para las células L929. Las imágenes ópticas de las células L929 expuestas a 20 mg mL-1 de TEG y a 0,1 mg mL-1 de mPEGA durante 24 h se mostraron en la Fig. 5A y B, respectivamente.
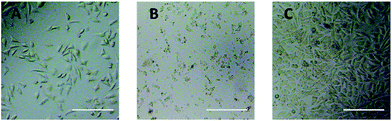
Después de la incubación con 20 mg mL-1 de TEG durante 24 h, las células mantuvieron la morfología similar (Fig. 5A) con el grupo de control (Fig. 5C, células en medio de cultivo puro), pero el número de células disminuyó drásticamente, lo que indica la citotoxicidad del TEG a alta concentración, que condujo a la muerte y siguió al desprendimiento de las células del fondo de la microplaca. La Fig. 5B muestra la morfología de las células L929 después de la incubación con 0,1 mg mL-1 de mPEGA-480. Casi todas las células perdieron la morfología normal, lo que sugiere la citotoxicidad aguda de mPEGA-480 incluso a una concentración tan baja.
Además, las células también se tiñeron utilizando fluoresceína. La doble tinción con FDA/PI es un procedimiento rápido, sencillo y simultáneo para observar las células vivas y muertas.43 La FDA puede entrar en las células completas y acumularse en ellas, por lo que es necesaria la membrana celular completa para evitar la fuga de fluoresceína de la célula. Por el contrario, el PI no puede atravesar la membrana celular intacta, pero puede teñir el núcleo de las células muertas al atravesar la membrana celular dañada. Como muestra la Fig. 6, las células L929 incubadas con 20 mg mL-1 de TEG tienen menos células viables después de la tinción con FDA (Fig. 6b) en comparación con el control (Fig. 6a), y se pueden observar más células muertas después de la tinción con PI (Fig. 6b′), idéntico al resultado de la observación a través de un microscopio óptico. La citotoxicidad aguda de mPEGA-480 también se observó después del procedimiento de doble tinción FDA/PI, no se pudo identificar ninguna señal verde después de incubar las células con 0,1 mgL-1 mPEG-480 durante 24 h (Fig. 6c y c′′).
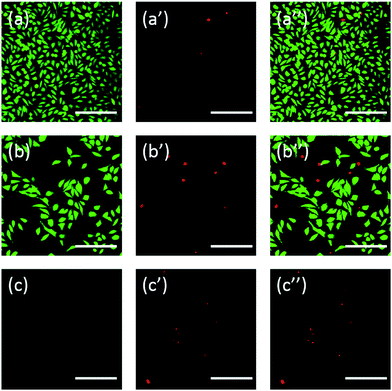
Tanto las imágenes ópticas como las fluorescentes demostraron intuitivamente la citotoxicidad de estos derivados de PEG, apoyando además la conclusión obtenida mediante los ensayos de CCK-8. Se observa que el mPEGA-480 parecía más tóxico mediante el ensayo de tinción doble FDA/PI, lo que se atribuye a que la tinción doble FDA/PI distingue la integridad de la membrana de las células vivas/muertas, mientras que el ensayo CCK-8 detecta la actividad de la deshidrogenasa en las mitocondrias, lo que sugiere que la tinción FDA/PI es un excelente complemento del ensayo CCK-8 para ofrecer más detalles del estado celular.
3.3 Estudio del mecanismo
Según los experimentos de viabilidad celular, se calcularon y resumieron los valores IC50 de los oligómeros de PEG y de los monómeros basados en PEG para las células HeLa y L929 después de 24 h de cultivo (Tabla 1), lo que sugiere que los monómeros basados en PEG son mucho más tóxicos para las células que los oligómeros de PEG, y el mPEGA tiene la mayor citotoxicidad. Por lo tanto, se analizó la generación de ROS y la disminución de GSH en las células, dos mecanismos principales de citotoxicidad, para investigar la posible razón de la citotoxicidad.
| TEG | PEG-400 | PEG-1000 | PEG-2000 | PEG-4000 | mPEGMA-500 | mPEGMA-950 | mPEGA-480 | |
|---|---|---|---|---|---|---|---|---|
| Células HeLa | 19.8 | 32,5 | 36,2 | 38,2 | 29,6 | 4,7 | 20,8 | 0,2 |
| Células L929 | 12,4 | 24.7 | 22,5 | 28,7 | 20,0 | 5,3 | 21,7 | 0,1 |
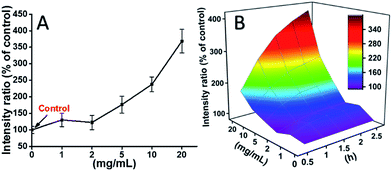
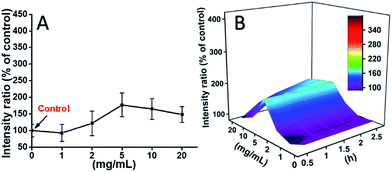
Las células L929 se incubaron con TEG, y los niveles de ROS en diferentes puntos de tiempo (0, 0,5, 1,0, 1,5, 2 h) se detectaron de acuerdo con nuestros informes anteriores y se muestran en la Fig. 7. Como ejemplo, los niveles de ROS tras la incubación con diferentes concentraciones de TEG durante 2 h se muestran en la Fig. 7A. Se observa claramente que los niveles de ROS se mantienen estables con una baja concentración de TEG (≤2 mg mL-1), pero aumentan significativamente cuando la concentración de TEG es superior a 2 mg mL-1, lo que coincide con el resultado del experimento de viabilidad celular de la Fig. 2B. Del mismo modo, se dibujaron las figuras del nivel de ROS frente a la concentración de TEG en diferentes puntos de tiempo y se fusionaron para obtener un mapa 3D (Fig. 7B). Los niveles máximos de ROS se encontraron a las 2 h con 20 mg mL-1 de TEG, se detectó un nivel de ROS aproximadamente 400% mayor que el del control (nivel de ROS = 100), dando lugar a la intensidad de fluorescencia más brillante. Estos resultados sugieren que la generación de ROS es el posible mecanismo de la citotoxicidad del TEG, y el alto nivel de ROS inducido por el TEG podría ser la razón principal de la apoptosis celular.
También se comprobaron los niveles de ROS inducidos por mPEGA-480 después de 2 h (Fig. 8A). A diferencia del TEG, el mPEGA no causó el rápido aumento de ROS en las células, sólo se observó un aumento de ROS de ∼170% en comparación con el control como máximo. El nivel de ROS en 3D frente al tiempo de mPEGA & (Fig. 8B) mostró el nivel de ROS inducido por mPEGA-480 como una onda y la cresta apareció a una concentración moderada de mPEGA (5 mg mL-1), no se puede observar ninguna generación significativa de ROS, lo que sugiere que la generación de ROS podría contribuir sólo en parte a la citotoxicidad de mPEGA-480.
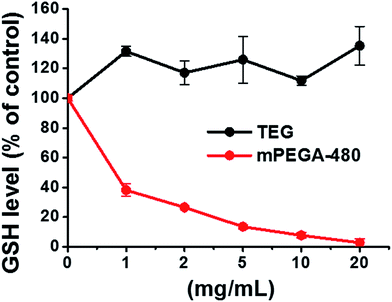
El grupo tiol reductor del GSH es una importante fuente de antioxidación en los organismos. Un posible mecanismo de la citotoxicidad de mPEGA-480 se atribuye a la reacción de adición de Michael entre el grupo tiol y el enlace de vinilo, lo que conduce a la ruptura del equilibrio redox intracelular y a la apoptosis celular. Investigaciones anteriores sugirieron que la adición de Michael entre el tiol y el acrilato es mucho más rápida que entre el tiol y el metacrilato,52 lo que podría ser una causa razonable de la diferente citotoxicidad aguda entre el mPEGA-480 y el mPEGMA-500.
Conclusiones
Se evaluó por primera vez la citotoxicidad de los oligómeros de PEG y los monómeros basados en PEG para las células HeLa y las células L929. Se ha confirmado la citotoxicidad dependiente de la concentración de los oligómeros de PEG y de los monómeros basados en PEG, y se ha presentado como valores IC50 para las células HeLa y las células L929. PEG-400, PEG-2000 parecen casi no citotóxicos en la investigación actual. El PEG-1000, el PEG-4000 y el mPEGMA-950 mostraron una citotoxicidad moderada, especialmente a altas concentraciones. El TEG y el mPEGMA-500 mostraron una citotoxicidad significativa, y el mPEGA-480 mostró una citotoxicidad aguda. Además, los tipos de células también influyen en los resultados del estudio de citotoxicidad, las células HeLa son más robustas que las células L929 para tolerar los derivados de PEG. Estos resultados sobre la citotoxicidad de los derivados de PEG son preliminares pero fundamentales para su futura aplicación biomédica, se seguirá investigando más información sobre la respuesta y el comportamiento celular a otros derivados de PEG.
Agradecimientos
Esta investigación fue apoyada por la Fundación Nacional de Ciencia de China (21574073, 21534006).
- M. V. Cleveland, D. P. Flavin, R. A. Ruben, R. M. Epstein y G. E. Clark, South. Med. J., 2001, 94, 478-481 CrossRef CAS PubMed.
- J. A. DiPalma, M. V. B. Cleveland, J. McGowan y J. L. Herrera, Am. J. Gastroenterol, 2007, 102, 1436-1441 CrossRef CAS PubMed.
- B. A. Erickson, J. C. Austin, C. S. Cooper y M. A. Boyt, J. Urol, 2003, 170, 1518-1520 CrossRef CAS PubMed.
- J. L. Cleland, S. E. Builder, J. R. Swartz, M. Winkler, J. Y. Chang y D. I. C. Wang, Bio/Technology, 1992, 10, 1013-1019 CrossRef CAS PubMed.
- Z. Liu, J. T. Robinson, X. M. Sun y H. J. Dai, J. Am. Chem. Soc., 2008, 130, 10876-10877 CrossRef CAS PubMed.
- J. M. Harris y R. B. Chess, Nat. Rev. Drug Discovery, 2003, 2, 214-221 CrossRef CAS PubMed.
- F. M. Veronese y G. Pasut, Drug Discovery Today, 2005, 10, 1451-1458 CrossRef CAS PubMed.
- M. J. Roberts, M. D. Bentley y J. M. Harris, Adv. Drug Delivery Rev., 2002, 54, 459-476 CrossRef CAS PubMed.
- F. M. Veronese, Biomaterials, 2001, 22, 405-417 CrossRef CAS PubMed.
- H. Zhang, T. Zhao, P. Duffy, Y. Dong, A. Ni Annaidh, E. O’Cearbhaill y W. Wang, Adv. Healthcare Mater., 2015, 4, 2260-2268 CrossRef CAS PubMed.
- Y. Dong, Y. Qin, M. Dubaa, J. Killion, Y. Gao, T. Zhao, D. Zhou, D. Duscher, L. Geever, G. C. Gurtner y W. Wang, Polym. Chem., 2015, 6, 6182-6192 RSC.
- T. M. Allen, C. Hansen, F. Martin, C. Redemann y A. Yauyoung, Biochim. Biophys. Acta, Biomembr., 1991, 1066, 29-36 CrossRef CAS.
- Y. L. Zhang, L. Tao, S. X. Li y Y. Wei, Biomacromolecules, 2011, 12, 2894-2901 CrossRef CASMed.
- Y. L. Zhang, B. Yang, L. X. Xu, X. Y. Zhang, L. Tao e Y. Wei, Acta Chim. Sin., 2013, 71, 485-492 CrossRef CAS.
- C. C. Luo, Y. H. Zhang, X. W. Zeng, Y. W. Zeng y Y. G. Wang, J. Colloid Interface Sci., 2005, 288, 444-448 CrossRef CASMed.
- S. Dhar, F. X. Gu, R. Langer, O. C. Farokhzad y S. J. Lippard, Proc. Natl. Acad. Sci. U. S. A., 2008, 105, 17356-17361 CrossRef CAS PubMed.
- J. Manson, D. Kumar, B. J. Meenan y D. Dixon, Gold Bull., 2011, 44, 99-105 CrossRef CAS.
- X. Y. Zhang, C. K. Fu, L. Feng, Y. Ji, L. Tao, Q. Huang, S. X. Li y Y. Wei, Polymer, 2012, 53, 3178-3184 CrossRef CAS.
- X. Y. Zhang, J. F. Hui, B. Yang, Y. Yang, D. D. Fan, M. Y. Liu, L. Tao y Y. Wei, Polym. Chem., 2013, 4, 4120-4125 RSC.
- D. Bontempo y H. D. Maynard, J. Am. Chem. Soc., 2005, 127, 6508-6509 CrossRef CAS PubMed.
- K. L. Heredia, Z. P. Tolstyka y H. D. Maynard, Macromolecules, 2007, 40, 4772-4779 CrossRef CAS.
- H. Hussain, K. Y. Mya y C. He, Langmuir, 2008, 24, 13279-13286 CrossRef CAS PubMed.
- J. P. Magnusson, S. Bersani, S. Salmaso, C. Alexander y P. Caliceti, Bioconjugate Chem, 2010, 21, 671-678 CrossRef CAS PubMed.
- F. J. Xu, Y. L. Li, E. T. Kang y K. G. Neoh, Biomacromolecules, 2005, 6, 1759-1768 CrossRef CAS PubMed.
- L. L. Yu, L. Yao y K. Yang, J. Porous Mater, 2016, 23, 1581-1589 CrossRef CAS.
- S. Yuan, D. Wan, B. Liang, S. O. Pehkonen, Y. P. Ting, K. G. Neoh y E. T. Kang, Langmuir, 2011, 27, 2761-2774 CrossRef CASMed.
- S. A, Q. Xu, D. Zhou, Y. Gao, J. M. Vasquez, U. Greiser, W. Wang, W. Liu y W. Wang, Polym. Chem., 2017, 8, 1283-1287 RSC.
- H. F. Smyth, C. P. Carpenter y C. S. Weil, J. Am. Pharm. Assoc., 1950, 39, 349-354 CrossRef CAS.
- H. F. Smyth, C. P. Carpenter y C. S. Weil, J. Am. Pharm. Assoc., 1955, 44, 27-30 CrossRef CAS.
- D. E. Prentice y S. K. Majeed, Toxicol. Lett., 1978, 2, 119-122 CrossRef CAS.
- H. Tominaga, M. Ishiyama, F. Ohseto, K. Sasamoto, T. Hamamoto, K. Suzuki y M. Watanabe, Anal. Commun., 1999, 36, 47-50 RSC.
- Y. Li, Y. Zhang, F. Shi, L. Tao, Y. Wei y X. Wang, Colloids Surf., B, 2016, 149, 168-173 CrossRef PubMed.
- B. Yang, Y. Zhang, X. Zhang, L. Tao, S. Li e Y. Wei, Polym. Chem., 2012, 3, 3235-3238 RSC.
- H. Wang and J. A. Joseph, Free Radical Biol. Med., 1999, 27, 612-616 CrossRef CAS PubMed.
- I. K. Smith, T. L. Vieweller y C. A. Thorne, Anal. Biochem., 1988, 175, 408-413 CrossRef CAS PubMed.
- I. Rahman, A. Kode y S. K. Biswas, Nat. Protoc., 2006, 1, 3159-3165 CrossRef CAS PubMed.
- R. Jevprasesphant, J. Penny, R. Jalal, D. Attwood, N. B. McKeown y A. D’Emanuele, Int. J. Pharm., 2003, 252, 263-266 CrossRef CAS PubMed.
- A. K. Gupta y S. Wells, IEEE Trans. Nanobioscience, 2004, 3, 66-73 CrossRef PubMed.
- D. Luo, K. Haverstick, N. Belcheva, E. Han y W. M. Saltzman, Macromolecules, 2002, 35, 3456-3462 CrossRef CAS.
- C. W. Chang, E. Bays, L. Tao, S. N. S. Alconcel y H. D. Maynard, Chem. Commun., 2009, 3580-3582 RSC.
- B. D. Fairbanks, P. A. Gunatillake y L. Meagher, Adv. Drug Delivery Rev., 2015, 91, 141-152 CrossRef CAS PubMed.
- T. Zhou, Y. Zhu, X. Li, X. Liu, K. W. K. Yeung, S. Wu, X. Wang, Z. Cui, X. Yang y P. K. Chu, Prog. Mater. Sci., 2016, 83, 191-235 CrossRef CAS.
- K. H. Jones and J. A. Senft, J. Histochem. Cytochem., 1985, 33, 77-79 CrossRef CAS PubMed.
- M. Hayyan, M. A. Hashim y I. M. AlNashef, Chem. Rev., 2016, 116, 3029-3085 CrossRef CAS PubMed.
- A. Lankoff, W. J. Sandberg, A. Wegierek-Ciuk, H. Lisowska, M. Refsnes, B. Sartowska, P. E. Schwarze, S. Meczynska-Wielgosz, M. Wojewodzka y M. Kruszewski, Toxicol. Lett., 2012, 208, 197-213 CrossRef CAS PubMed.
- Y. Chang, S.-T. Yang, J.-H. Liu, E. Dong, Y. Wang, A. Cao, Y. Liu y H. Wang, Toxicol. Lett., 2011, 200, 201-210 CrossRef CAS PubMed.
- X. Cai, J. Hao, X. Zhang, B. Yu, J. Ren, C. Luo, Q. Li, Q. Huang, X. Shi, W. Li y J. Liu, Toxicol. Appl. Pharmacol., 2010, 243, 27-34 CrossRef CAS PubMed.
- S. J. Park, Y. C. Park, S. W. Lee, M. S. Jeong, K.-N. Yu, H. Jung, J.-K. Lee, J. S. Kim y M.-H. Cho, Toxicol. Lett., 2011, 207, 197-203 CrossRef CAS PubMed.
- K. Pulskamp, S. Diabate y H. F. Krug, Toxicol. Lett., 2007, 168, 58-74 CrossRef CAS PubMed.
- A. M. Studer, L. K. Limbach, L. Van Duc, F. Krumeich, E. K. Athanassiou, L. C. Gerber, H. Moch y W. J. Stark, Toxicol. Lett., 2010, 197, 169-174 CrossRef CAS PubMed.
- T. Thurnherr, C. Brandenberger, K. Fischer, L. Diener, P. Manser, X. Maeder-Althaus, J.-P. Kaiser, H. F. Krug, B. Rothen-Rutishauser y P. Wick, Toxicol. Lett., 2011, 200, 176-186 CrossRef CAS PubMed.
- G. Li, R. K. Randev, A. H. Soeriyadi, G. Rees, C. Boyer, Z. Tong, T. P. Davis, C. R. Becer y D. M. Haddleton, Polym. Chem., 2010, 1, 1196-1204 RSC.
