Jaksollisen järjestelmän yleisesti käytetty pitkä muoto on suunniteltu korostamaan elektronikonfiguraatioita. Koska juuri uloimmat (valenssi)elektronit ovat ensisijaisesti mukana atomien välisissä kemiallisissa vuorovaikutuksissa, atomiin rakentumisprosessissa lisätty viimeinen elektroni kiinnostaa kemistiä paljon enemmän kuin ensimmäinen. Tätä viimeistä elektronia kutsutaan erottelevaksi elektroniksi, koska se erottaa atomin sitä jaksollisessa järjestelmässä välittömästi edeltävästä atomista. Se, minkä tyyppiseen alikuoreen (s, p, d, f) erotuselektroni sijoitetaan, liittyy hyvin läheisesti alkuaineen kemialliseen käyttäytymiseen, ja se johtaa luokitteluun, joka on esitetty tässä näkyvässä jaksollisen järjestelmän värikoodauksessa. Edustavat alkuaineet ovat alkuaineita, joissa erottava elektroni on ans- tai p-alakuoressa. Useimmat alkuaineet, joiden kemiaa ja valenssia olemme tähän mennessä käsitelleet, kuuluvat tähän luokkaan. Monet edustavien alkuaineiden kemialliset ominaisuudet voidaan selittää Lewisin diagrammien perusteella. Toisin sanoen edustavien alkuaineiden valenssit voidaan ennustaa niiden valenssielektronien lukumäärän perusteella tai niiden elektronien lukumäärän perusteella, jotka olisi lisättävä, jotta saavutettaisiin sama elektronikonfiguraatio kuin jalokaasun atomilla. Edustavien alkuaineiden valenssielektronien lukumäärä on sama kuin jaksollisen ryhmän numero, ja seuraavan jalokaasun konfiguraation saavuttamiseksi tarvittava määrä on 8 miinus ryhmän numero. Tämä vastaa jaksollisesta järjestelmästä johdettuja valenssisääntöjä, ja tuloksena saadaan ensimmäisen tusinan alkuaineiden kloridien kaavat, joissa näkyy valenssin jaksollinen vaihtelu.
| Elementti | Atomipaino | Vety-yhdisteet | Happiyhdisteet | Klooriyhdisteet | |
|---|---|---|---|---|---|
| Vety | 1.01 | H2 | H2O, H2O2 | HCl | |
| Helium | 4.00 | Ei muodostunut | Ei muodostunut | Ei muodostunut | Ei muodostunut |
| Lithium | 6.94 | LiH | Li2O, Li2O2 | LiCl | |
| Beryllium | 9.01 | BeH2 | BeO | BeCl2 | |
| Boori | 10.01 | CH4, C2H6, C3H8 | CO2, CO, C2O3 | CCl4, C2Cl6 | |
| Typpi | 14.01 | NH3, N2H4, HN3 | N2O, NO, NO2, N2O5 | NCl3 | |
| Happi | 16.00 | H2O, H2O2 | O2, O3 | <Cl2O, ClO2, Cl2O7 | |
| Fluori | 19.00 | HF | OF2, O2F2 | ClF, ClF3, ClF5 | |
| Neon | 20.18 | Ei muodostunut | Ei muodostunut | Ei muodostunut | Ei muodostunut |
| Natrium | 22.99 | NaH | Na2O, Na2O2 | NaCl | |
| Magnesium | 24.31 | MgH2 | MgO | MgCl2 |
Nykyaikaisen jaksollisen järjestelmän kolme ensimmäistä vaakasuoraa riviä tai jaksoa koostuvat kokonaan edustavista alkuaineista. Ensimmäisessä jaksossa H:n ja He:n erottuvat elektronit ovat 1s-alikuoressa. Toisen jakson poikki Li:llä ja Be:llä on erottuvat elektronit 2s-alakuoressa, ja B:stä Ne:hen oleviin atomeihin lisätään elektroneja 2p-alakuoreen. Kolmannessa jaksossa 3s-alikuori täyttyy Na:lla ja Mg:llä ja siten myös Alilla, Si:llä, P:llä, S:llä, Cl:llä ja Ar:lla. Yleissääntönä on, että edustavien alkuaineiden kohdalla erottuva elektroni on ns- tai np-alakuoressa. Erotuselektronin pääkvanttiluvun n arvo voidaan nopeasti määrittää laskemalla alaspäin jaksollisen järjestelmän yläosasta. Esimerkiksi jodi on viidennen jakson edustava alkuaine. Erotuselektronin on siis oltava joko 5s:n tai 5p:n alikuoressa. Koska I on taulukon oikealla puolella, 5p on oikea valinta.
Kun pääkvanttiluku on kolme tai enemmän, myös d-tyypin alakuoret ovat mahdollisia. Siirtymäalkuaineita tai siirtymämetalleja ovat ne alkuaineet, joiden erottava elektroni sijaitsee d-orbitaalissa. Ensimmäiset esimerkit siirtymämetalleista (Sc, Ti, V, Cr, Mn, Fe, Co, Ni, Cu, Zn) löytyvät neljännestä jaksosta, vaikka erotteleva elektroni on kussakin tapauksessa 3d-elektroni ja kuuluu kolmanteen kuoreen. Tämä välimatka johtuu, kuten olemme jo nähneet, siitä, että 4s:n energia on alhaisempi kuin 3d:n. Näin ollen 4s:n orbitaali alkaa täyttyä, jolloin neljäs jakso alkaa ennen kuin yksikään 3d-orbitaaleista ehtii täyttyä.
Kuvassa \(\PageIndex{1}\) verrataan 4s:n ja 3d-elektronin todennäköisyysjakaumia V-atomissa. Vaikka 4s:n elektronipilvi sijaitsee keskimäärin kauempana ytimestä kuin 3d-pilvi, pieni osa 4s:n elektronitiheydestä sijaitsee hyvin lähellä ydintä, jossa se on tuskin suojassa kokonaisydinvaraukselta +23. Tämän pienen 4s:n elektronitiheyden pienen osan erittäin voimakas vetovoima alentaa 4s:n elektronin energian 3d:n energiaa alemmaksi.
_and_4s_(color)_Electron_Clouds.jpg?revision=1)
Se, että 4s:n elektronipilvi on 3d:tä laajempi, vaikuttaa merkittävästi siirtymäalkuaineiden kemiaan. Kun V:n kaltainen atomi (kuva \(\PageIndex{1}\) ) on vuorovaikutuksessa toisen atomin kanssa, ytimestä kauimmaksi ulottuvat 4s-elektronit ovat ensimmäisinä kosketuksissa toiseen atomiin. Näin ollen 4s:n elektronit ovat usein merkittävämpiä kuin 3d:n elektronit määritettäessä valenssia ja yhdisteiden kaavoja. 3d-elektronit ovat ”haudattuina” siirtymämetallien atomien pintojen alle. Yhden 3d-elektronin lisääminen vaikuttaa niiden kemiallisiin ominaisuuksiin huomattavasti vähemmän kuin yhden 3s- tai 3p-elektronin lisääminen edustavien alkuaineiden tapauksessa. Näin ollen ominaisuudet muuttuvat hitaasti mutta tasaisesti siirtymäalkuaineesta toiseen. Huomaa esimerkiksi, että Sc:tä lukuun ottamatta kaikki siirtymämetallit muodostavat klorideja, MCl2, joissa metallin valenssi on 2; esimerkkejä ovat TiCl2, VCl2, CrCl2 ja niin edelleen. Tämä käy ilmi tämän sivun yläosassa olevasta taulukosta. Valenssi 2 vastaa kahta 4s-valenssielektronia.
Kullakin siirtymämetallilla on myös muita valensseja, joissa yksi tai useampi 3d-elektroni on myös mukana. Esimerkiksi joissakin yhdisteissä V:n (vanadiini) valenssi on 2 (VO, VCl2), toisissa 3 (V2O3, VCl3), taas toisissa 4 (VO2, VCl4) ja ainakin yhdessä tapauksessa (V2O5) 5. Siirtymämetallien kemia on monimutkaisempaa, ja vaihtelevan valenssin vuoksi siirtymämetalliyhdisteiden kaavojen kirjo on suurempi. Joissakin tapauksissa d-alakuoren elektronit toimivat valenssielektroneina, kun taas toisissa tapauksissa ne eivät toimi. Vaikka 3d-elektronipilvet eivät ulotu kauemmas ytimestä kuin 3s ja 3p (eivätkä siten muodosta toista kuorta kuten 4s:n elektronit), ne ovat hyvin suojattuja ydinvaraukselta ja toimivat siten usein valenssielektroneina. Tämä 3d-elektronien Jekyll ja Hyde -käyttäytyminen tekee elämästä monimutkaisempaa (ja usein paljon mielenkiintoisempaa) kemisteille, jotka tutkivat siirtymäalkuaineita.
| Z | Elementti | Konfiguraatio | |
|---|---|---|---|
| 1 | H | 1s 1 | |
| 2 | H | 1s 2 | |
| 3 | Li | 2s 1 | |
| 4 | Be | 2s 2 | |
| 5 | B | 2s 2 2p1 | |
| 6 | C | 2s 2 2p2 | |
| 7 | N | 2s 2 2p3 | |
| 8 | 0 | 2s 2 2p4 | |
| 8 | 0 | 2s 2 2p4 | |
| 9 | F | 2s 2 2p5 | |
| 10 | Ne | 2s 2 2p6 | |
| 11 | Na | 3s 1 | |
| 12 | Mg | 3s 2 | |
| 13 | Al | 3s 2 3p1 | |
| 14 | Si | 3s 2 3p2 | |
| 15 | P | 3s 2 3p3 | |
| 16 | S | 3s 2 3p4 | |
| 17 | Cl | 3s 2 3p5 | |
| 18 | Ar | 3s 2 3p6 | |
| 19 | K | 4s 1 | |
| 20 | Ca | 4s 2 | |
| 21 | Sc | 3d 1 4s 2 | |
| 22 | Ti | 3d 2 4s 2 | |
| 23 | V | 3d 3 4s 2 | |
| 24 | Cr | Cr | 3d 5 4s 1 |
| 25 | Mn | 3d 5 4s 2 | |
| 26 | Fe | 3d 6 4s 2 | |
| 27 | Co | 3d 7 4s 2 | |
| 28 | Ni | 3d 8 4s 2 | |
| 29 | Cu | 3d 10 4s 1 | |
| 30 | Zn | 3d 10 4s 2 | |
| 31 | Ga | 3d 10 4s 2 4p 1 | |
| 32 | Ge | 3d 10 4s 2 4p 2 | |
| 33 | As | 3d 10 4s 2 4p 3 | |
| 34 | Se | 3d 10 4s 2 4p 4 | |
| 35 | Br | 3d 10 4s 2 4p 5 | |
| 36 | Kr | 3d 10 4s 2 4p 6 | |
| 37 | Rb | 5s 1 | |
| 38 | Sr | 5s 2 | |
| 39 | Y | 4d 1 5s 2 | |
| 40 | Zr | 4d 2 5s 2 | |
| 41 | Nb | 4d 4 5s 1 | |
| 42 | Mo | 4d 5 5s 1 | |
| 43 | Tc | 4d 5 5s 2 | |
| 44 | Ru | 4d 7 5s 1 | |
| 45 | Rh | 4d 8 5s 1 | |
| 46 | Pd | 4d 10 | |
| 47 | Ag | 4d 10 5s 1 | |
| 48 | Cd | 4d 10 5s 2 | |
| 49 | In | 4d 10 5s 2 5p 1 | |
| 50 | Sn | 4d 10 5s 2 5p 2 | |
| 51 | Sb | 4d 10 5s 2 5p 3 | |
| 52 | Te | 4d 10 5s 2 5p 4 | |
| 53 | I | 4d 10 5s 2 5p 5 | |
| 54 | Xe | 4d 10 5s 2 5p 6 | |
| 55 | Cs | 6s 1 | |
| 56 | Ba | 6s 2 | |
| 57 | La | 5d 1 6s 2 | |
| 58 | Ce | 4f 1 5d 1 6s 2 | |
| 59 | Pr | 4f 3 6s 2 | |
| 60 | Nd | 4f 4 6s 2 | |
| 61 | Pm | 4f 5 6s 2 | |
| 62 | Sm | 4f 6 6s 2 | |
| 63 | Eu | 4f 7 6s 2 | |
| 64 | Gd | 4f 7 5d 1 6s 2 | |
| 65 | Tb | 4f 9 6s 2 | |
| 66 | Dy | 4f 10 6s 2 | |
| 67 | Ho | 4f 11 6s 2 | |
| 68 | Er | 4f 12 6s 2 | |
| 69 | Tm | 4f 13 6s 2 | |
| 70 | Yb | 4f 14 6s 2 | |
| 71 | Lu | 4f 14 5d 1 6s 2 | |
| 72 | Hf | 4f 14 5d 2 6s 2 | |
| 73 | Ta | 4f 14 5d 3 6s 2 | |
| 74 | W | 4f 14 5d 4 6s 2 | |
| 75 | Re | 4f 14 5d 5 6s 2 | |
| 76 | 0s | 4f 14 5d 6 6s 2 | |
| 77 | Ir | 4f 14 5d 7 6s 2 | |
| 78 | Pt | 4f 14 5d 9 6s 1 | |
| 79 | Au | 4f 14 5d 10 6s 1 | |
| 80 | Hg | 4f 14 5d 10 6s 2 | |
| 81 | Tl | 4f 14 5d 10 6s 2 6p1 | |
| 82 | Pb | 4f 14 5d 10 6s 2 6p2 | |
| 83 | Bi | 4f 14 5d 10 6s 2 6p 3 | |
| 84 | Po | 4f 14 5d 10 6s 2 6p 4 | |
| 85 | At | 4f 14 5d 10 6s 2 6p 5 | |
| 86 | Rn | 4f 14 5d 10 6s 2 6p 6 | |
| 87 | Fr | 7s 1 | |
| 88 | Ra | 7s 2 | |
| 89 | Ac | 6d 1 7s 2 | |
| 90 | Th | 6d 2 7s 2 | |
| 91 | Pa | 5f 2 6d 1 7s 2 | |
| 92 | U | 5f 3 6d 1 7s 2 | |
| 93 | Np | 5f 4 6d 1 7s 2 | |
| 94 | Pu | 5f 6 7s 2 | |
| 95 | Am | 5f 7 7s 2 | |
| 96 | Cm | 5f 7 6d 1 s 2 | |
| 97 | Bk | 5f 9 s 2 | |
| 98 | Cf | 5f 10 s 2 | |
| 99 | Es | 5f 11 s 2 | |
| 100 | Fm | 5f 12 s 2 | |
| 101 | Md | 5f 13 s 2 | |
| 102 | Ei | 5f 14 s 2 | |
| 103 | Lr | 5f 14 6d 1 s 2 | |
| 104 | Rf | 5f 14 6d 2 s 2 |
Kolmas alkuaineiden pääluokka syntyy silloin, kun erottautuva elektroni miehittää f-alakuorta. Ensimmäinen esimerkki on lantanoidit (alkuaineet, joiden järjestysluvut ovat välillä 57-71).Lantanoidien yleinen elektronikonfiguraatio on
4d104f i5s25p65d0 tai 16s2
missä i on luku välillä 0-14. Näin ollen lantanoidien rakentumisprosessissa elektroneja lisätään alakuoreen (4f), jonka pääkvanttiluku on kaksi pienempi kuin uloimman orbitaalin (6s). Toisen elektronin lisääminen yhtä syvälle haudattuun sisäkuoreen kuin 4f-kuori vaikuttaa vain vähän tai ei lainkaan näiden alkuaineiden kemiallisiin ominaisuuksiin. Kaikki ovat varsin samankaltaisia kuin lantaani (La), ja ne saattavat mahtua jaksollisessa järjestelmässä täsmälleen samaan tilaan kuin La. Lantanoidiset alkuaineet ovat niin samankaltaisia keskenään, että niiden erottamiseen tarvitaan erityisiä tekniikoita. Tämän vuoksi useimmista niistä valmistettiin edes suunnilleen puhtaita näytteitä vasta 1870-luvulla. Alkuaineen aktinium (Ac) jälkeen seuraa sarja atomeja, joissa 5f-alakuori täyttää. Aktinoidit ovat hieman vähemmän samankaltaisia Ac:n kanssa kuin lantanoidit La:n kanssa, koska Th:n, Pa:n ja U:n kohdalla esiintyy joitakin poikkeuksia tavanomaisesta täyttöorbitaalien järjestyksestä (taulukko \(\(\PageIndex{1}\) ).
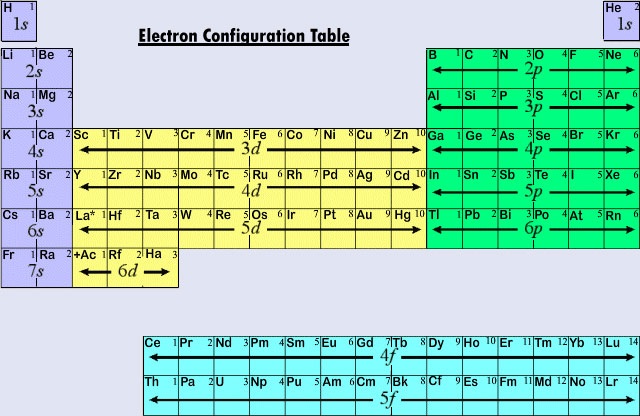
Koska lantanoidit ja useimmat aktinoidit käyttäytyvät kemiallisesti ikään kuin niiden pitäisi sopia jaksollisen järjestelmän IIIB-ryhmään (jossa Lu ja Lr esiintyvät), nämä kaksi ryhmää on erotettu muusta taulukosta, ja ne on sijoitettu yhdessä alla olevaan lohkoon. Yhdessä lantanoideja ja aktinoideja kutsutaan sisäisiksi siirtymäalkuaineiksi, koska täytettävät f-alakuoret sijaitsevat niin syvällä niiden atomien jäljelle jäävässä elektronirakenteessa.
Kuvassa \(\PageIndex{2}\) on esitetty yhteenveto siitä, minkälaisessa alakuoressa erottuva elektroni on jaksollisen järjestelmän eri alueilla olevien alkuaineiden atomeilla. Tämän yhteenvetotiedon avulla on suhteellisen helppoa käyttää jaksollista järjestelmää elektronikonfiguraatioiden saamiseksi, kuten seuraava esimerkki osoittaa.
Esimerkki \(\PageIndex{1}\): Elektronikonfiguraatio
Saa elektronikonfiguraatio a) Nb:lle; b) Pr:lle.
Ratkaisu
a) Nb, alkuaine numero 41, löytyy viidennestä periodista ja jaksollisen järjestelmän alueelta, jossa d-alakuori on täyttymässä (toinen siirtymäsarja). Siirryttäessä taaksepäin (kohti pienempiä järjestyslukuja) jaksollisessa järjestelmässä lähin jalokaasu on Kr, joten käytämme Kr-ydintä:
Nb _____
Seuraavana alkuaineena 36K:n jälkeen on 37Rb, jossa 5s-alikuori täyttyy. Siirryttäessä vielä yhden tilan verran oikealle tulemme 38Sr:ään, jossa on 5s2-pari. Tähän mennessä meillä on Nb _____ 5s2 Nb-konfiguraation osalta. Siirrymme nyt edelleen oikealle jaksollisen järjestelmän 4d-alakuoren alueelle ja laskemme kolme tilaa (Y, Zr, Nb) saavuttaaksemme Nb:n. Elektronien kokonaiskonfiguraatio on siis Nb 4d35s2 (Huomaa, että d-alakuoren pääkvanttiluku on 4 – yksi vähemmän kuin jakson numero). Jos tarkastellaan elektronikonfiguraatioiden taulukkoa, on myös huomattava, että Nb on poikkeus tyypillisistä orbitaalien täyttösäännöistä) b) Samanlaista menettelyä noudatetaan Pr:n, alkuaineen numero 59, kohdalla. Taulukossa taaksepäin mentäessä lähin jalokaasu on Xe, joten käytämme Xe-ydintä. Kun taas lasketaan eteenpäin, Cs ja Ba vastaavat 6s2:ta. Sitten La, Ce ja Pr vastaavat kolmea muuta elektronia 4f-alakuoressa. Konfiguraatio on siis Pr…4f36s2
Vielä on korostettava yhtä seikkaa elektronikonfiguraation ja jaksollisen järjestelmän välisestä suhteesta. Taulukon samassa pystysarakkeessa olevien alkuaineiden atomeilla on samanlaiset elektronikonfiguraatiot. Tarkastellaan esimerkiksi emäksisiä maametalleja (ryhmä IIA). Käyttämällä elektronikonfiguraatioiden johtamissääntöjämme (esimerkki 1) saadaan
| Elementti | Elektronikonfiguraatio | Lewis-diagrammi |
|---|---|---|
| Be | 2s2 | Be: |
| Mg | 3s2 | Mg: |
| Ca | 4s2 | Ca: |
| Sr | 5s2 | Sr: |
| Ba | 6s2 | Ba: |
| Ra | 7s2 | Ra: |
Näin ollen näiden alkuaineiden kemiallisessa käyttäytymisessä ja valenssissa aiemmin todetut samankaltaisuudet korreloivat näiden alkuaineiden uloimpien elektronipilvien samankaltaisuuksien kanssa. Tällaiset samankaltaisuudet selittävät Mendelejevin ennusteiden onnistumisen löytämättömien alkuaineiden ominaisuuksista.
Tekijät ja attribuutiot
-
Ed Vitz (Kutztown University), John W. Moore (UW-Madison), Justin Shorb (Hope College), Xavier Prat-Resina (University of Minnesota Rochester), Tim Wendorff ja Adam Hahn.
