\
Suola voi kuitenkin liueta veteen neutraaliksi liuokseksi, emäksiseksi liuokseksi tai happamaksi liuokseksi sen sisältämien ionien happo-emäs-ominaisuuksista riippuen.
Kun suola, kuten \(NaCl\) liukenee veteen, se tuottaa \(Na^+_{(aq)}\) ja \(Cl^-_{(aq)}\) ioneja. Lewisin lähestymistapaa käyttäen \(Na^+\)-ionia voidaan pitää happona, koska se on elektroniparin akseptori, vaikka sen alhainen varaus ja suhteellisen suuri säde tekevät siitä hyvin heikon hapon. \(Cl^-\)-ioni on vahvan hapon \(HCl\) konjugaattiemäs, joten sillä ei ole olennaisesti emäksistä luonnetta. Näin ollen \(NaCl\):n liuottaminen veteen ei vaikuta liuoksen \(pH\):aan, ja liuos pysyy neutraalina.
Vertaillaan nyt tätä käyttäytymistä kaliumsyanidin ja natriumasetaatin vesiliuosten käyttäytymiseen. Jälleen kerran kationeilla (\(K^+\) ja \(Na^+\)) ei ole olennaisesti hapanta luonnetta, mutta anionit (\(CN^-\) ja \(CH_3CO_2^-\)) ovat heikkoja emäksiä, jotka voivat reagoida veden kanssa, koska ne ovat heikkojen happojen \(HCN\) ja etikkahapon konjugaattiemäksiä, vastaavasti.
\
\
Kumpikaan reaktio ei etene kovin pitkälle oikealle kirjoitettuna, koska heikomman happo-emäsparin muodostumista suositaan. Sekä \(HCN\) että etikkahappo ovat vahvempia happoja kuin vesi, ja hydroksidi on vahvempi emäs kuin joko asetaatti tai syanidi, joten molemmissa tapauksissa tasapaino on vasemmalla. Kummassakin reaktiossa syntyy kuitenkin riittävästi hydroksidi-ioneja emäksisen liuoksen tuottamiseksi. Esimerkiksi 0,1 M natriumasetaatti- tai kaliumsyanidiliuoksen \(pH\) 25 °C:ssa on 8,8 tai 11,1. Taulukosta \(\PageIndex{1}\) ja kuvasta \(\PageIndex{1}\) nähdään, että \(CN^-\) on vahvempi emäs (\(pK_b = 4,79\)) kuin asetaatti (\(pK_b = 9.24\)), mikä on sopusoinnussa sen kanssa, että \(KCN\) tuottaa emäksisemmän liuoksen kuin natriumasetaatti samalla konsentraatiolla.
Kontrastina heikon emäksen konjugaattihapon pitäisi olla heikko happo (yhtälö \(\(\ref{16.2}\)). Esimerkiksi ammoniumkloridi ja pyridiniumkloridi ovat suoloja, jotka saadaan reagoimalla ammoniakin ja pyridiinin kanssa \(HCl\). Kuten jo tiedät, kloridi-ioni on niin heikko emäs, että se ei reagoi veden kanssa. Sen sijaan näiden kahden suolan kationit ovat heikkoja happoja, jotka reagoivat veden kanssa seuraavasti:
\
\
Yhtälö \(\ref{16.2}\) osoittaa, että \(H_3O^+\) on vahvempi happo kuin \(NH_4^+\) tai \(C_5H_5NH^+\), ja päinvastoin ammoniakki ja pyridiini ovat molemmat vahvempia emäksiä kuin vesi. Tasapaino on siis molemmissa tapauksissa kaukana vasemmalla, mikä suosii heikompaa happo-emäsparia. Reaktioiden tuottama \(H_3O^+\)-pitoisuus on kuitenkin niin suuri, että liuoksen \(pH\) laskee merkittävästi: 0,10 M:n ammoniumkloridiliuoksen \(pH\) 25 °C:n lämpötilassa on 5,13 ja pyridiniumkloridiliuoksen \(pH\) 3,12. Tämä on sopusoinnussa kuvassa 16.2 esitettyjen tietojen kanssa, mikä osoittaa, että pyridiniumioni on happamampi kuin ammoniumioni.
Mitä tapahtuu ammoniumasetaatin kaltaisen suolan vesiliuoksessa, jossa sekä kationi että anioni voivat reagoida erikseen veden kanssa muodostaen vastaavasti hapon ja emäksen? Kuvan 16.10 mukaan ammoniumioni laskee \(pH\), kun taas yhtälön \(\ref{16.3}\) mukaan asetaatti-ioni nostaa \(pH\). Tämä tapaus on sikäli epätavallinen, että kationi on yhtä vahva happo kuin anioni on emäs (pKa ≈ pKb). Näin ollen nämä kaksi vaikutusta kumoavat toisensa, ja liuos pysyy neutraalina. Suoloissa, joissa kationi on vahvempi happo kuin anioni on emäs, lopullisen liuoksen \(pH\) < 7,00. Kääntäen, jos kationi on heikompi happo kuin anioni on emäs, lopullisen liuoksen \(pH\) > 7,00.
Metalli-ionien yksinkertaisten suolojen liuokset voivat myös olla happamia, vaikka metalli-ioni ei voi luovuttaa protonia suoraan veteen tuottaakseen \(H_3O^+\). Sen sijaan metalli-ioni voi toimia Lewisin happona ja olla vuorovaikutuksessa veden, Lewisin emäksen, kanssa koordinoimalla happiatomin yksinäisen elektroniparin kanssa muodostaen hydratoidun metalli-ionin (osa (a) kuvassa \(\PageIndex{1}\)). Metalli-ioniin koordinoitu vesimolekyyli on happamampi kuin vapaa vesimolekyyli kahdesta syystä. Ensinnäkin positiivisesti varautuneen metalli-ionin ja koordinoidun vesimolekyylin osittain positiivisesti varautuneiden vetyatomien väliset repulsiiviset sähköstaattiset vuorovaikutukset helpottavat koordinoidun veden protonin menetystä.
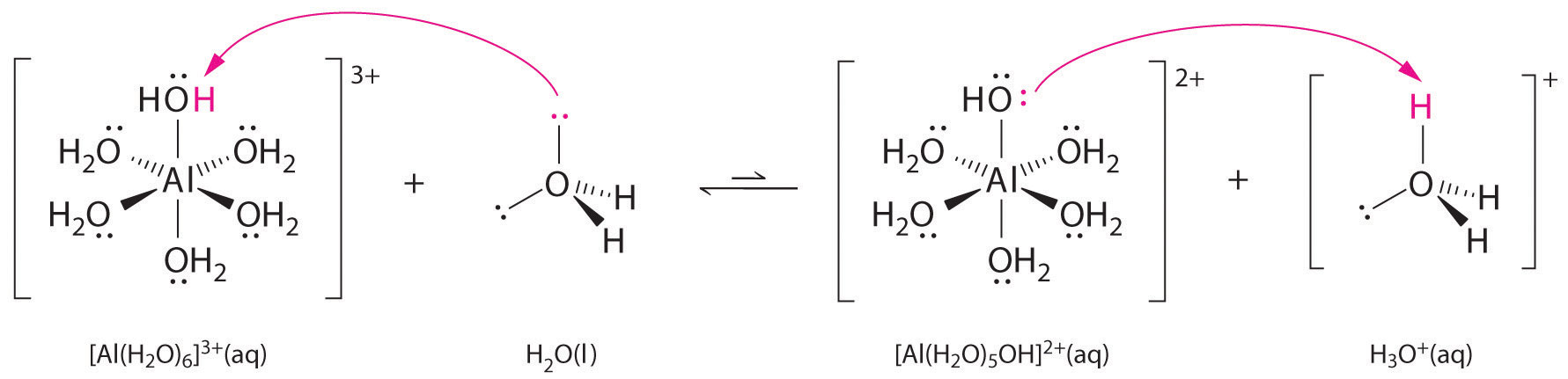
Toiseksi \(Al^{3+}\)-ionin positiivinen varaus vetää puoleensa elektronitiheyttä vesimolekyylien happiatomeista, mikä vähentää elektronitiheyttä \(\ce{O-H}\)-sidoksessa, kuten kuvan \(\PageIndex{1}\) osassa (b) näkyy. Kun \(O\)-atomien ja H-atomien välinen elektronitiheys on pienempi, \(\ce{O-H}\)-sidokset ovat heikompia kuin vapaassa \(H_2O\)-molekyylissä, jolloin \(H^+\)-ionin menettäminen on helpompaa.
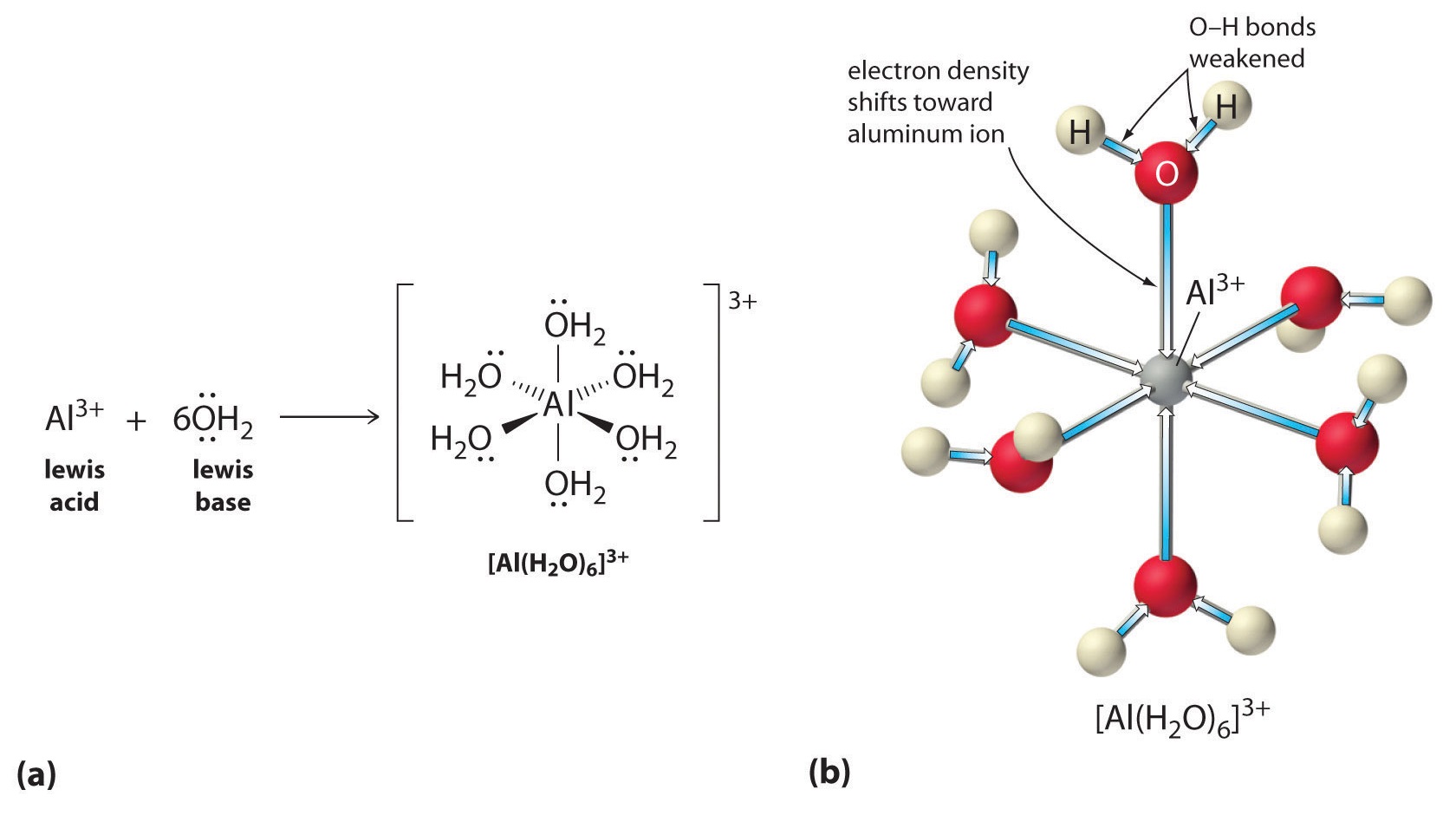
Kuvio \(\(\Sivuindeksi{1}\)\: Metalli-ionin vaikutus veden happamuuteen a) Metalli-ionin \(Al^{3+}\) reagointi veden kanssa hydratoidun metalli-ionin muodostamiseksi on esimerkki Lewisin happo-emäsreaktiosta. (b) Alumiini-ionin positiivinen varaus vetää elektronitiheyttä happiatomeista, mikä siirtää elektronitiheyttä pois O-H-sidoksista. Elektronitiheyden väheneminen heikentää vesimolekyylien O-H-sidoksia ja helpottaa niiden protonin menetystä.
Tämän vaikutuksen suuruus riippuu seuraavista kahdesta tekijästä (kuva \(\(\PageIndex{2}\)):
- Metalli-ionin varaus. Kaksiarvoisella ionilla (\(M^{2+}\)) on noin kaksi kertaa niin voimakas vaikutus koordinoidun vesimolekyylin elektronitiheyteen kuin saman säteen omaavalla yksiarvoisella ionilla (\(M^+\)).
- Metalli-ionin säde. Saman varauksen omaavilla metalli-ioneilla mitä pienempi ioni on, sitä lyhyempi on sisäydinetäisyys vesimolekyylin happiatomiin ja sitä suurempi on metallin vaikutus elektronitiheysjakaumaan vesimolekyylissä.
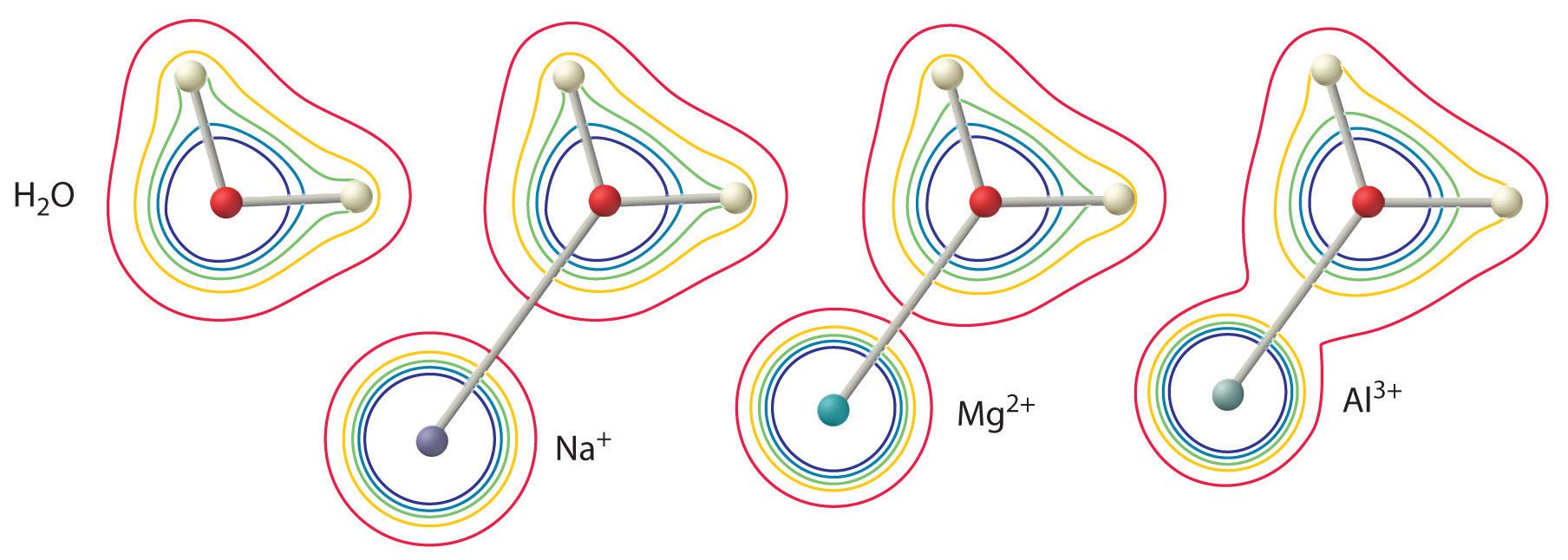
Kuva \(\PageIndex{2}\): Metalli-ionin varauksen ja säteen vaikutus koordinoidun vesimolekyylin happamuuteen. Kuvassa on esitetty O- ja H-atomien elektronitiheys sekä vapaassa vesimolekyylissä (vasemmalla) että \(Na^+\)-, \(Mg^{2+}\)- ja \(Al^{3+}\)-ionien kanssa koordinoiduissa vesimolekyyleissä. Nämä ääriviivakartat osoittavat, että pienin, voimakkaimmin varautunut metalli-ioni (\(Al^{3+}\)) aiheuttaa suurimman elektronitiheyden vähenemisen vesimolekyylin O-H-sidoksissa. Tämän vaikutuksen vuoksi hydratoituneiden metalli-ionien happamuus kasvaa, kun metalli-ionin varaus kasvaa ja sen säde pienenee.
Siten pienten, voimakkaasti varautuneiden metalli-ionien, kuten \(Al^{3+}\) ja \(Fe^{3+}\), vesiliuokset ovat happamia:
\^{3+}_(aq)} \rightleftharpoons ^{2+}_{(aq)}+H^+_{(aq)} \label{16.36}\]
\(^{3+}\)-ionin \(pK_a\) on 5,0, joten se on lähes yhtä vahva happo kuin etikkahappo. Edellä kuvattujen kahden tekijän vuoksi tärkein parametri, jonka avulla voidaan ennustaa metalli-ionin vaikutusta koordinoitujen vesimolekyylien happamuuteen, on metalli-ionin varaus-radiussuhde. Useilla metalli-ionipareilla, jotka sijaitsevat jaksollisen järjestelmän diagonaaliviivalla, kuten \(Li^+\) ja \(Mg^{2+}\) tai \(Ca^{2+}\) ja \(Y^{3+}\), on erisuuruiset ja -varautuneet, mutta samankaltaiset varauksen ja säteen suhteet. Tämän seurauksena näillä metalli-ionipareilla on samanlaisia vaikutuksia koordinoitujen vesimolekyylien happamuuteen, ja niillä on usein myös muita merkittäviä kemiallisia yhtäläisyyksiä.
Pienten, voimakkaasti varautuneiden metalli-ionien liuokset vedessä ovat happamia.
Tässä jaksossa käsiteltyjen kaltaisia reaktioita, joissa suola reagoi veden kanssa antaen happaman tai emäksisen liuoksen, sanotaan usein hydrolyysireaktioiksi. Erillisen nimen käyttäminen tämäntyyppisille reaktioille on valitettavaa, koska se antaa ymmärtää, että ne ovat jotenkin erilaisia. Itse asiassa hydrolyysireaktiot ovat vain happo-emäsreaktioita, joissa happo on kationi tai emäs on anioni; ne noudattavat samoja periaatteita ja sääntöjä kuin kaikki muutkin happo-emäsreaktiot.
Hydrolyysireaktio on happo-emäsreaktio.
Esimerkki \(\PageIndex{1}\)
Arvioi, ovatko näiden yhdisteiden vesiliuokset happamia, emäksisiä vai neutraaleja.
- \(KNO_3\)
- \(CrBr_3 cdot H_2O\)
- \(Na_2SO_4\)
Annettu: yhdiste
Kysytty:
Strategia:
- Arvioi kationin ja anionin happo-emäsominaisuudet. Jos kationi on heikko Lewisin happo, se ei vaikuta liuoksen \(pH\) arvoon. Jos kationi on heikon emäksen konjugaattihappo tai suhteellisen voimakkaasti varautunut metallikationi, se kuitenkin reagoi veden kanssa muodostaen happaman liuoksen.
- Jos anioni on vahvan hapon konjugaattiemäs, se ei vaikuta liuoksen \(pH\) arvoon. Jos anioni on kuitenkin heikon hapon konjugaattiemäs, liuos on emäksinen.
Liuos:
a
- Kationilla \(K^+\) on pieni positiivinen varaus (+1) ja suhteellisen suuri säde (koska se on jaksollisen järjestelmän neljännellä rivillä), joten se on hyvin heikko Lewisin happo.
- \(NO_3-\)-anioni on vahvan hapon konjugaattiemäs, joten sillä ei ole olennaisesti emäksistä luonnetta (taulukko 16.1). Näin ollen kationi tai anioni ei reagoi veden kanssa tuottaen \(H^+\) tai \(OH^-\), ja liuos on neutraali.
b.
- \(Cr^{3+}\)-ioni on suhteellisen korkeasti varautunut metallikationi, jonka pitäisi käyttäytyä samalla tavalla kuin \(Al^{3+}\)-ionin ja muodostaa \(^{3+}\)-kompleksi, joka käyttäytyy heikkona happona: \^{3+}_{(aq)} \ce{ <=>>}} Cr(H_2O)_5(OH)]^{2+}_{(aq)} + H^+_{(aq)} \nonumber\]
- \(Br^-\)-anioni on hyvin heikko emäs (se on vahvan hapon \(HBr\) konjugaattiemäs), joten se ei vaikuta liuoksen \(pH\) arvoon. Näin ollen liuos on hapan.
c.
- \(Na^+\)-ioni on \(K^+\)-ionin tavoin hyvin heikko happo, joten sen ei pitäisi vaikuttaa liuoksen happamuuteen.
- Vastakohtaisesti \(SO_4^{2-}\)-ionin \(SO_4^{2-}\)-ioni on heikon hapon \(HSO_4^-\)-ionin konjugaattiemäs. Näin ollen \(SO_4^{2-}\)-ioni reagoi veden kanssa kuvan 16.6 osoittamalla tavalla antaen lievästi emäksisen liuoksen.
Harjoitus \(\PageIndex{1}\)
Arvioi, ovatko seuraavien aineiden vesiliuokset happamia, emäksisiä vai neutraaleja.
- neutraali
- hapan
- emäksinen (koska \(HS^-\) reagoi veden kanssa muodostaen \(H_2S\) ja \(OH^-\))
Yhteenvetoa
Suola voi liueta veteen muodostaen neutraalin, emäksisen tai happaman liuoksen riippuen siitä, sisältääkö se anionina heikon hapon konjugoitua emästä (\(A^-\)), kationina heikon emäksen konjugoitua happoa (\(BH^+\)) vai molempia. Pieniä, voimakkaasti varautuneita metalli-ioneja sisältävät suolat tuottavat happamia liuoksia veteen. Suolan reaktiota veden kanssa happaman tai emäksisen liuoksen tuottamiseksi kutsutaan hydrolyysireaktioksi.
