JOHDANTO
Viime vuosina tehdyissä perustutkimuksissa ja kliinisissä tutkimuksissa on todettu, että kroonisen munuaissairauden ja sydän- ja verisuonitautien välillä vallitsee suora ja kaksisuuntainen suhde.1,2 Päivittäisessä kliinisessä käytännössä munuaistoiminnan arviointiin käytetään yleisesti seerumin kreatiniinipitoisuuksia ja Cockcroft-Gault3 -kaavalla tai Modification of Diet in Renal Disease (MDRD)4 -yhtälöllä (Modification of Diet in Renal Disease) arvioitua glomerulussuodatusnopeutta. Plasman kreatiniinipitoisuuksiin voivat kuitenkin vaikuttaa monet tekijät, kuten potilaan ikä, sukupuoli, lihasmassa, fyysinen aktiivisuus, ruokavalio ja lääkitys.5
Kystatiini C on kysteiiniproteaasin inhibiittoriproteiini, jota syntetisoidaan vakiintuneella nopeudella kaikissa ydinsoluissa. Matalan molekyylipainonsa ja korkean isoelektrisen pisteensä vuoksi se voidaan eliminoida lähes yksinomaan glomerulussuodatuksen kautta. Ikä, sukupuoli tai proteiinien nauttiminen eivät vaikuta kystatiini C:n pitoisuuksiin, ja ne ovat herkkiä pienille muutoksille glomerulussuodatuksessa. Näiden ominaisuuksien vuoksi plasman kystatiini C -pitoisuutta pidetään yhtenä parhaista glomerulussuodatuksen tilan merkkiaineista.6-9 Viime aikoina useissa tutkimuksissa on raportoitu kohonneiden kystatiini C -arvojen ja sepelvaltimotautipotilaiden sydän- ja verisuonikomplikaatioiden kehittymisen välisestä yhteydestä. Tällä hetkellä ei tiedetä, johtuuko tämä yhteys siitä, että kystatiini C on parempi munuaistoiminnan merkkiaine kuin seerumin kreatiniini, vai onko glomerulussuodatuksen lisäksi muita tekijöitä, jotka vaikuttavat tämän proteiinin pitoisuuteen ja ovat lisäksi yhteydessä sydän- ja verisuonitautiriskiin10.
Tämän tutkimuksen tavoitteena oli arvioida plasman kystatiini C-pitoisuuden ennustearvoa korkean riskin akuutin sepelvaltimotautioireyhtymän (ACS) vuoksi sairaalahoitoon joutuneilla potilailla sekä tutkia kystatiini C:n ja muiden munuaistoiminnan ja tulehduksen merkkiaineiden välistä yhteyttä.
MENETELMÄT
Tämä on prospektiivinen, havainnointitutkimus, joka tehtiin toukokuun 2006 ja heinäkuun 2007 välisenä aikana. Tutkimukseen otettiin mukaan yhteensä 203 yli 18-vuotiasta potilasta, jotka olivat peräkkäin sairaalahoidossa keskuksemme sydämen teho-osastolla (ICU) ja joilla oli diagnosoitu korkean riskin ACS.
Korkean riskin ACS:n diagnostisiin kriteereihin kuului vähintään kaksi seuraavista tekijöistä: kipu, jolla oli iskeemisiä piirteitä, iskemian kanssa sopusoinnussa olevat elektrokardiografiset muutokset ja/tai kohonneet sydänlihaksen nekroosimarkkerit. Potilaan sairaalassaoloaikana annettu hoito ja tehdyt lisäkokeet perustuivat hoitavan lääkärin kliinisiin päätöksiin. Useimmilla potilailla käytettiin invasiivista strategiaa, johon kuului kiireellinen sepelvaltimoiden varjoainekuvaus (sydäninfarktissa, jossa on ST-segmentin kohoaminen tai vasemman päähaarakatkos) tai varhainen suunnitelmallinen sepelvaltimoiden varjoainekuvaus ensimmäisten 24-72 tunnin aikana sairaalahoitoon tulosta.
Kliiniset ominaisuudet
Potilaiden sairauskertomuksista kirjattiin seuraavat tiedot: demografiset tiedot, klassisten sydän- ja verisuonitautien riskitekijöiden esiintyminen (diabetes mellitus, systeeminen verenpainetauti, dyslipidemiat ja tupakointi) sekä tiedossa oleva verisuonisairaus (iskeeminen sydänsairaus, aivoverisuonisairaus, perifeerinen valtimosairaus ja aiempi sydänlihaksen revaskularisaatiohoito). Muita analysoituja kliinisiä muuttujia olivat ACS:n tyyppi, Killip-luokka sairaalahoitohetkellä, systoliset ja diastoliset painearvot, pulssipaine (arvioitu systolisen ja diastolisen valtimopaineen erotuksena) ja syke.
Kaikille potilaille tehtiin kaikukardiografia, jossa vasemman kammion ejektiofraktio arvioitiin Simpsonin menetelmällä käyttäen 4-kammioperäistä lähestymistapaa; sinusrytmissä oleville potilaille laskettiin kolmen määrityksen keskiarvo ja eteisvärinää sairastaville potilaille viiden määrityksen keskiarvo.
95 prosentille potilaista tehtiin sepelvaltimoiden varjoainekuvaus, ja sepelvaltimovaurioiden vaikeusaste arvioitiin pisteytyksellä, joka perustui vaurioituneiden epikardiaalisten sepelvaltimoiden määrään.
Analyyttiset tiedot
Haamoglobiinin, hematokriitin, leukosyyttien, glukoosin ja kreatiniinin perusarvot kirjattiin ensimmäisiin laboratorioanalyyseihin, jotka tehtiin keskuksessamme sairaalahoidon yhteydessä. Kokonaiskolesterolin, suuren tiheyden lipoproteiinikolesterolin (HDL-C), pienen tiheyden lipoproteiinikolesterolin (LDL-C), glukoosin, korkean herkkyyden C-reaktiivisen proteiinin ja kystatiini C:n pitoisuudet kirjattiin ensimmäisten 24 tunnin aikana yhdessä troponiini I:n (TpI) huipputason kanssa.
Kystatiini C mitattiin automaattisella homogeenisella immunomäärityksellä käyttäen Dade-Behring BN ProSpec -nefelometriä. Analyysissä käytettävä reagenssi koostui polystyreenipartikkeleista, jotka on päällystetty proteiinin vasta-aineilla, jotka agglutinoituvat, kun ne sekoitetaan kystatiini C:tä sisältäviin näytteisiin, ja hajottavat valoa intensiteetillä, joka on verrannollinen analyytin pitoisuuteen.
Aikuisten seerumin kystatiini C:n pitoisuuden vertailuväli käytetyllä nefelometrisellä menetelmällä on 0,51-0,95 mg/l. Myös korkean herkkyyden C-reaktiivisen proteiinin pitoisuudet määritettiin immunomäärityksellä. Glomerulussuodatusnopeus arvioitiin MDRD-yhtälöllä.
Analysoidut komplikaatiot
Analysoituihin sydän- ja verisuonikomplikaatioihin kuuluivat sairaalakuolleisuus, kokonaiskuolleisuus seurannan aikana, uuden sydäninfarktin kehittyminen, joka määriteltiin rintakivuksi tai vastaavaksi anginaaliseksi kivuksi, johon liittyi EKG-muutoksia, tai kohonneet tuumorinekroosimarkkerit ensimmäisten sairaalahoitoa seuranneiden 24 tunnin aikana (pois suljettiin potilaat, joilla oli kohonneita merkkiaineita sepelvaltimoiden toimenpidetapahtumien jälkeen) ja sydämen vajaatoiminnan kehittyminen sairaalahoidon tai seurannan aikana.
Kliininen seuranta
Keskimääräinen seuranta-aika oli 186 (SD, 110; mediaani, 156) vuorokautta, jona aikana kaikki potilaiden kliiniset tapahtumat kirjattiin. Seuranta suoritettiin ottamalla yhteyttä puhelimitse, poliklinikoilla ja tarkastelemalla potilaiden sairauskertomuksia.
Tilastollinen analyysi
Kaikki tiedot kirjattiin prospektiivisesti tietokantaan, joka luotiin Microsoft Office Access 2003 SP2:lla. Tilastolliset analyysit tehtiin SPSS-ohjelman (Statistical Package for the Social Sciences) versiolla 12.0. Kategoriset tai dikotomiset muuttujat ilmaistaan absoluuttisina arvoina ja prosentteina, ja niitä verrattiin Pearsonin χ2-testillä. Jatkuvat muuttujat, joilla on normaali jakauma, kuvataan keskiarvona (SD), ja ryhmien väliseen vertailuun käytettiin Studentin t-testiä. Muuttujia, joilla ei ollut Gaussin jakaumaa, verrattiin Mann-Whitneyn U-testillä.
Spearmanin korrelaatiokerrointa käytettiin arvioitaessa kystatiini C:n pitoisuuden korrelaatioita korkean herkkyyden C-reaktiivisen proteiinin ja glomerulussuodatusnopeuden kanssa. Logistisella regressioanalyysillä arvioitiin kliinisten ja laboratoriotekijöiden riippumatonta roolia kystatiini C:n suhteen kardiovaskulaaristen komplikaatioiden kehittymisen ennustamisessa sairaalahoidon aikana, mukaan lukien merkittävät muuttujat univariaattianalyysissä. Mukautetut odds-suhteet ja 95 prosentin luottamusvälit (CI) esitetään. Kaplan-Meierin eloonjäämiskäyrät seurannan aikana muodostettiin ja niitä verrattiin long-rank-testillä.
Tutkimuksen kohteena olleen populaation kuvailevan analyysin suorittamiseksi eräät kvantitatiiviset muuttujat luokiteltiin väleihin: glomerulussuodatusnopeus (>90, 90-60, 55 % ja 0,95 ja
P-arvoa, joka oli pienempi kuin .05, pidettiin tilastollisesti merkitsevänä.
TULOKSET
Tutkimukseen otettiin mukaan toukokuusta 2006 heinäkuuhun 2007 203 potilasta, jotka olivat joutuneet sairaalaan korkean riskin ACS-diagnoosin vuoksi. Keski-ikä oli 66,6 (13,16) vuotta. Kaikista potilaista 62,1 %:lla (n=126) oli ei-ST-nousu ACS ja 37,9 %:lla (n=77) ST-nousu ACS. Tutkimuspopulaation perusominaisuudet on kuvattu taulukossa 1.
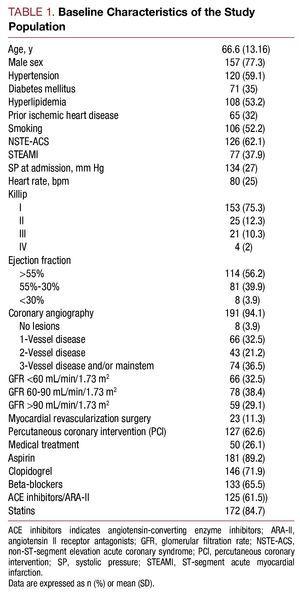
Kystatiini C:n pitoisuuden mediaani oli 1,01 (vaihteluväli 0,83-1,35) mg/l, plasman kreatiniini ensimmäisen kerran tehdyssä analyysissä oli 1 (0.9-1,3) mg/l, glomerulussuodatusnopeus oli 72,4 (49,12-93,73) ml/min/1,73 m2 ja korkean herkkyyden C-reaktiivinen proteiini oli 1,37 (0,46-5,02) mg/l. Glomerulussuodatus sairaalahoitohetkellä oli 2 32,5 %:lla potilaista ja seerumin kystatiini C oli >0,95 mg/l 113 (55,7 %) potilaalla.
Potilailla, joilla oli korkeammat kystatiini C -arvot, oli huonompi kliininen profiili, he olivat iäkkäämpiä, heillä oli paljon verenpainetautia, huonompi Killip-luokka sairaalahoitohetkellä, vakavampi sepelvaltimotauti sepelvaltimoiden angiografiassa ja korkeammat plasman kreatiniini- ja C-reaktiivisen proteiinin arvot (taulukko 2).
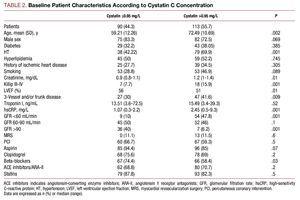
Toteutetun sepelvaltimotoimenpiteen suhteen ei ollut merkitseviä eroja kahden kystatiini C -ryhmän välillä; lopullisessa angiografiatuloksessa onnistumisprosentti oli samankaltainen eikä merkittäviä komplikaatioita ollut havaittavissa (potilailla, joiden kystatiini C:n keskiarvo oli ≤0,95, vastaava osuus potilaiden kohdalla oli 3,27 % ja toisessa ryhmässä 4,09 %). Farmakologisen hoidon analyysi osoitti, että beetasalpaajia ja aspiriinia käytettiin huomattavasti enemmän ryhmässä, jossa kystatiini C ≤0,95 (taulukko 2).
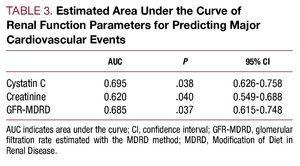
Serumin kystatiini C -arvoilla oli korkeampi korrelaatio arvioidun glomerulussuodatusnopeuden kanssa (r=-0,655; P=,001) (kuva 1) kuin mikroalbuminurian kanssa (r=0,302, P=,01) ja matalampi korrelaatio C-reaktiivisen proteiinin kanssa (r=0,29; P=,01).
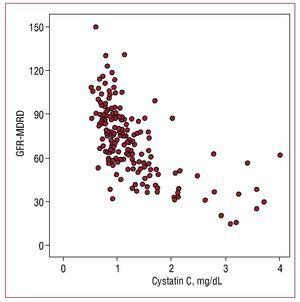
Kuvio 1. Kystatiini C -arvojen ja MDRD-kaavalla arvioidun glomerulussuodatusnopeuden (GFR-MDRD) välinen korrelaatio.
Potilaiden ryhmässä, joiden kystatiini C -arvot olivat >0,95, 6,5 %:lla esiintyi normaali glomerulussuodatusnopeus ja 46 %:lla glomerulussuodatusnopeus välillä 60-90 ml/min/1,73 m2. Lisäksi 10 %:lla potilaista, joilla oli munuaisten toimintahäiriö, jonka suodatusnopeus oli 2, oli kystatiini C -arvot
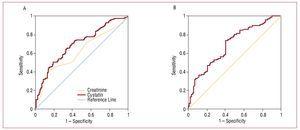
Kuva 2. Kystatiini C -arvot. A, Kystatiini C:n ja kreatiniinin ROC-arvot suhteessa sydän- ja verisuonikomplikaatioiden (sydämen vajaatoiminta, infarkti ja sydän- ja verisuonikuolema) kehittymiseen. B, MDRD:llä arvioidun glomerulussuodatusnopeuden ROC-käyrä suhteessa sydän- ja verisuonikomplikaatioiden (sydämen vajaatoiminta, infarkti ja sydän- ja verisuonitautikuolema) kehittymiseen.
Sairaalassaoloaika kesti mediaanisti 9 (6-19) päivää. Vastaanottohetkestä tutkimuksen seurannan päättymiseen 56 (27,58 %) potilasta koko otoksesta oli sairastunut sydämen vajaatoimintaan, joista suurin osa kuului ryhmään, jossa kystatiini C -arvot olivat koholla (45 potilasta). Sairaalakuolleisuus oli merkitsevästi suurempi ryhmässä, jossa kystatiini C -arvot olivat koholla (17,6 % vs. 3,3 %; P=,001), ja nämä erot säilyivät seurannan aikana (kuva 3, taulukko 4).
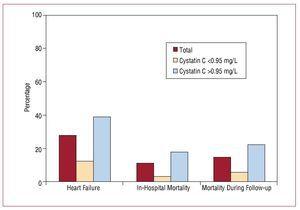
Kuvio 3. Kystatiini C 0,95 mg/L:n ja sairaalan sisäisten sydän- ja verisuonitapahtumien kehittymisen välinen yhteys.

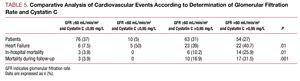
Yksimuuttuja-analyysissä ei havaittu yhteyttä kardiovaskulaaristen komplikaatioiden ja ACS:n tyypin, hyperlipidemian tai TpI-huippukonsentraation välillä, mutta yhteys havaittiin muihin kardiovaskulaarisiin riskitekijöihin: sairastuneiden verisuonten lukumäärään, ulostulon murto-osaan, munuaistoiminnan markkereihin, kystatiini C:hen ja korkea-herkkään C-reaktiiviseen proteiiniin. Kun analysoitiin niiden potilaiden tuloksia, joiden glomerulussuodatusnopeus oli >60 ml/min/1,73 m2 , havaittiin, että potilailla, joiden kystatiini C >0.95 mg/l esiintyi merkittävästi enemmän sydän- ja verisuonikomplikaatioita kuin potilailla, joiden glomerulussuodatus >60 ja kystatiini C 60 ja kystatiini C
Arvioitu tapahtumavapaa eloonjäämisosuus (ts. ei sydämen vajaatoimintaa, sydäninfarktia tai kuolemaa) keskimääräisen 186 vuorokauden seurannan jälkeen oli merkitsevästi korkeampi potilasryhmään kuuluvilla potilailla, joilla oli kystatiiniarvot ≤0.95 mg/l: 75 % verrattuna 44 %:iin (P=.02) (kuva 4).

Kuvio 4. Kaplan-Meierin käyrät suurista sydän- ja verisuonitapahtumista vapaan eloonjäämisen todennäköisyyden arvioimiseksi kystatiini C-arvon mukaan.
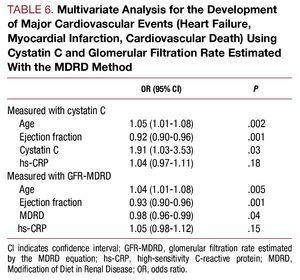
Monimuuttuja-analyysissä ikä, ejektiofraktio ja kystatiini C-pitoisuus todettiin sairaalahoidon aikaisten sydän- ja verisuonitautikomplikaatioiden itsenäisiksi ennustetekijöiksi (taulukko 6).
JOHTOPÄÄTÖKSET
Tämän tutkimuksen tulokset viittaavat siihen, että kohonneet kystatiini C -arvot ennustavat sairaalahoidon aikaista sydämen vajaatoimintaa, sydäninfarktia ja sydän- ja verisuonitautien aiheuttamaa kuolemantapausta potilailla, joilla on suuririskinen AVHK:n aiheuttama sydän- ja verisuonitautien vajaatoiminta (ACS), itsenäisesti riippumatta muista klassisista riskitekijöistä. Lisäksi plasman kystatiini C -arvolla saattaa olla paremmat mahdollisuudet osittaa potilaat, joilla on suuri riski sydän- ja verisuonikomplikaatioihin sairaalahoidon aikana, kuin muilla munuaisten toiminnan arviointimenetelmillä. Havaitsimme, että kohonnut kystatiini C oli yhteydessä huonompaan kardiovaskulaariseen ennusteeseen myös niiden potilaiden ryhmässä, joiden glomerulussuodatus oli normaali. Tietojemme mukaan tämä on ensimmäinen raportti tästä yhteydestä, ja uskomme, että sillä voi olla merkitystä riskien stratifioinnissa tässä potilasryhmässä.
Viime vuosina useissa artikkeleissa on kuvattu munuaisten toimintahäiriön ja sydän- ja verisuonitautikomplikaatioiden välistä läheistä yhteyttä akuuttia ja kroonista iskeemistä sydänsairautta sairastavien potilaiden seurannassa sekä muissa sydän- ja verisuonitautien kliinisissä ilmenemismuodoissa, erityisesti sydämen vajaatoiminnassa.1,10-12 Glomerulusfiltraation aleneminen alle 60 millilitraan minuutissa liittyy kuoleman, sydäninfarktin ja aivohalvauksen riskin merkittävään kasvuun sekä potilailla, joilla on tai joilla ei ole aiempaa sydän- ja verisuonitautia.13 Tämä yhteys on kuvattu erityisesti ACS-potilailla, joilla on ST-nousu, ja potilailla, joilla ei ole ST-nousua.10,13-15 VALIANT-tutkimuksessa16 (potilaat, joilla oli kammion toimintahäiriö ja sydämen vajaatoiminta ST-nousua aiheuttavan sydäninfarktin jälkeen) munuaistoiminnan heikkeneminen (jota arvioitiin glomerulusfiltraatioluvun avulla) liittyi kuolleisuuden ja sydän- ja verisuonikomplikaatioiden lisääntymiseen seurannan aikana. Samanlaisia tuloksia on raportoitu SAVE- (postinfarktin jälkeinen kammion toimintahäiriö), HOPE- (potilaat, joilla on suuri sydän- ja verisuonitautiriski, joista suurimmalla osalla on krooninen iskeeminen sydänsairaus) ja PEACE-tutkimuksissa (potilaat, joilla on krooninen iskeeminen sydänsairaus) mukana olleista potilasryhmistä. Näissä tutkimuksissa munuaisten toimintahäiriön ja ennusteen välinen yhteys havaittiin alentuneen glomerulussuodatusnopeuden sekä virtsan albumiinin erittymisen osalta.16-19
Kuten edellä mainittiin, munuaisten toimintahäiriön ja sydän- ja verisuonitautien välillä on kuvattu suora kaksisuuntainen yhteys. Krooninen munuaisten vajaatoiminta suosii verenpainetaudin ja dyslipidemian kehittymistä ja edistää reniini-angiotensiini-aldosteronijärjestelmän aktivoitumista. Nämä tekijät yhdessä tulehdusvälittäjäaineiden lisääntymisen kanssa näyttävät lisäävän vapaiden radikaalien tuotantoa, jotka vaikuttavat ateroskleroottiseen prosessiin ja sydän- ja verisuonivaurioihin. Lisäksi mineraaliaineenvaihdunnan muutokset (kalkkeutumista edistävien tekijöiden lisääntyminen ja kalkkeutumisen estäjien väheneminen) edistävät kalsiumin kertymistä sepelvaltimoihin.20,21 Munuaisten toimintahäiriöistä kärsivillä potilailla on kuvattu, että kliinisesti ja ennusteteknisesti hyödyllisiksi tunnustettuja terapeuttisia toimenpiteitä käytetään vähemmän intensiivisesti. Erityisesti ACS-potilailla vähemmän aggressiivinen hoito ja pidemmät viiveet sepelvaltimotoimenpiteiden suorittamisessa sekä IIb/IIIa:n, reniini-angiotensiini-aldosteroniakselin salpaajien, beetasalpaajien, statiinien ja verihiutaleiden muodostumista estävien aineiden vähäisempi käyttö voivat osaltaan vaikuttaa tässä potilasryhmässä kuvattuun huonompaan ennusteeseen22.
Päiväisessä kliinisessä käytännössä munuaisten toiminnan arviointi perustuu yleensä seerumin kreatiniinimäärityksiin ja glomerulussuodatusnopeuden arvioihin Cockcroft-Gault- tai MDRD-kaavojen avulla. Näihin molempiin menetelmiin liittyy useita rajoituksia, joista monet johtuvat kreatiniinin tuotantoon vaikuttavista tekijöistä, kuten iästä, naissukupuolesta, rotuun liittyvistä ominaisuuksista, ruokavaliosta ja kroonisten sairauksien kulusta.
Näitä yhtälöitä arvioitiin äskettäin sydämen vajaatoimintaa sairastavilla potilailla ja niitä verrattiin NT-proBNP:hen, joka on ennusteellinen merkkiaine. NT-proBNP:n antaman ennustetiedon todettiin olevan parempi kuin MDRD-kaavalla arvioidun munuaistoiminnan.23
Kystatiini C:llä on molekulaarisia ja metabolisia ominaisuuksia, jotka tekevät tämän proteiinin plasmapitoisuuksista hyvän biologisen merkkiaineen munuaistoiminnan arvioimiseksi; pienet toiminnalliset muutokset havaitaan suuremmalla herkkyydellä kuin tähän tarkoitukseen käytetyt tavanomaiset parametrit.24 Tämä voi perustella sitä, että niiden potilaiden ryhmässä, joiden seerumin kystatiini C-pitoisuus oli yli normaalin ylärajan, 15 prosentilla oli normaali glomerulussuodatusnopeus; kystatiini C:n määrittäminen voi olla hyödyllistä niiden potilaiden tunnistamisessa, joilla on prekliininen munuaissairaus.6.
Tässä tutkimuksessa saadut tulokset ovat jossain määrin sopusoinnussa raportoitujen havaintojen kanssa, jotka osoittavat, että kystatiini C on riippumaton kardiovaskulaaristen komplikaatioiden ennustaja sepelvaltimotautipotilailla.25-27 Lisäksi tietojemme perusteella tätä käsitystä voidaan laajentaa koskemaan potilaita, joilla on normaali glomerulussuodatusnopeus. Jernberg ym.26 analysoivat plasman kystatiini C -arvojen ja ennusteen välistä suhdetta potilasryhmässä, joka oli sairaalahoidossa muun kuin ST-nousu ACS:n vuoksi, ja raportoivat merkittävän yhteyden kystatiini C -arvojen ja kuolleisuuden välillä. On myös kuvattu, että kohonneet kystatiini C-pitoisuudet ovat yhteydessä lisääntyneeseen kuoleman, sydän- ja verisuonikomplikaatioiden ja sydämen vajaatoiminnan ilmaantuvuuden riskiin avohoidossa olevilla kroonista sepelvaltimotautia sairastavilla potilailla.24 Iäkkäillä henkilöillä, joilla ei ole manifesti ilmennyttä munuaissairautta, kystatiini C on kuoleman, sydän- ja verisuonitautien ja kroonisen munuaissairauden riskimerkkiaine.6 Nykyisessä tutkimuksessamme havaitsimme, että potilailla, joilla oli kohonnut kystatiini C -pitoisuus, oli huonompi riskiprofiili; suhteellisen matala C-reaktiivisen proteiinin pitoisuus yllätti meidät kuitenkin. Uskomme, että tämä selittyy proteiinin kinetiikalla, jolla on spesifinen, karakterisoitu spektri, jossa sen arvo riippuu näytteenottohetkestä (huippu tapahtuu 49 tunnin kuluttua oireiden alkamisesta, ja myöhäisempi huippu on nähtävissä ST-segmenttivaikutteisessa akuutissa sydäninfarktissa); tutkimuksessamme näytteet otettiin sairaalahoitoa seuraavien ensimmäisten 24 tunnin aikana.28 Tutkimuksemme potilaita koskeneet sydän- ja verisuonikomplikaatiot poikkeavat viimeaikaisissa rekistereissä29 julkaistuista komplikaatioista, mikä voi johtua siitä, että mukaan otettiin potilaita, joilla oli erittäin suuri riski ja joilla komplikaatioiden esiintyvyys oli suurempi. Äskettäin julkaistussa MASCARA-rekisterissä vain 50 prosenttia mukana olleista potilaista oli alun perin otettu teho-osastolle tai sydänpotilaiden teho-osastolle, kun taas kaikki meidän potilaamme tulivat sydänpotilaiden teho-osastolta, mikä epäilemättä merkitsee jonkinasteista valintavirhettä. Potilasryhmä, jossa kystatiini C:n pitoisuus oli koholla, koostui kuitenkin väestöstä, jonka riskiprofiili ja sydän- ja verisuonikomplikaatioiden määrä oli huomattavasti suurempi kuin muiden potilaiden. Tämä tutkimus auttaa osaltaan tarkentamaan näitä assosiaatioita tarjoamalla ensimmäisen raportin siitä, että kohonneet kystatiini C-pitoisuudet korkean riskin ACS:n sairaalahoidon ensimmäisinä tunteina ovat itsenäinen sairaalahoidon aikaisten sydän- ja verisuonikomplikaatioiden ennustaja. Lisäksi kystatiini C:n ja sydän- ja verisuonikomplikaatioiden riskin välinen yhteys on suurempi kuin muiden munuaisten toiminnan arvioinnissa yleisesti käytettyjen muuttujien yhteys, ja se säilyy myös niiden potilaiden ryhmässä, joiden glomerulussuodatus on normaali. Tällä hetkellä ei tiedetä tarkkaan, johtuuko kyky ennustaa suurempaa komplikaatioriskiä siitä, että kystatiini C on parempi munuaisten toiminnan merkkiaine kuin muut yleisesti käytetyt parametrit (seerumin kreatiniini ja glomerulussuodatusnopeus), vai siitä, että glomerulussuodatuksen lisäksi on olemassa muitakin tekijöitä, jotka vaikuttavat kystatiini C:n pitoisuuteen ja jotka voivat olla suoraan yhteydessä sydän- ja verisuonitautien riskiin. Tällä linjalla on kuvattu plasman C-reaktiivisen proteiinin arvojen ja fibrinogeenin positiivinen korrelaatio kohonneiden kystatiini C-pitoisuuksien ja sydän- ja verisuonitautien esiintymisen kanssa.30 PRIME-tutkimuksessa (Prospective Epidemiological Study of Myocardial Infarction) tutkittiin kystatiini C:n ja akuutin sydäninfarktin sydänkuoleman ja angina pectoriksen kehittymisen välistä yhteyttä potilailla, joilla ei ollut sepelvaltimotautia. Yleisten sydän- ja verisuonitautien riskitekijöiden huomioon ottamisen jälkeen plasman kystatiini C -pitoisuus oli merkitsevästi yhteydessä ensimmäisen sepelvaltimotautikomplikaation kehittymiseen, joka oli iskeemistä alkuperää. Kirjoittajien mielestä alentunut glomerulussuodatusnopeus ei perustelisi tapausten korkeampia kystatiini C -arvoja kontrolliryhmiin verrattuna, ja he ehdottivat, että tulehdus voisi olla syynä kystatiini C:n ja sydän- ja verisuonitautiriskin väliseen yhteyteen.31,32 Näiden tietojen mukaisesti tuloksemme osoittivat positiivisen korrelaation kystatiini C:n ja korkean herkkyyden C-reaktiivisen proteiinin välillä (r=0,2), joka on myös riippumaton sydän- ja verisuonitautikomplikaatioiden ennustaja, ja ne tarjoavat lisänäyttöä munuaissairauksien, tulehduksen ja sydän- ja verisuonitautien suorien yhteyksien olemassaolosta.
Esitetyn tutkimuksen tärkeimpiin rajoituksiin kuuluu, että meidän on huomautettava, että tulokset koskevat vain potilaita, joilla on korkean riskin ACS ja jotka on sairaalahoidettu sydämen teho-osastolle ja joista suurin osa on hoidettu aggressiivisesti varhaisessa vaiheessa sepelvaltimoiden varhaista angiografiaa käyttäen. Toisaalta näitä ominaisuuksia olisi korostettava, koska tästä erityispopulaatiosta, josta kystatiini C mitattiin sairaalaan tullessa, on vain vähän tietoa. Läheskään kaikissa julkaistuissa tutkimuksissa ei ole ilmoitettu määritysten ajankohtaa, ja ainakin ACS-potilailla plasman kystatiini C-pitoisuuksiin voivat vaikuttaa tapahtumasta kulunut aika sekä tehdyt diagnostiset ja terapeuttiset toimenpiteet. Lyhyen seurannan rajoitus estää havaintojemme ulottamisen keskipitkälle tai pitkälle aikavälille. Havaintomme tarjoavat kuitenkin mahdollisuuden parantaa riskistratifiointia korkean riskin ACS:n vuoksi sairaalahoitoon otetuilla potilailla, mikä on hyödyllistä sekä hoidosta päätettäessä että diagnoosia määritettäessä.
PÄÄTELMÄT
Kystatiini C:n määritys sairaalahoidon yhteydessä potilailla, joilla on korkean riskin ACS, voi olla hyvä kliininen väline kardiovaskulaarisen riskin stratifioinnissa. Tämän proteiinin määrittäminen täydentäisi muiden munuaistoiminnan arviointimenetelmien antamaa tietoa, ja diagnostisten vaikutusten lisäksi siitä voisi olla hyötyä suurimman riskin ryhmän tunnistamisessa. Saattaa olla tarpeen kiinnittää erityistä huomiota kliinisten ohjeiden suositusten noudattamiseen tässä väestössä. Lisäksi kystatiini C:llä voisi olla tärkeä merkitys stratifioitaessa potilaita, joilla on korkean riskin ACS ja munuaisten toiminta on säilynyt. Lisätutkimuksia, joissa seurantaa jatketaan pidempään, saatetaan tarvita, jotta kystatiini C:n merkitys ACS:ssä voidaan määritellä tarkemmin.
LYHENTEET
ACS: akuutti sepelvaltimo-oireyhtymä
MDRD: Modification of Diet in Renal Disease
TpI: troponiini I
