 Open Access-artikkeli
Open Access-artikkeli Tämän Open Access-artikkelin lisenssi on
Tämän Open Access-artikkelin lisenssi on
Creative Commons Attribution 3.0 Unported Licence
Guoqiang Liua, Yongsan Liab, Lei Yangd, Yen Weia, Xing Wangb, Zhiming Wangc ja Lei Tao *a
*a
aBioorgaanisen fosforikemian avainlaboratorio & Kemiallisen biologian laboratorio & Kemiallisen biologian laboratorio & (Opetusministeriö), Kemian laitos, Tsinghuan Yliopisto, Peking 100084, P. R. Kiina. E-mail: [email protected]
bThe State Key Laboratory of Chemical Resource Engineering, Beijing University of Chemical Technology, Beijing 100029, P. R. China
cCollege of Pharmaceutical Science, Zhejiang Chinese Medical University, Hangzhou, Zhejiang 311400, P. R. China. Kiina
dCancer Institute & Hospital, Peking Union Medical College & Chinese Academy of Medical Science, Beijing 100021, P. R. China
Ensimmäinen julkaisupäivä 27.3.2017
Polyetyleeniglykoli- (PEG-) johdannaisia (polyethylene glycol (PEG) derivatives) on käytetty laajalti bioteknologiaan liittyvässä tutkimuksessa. PEG-oligomeereillä (joilla on erilaiset molekyylipainot) tai PEG-pohjaisilla monomeereillä (joilla on erilaiset ketjun loppuryhmät) on kuitenkin itse asiassa erilaiset kemialliset ja fysikaaliset ominaisuudet, jotka saattavat johtaa mahdolliseen myrkyllisyyteen. Tässä työssä mitattiin useiden PEG-johdannaisten (oligomeerien ja monomeerien) sytotoksisuutta käyttäen mallisoluina ihmisen kohdunkaulan syöpäsoluja (HeLa) ja hiiristä peräisin olevaa fibroblastien solulinjaa (L929). Useimmat PEG-oligomeerit ovat turvallisia molemmille solutyypeille lukuun ottamatta trietyleeniglykolia (TEG), joka on myrkyllinen suurina pitoisuuksina L929-soluille. Toisaalta PEG-pohjaiset monomeerit, kuten poly(eteeniglykoli)metyylieetteriakrylaatti (mPEGA) ja poly(eteeniglykoli)metyylieetterimetakrylaatti (mPEGMA), osoittivat selvää sytotoksisuutta. Myöhemmin näitä myrkyllisiä PEG-johdannaisia on tutkittu niiden myrkyllisyyden eri mekanismien paljastamiseksi. Tässä nykyisessä tutkimuksessa arvioitiin PEG-johdannaisten sytotoksisuutta ja osoitettiin ”turvallisten” biomateriaalien potentiaalinen vaara, mikä saattaa tarjota hyödyllisen viitekehyksen ihmisille, jotka käyttävät PEG-johdannaisia tulevassa biolääketieteellisessä tutkimuksessa.
Esittely
Polyeteeniglykolia (PEG) on sovellettu laajalti useilla lääketieteen aloilla sen erinomaisten ominaisuuksien, kuten tyydyttävän turvallisuutensa, biokompatibiliteettinsa, hydrofiilisyytensä jne. takia. Esimerkiksi PEG:tä on käytetty joissakin elintarvike- ja lääkeviraston hyväksymissä laksatiiveissa sen erinomaisen kosteudenpidätyskyvyn ja voitelukyvyn vuoksi.1-3 Toisena esimerkkinä voidaan mainita, että lääkkeiden/proteiinien muokkaaminen PEG:llä (PEGylaatio) voi tehokkaasti parantaa lääkkeiden vesiliukoisuutta ja kiertoaikaista puoliintumisaikaa,4,5 mikä parantaa turvallisuutta ja terapian vaikutuksia. Itse asiassa PEGyloinnista on tulossa yksi houkuttelevimmista bioteknologioista, ja se on saavuttamassa valtavaa menestystä perustutkimuksessa ja markkinoilla.6-11 Tähän mennessä monia PEG-johdannaisia on käytetty erinomaisina lähtöaineina syntetisoitaessa useita uusia polymeerimateriaaleja biosovelluksia varten.12 Esimerkiksi lineaarinen PEG on modifioitu difunktionalisoiduksi PEG:ksi (DF-PEG), jota on voitu käyttää mielenkiintoisen itsekorjautuvan hydrogeelin nopeaan tuottamiseen.13,14,14. Joitakin PEG-oligomeerejä on käytetty epäorgaanisten nanohiukkasten pinnan muokkaamiseen vesiliukoisuuden parantamiseksi ja kyseisten epäorgaanisten materiaalien myrkyllisyyden vähentämiseksi15.-17 Joitakin kaupallisia PEG-pohjaisia monomeerejä, kuten poly(etyleeniglykoli)metyylieetteriakrylaattia (mPEGA) ja poly(etyleeniglykoli)metyylieetterimetakrylaattia (mPEGMA), on käytetty valmistamaan haarautuneita polymeerejä proteiinien myöhempää konjugointia, itsekokoonpanoa, lääkeaineiden annostelua jne. varten.18-27
Vaikka PEG:tä pidetään tavallisesti melkeinpä ei-myrkyllisenä, tutkijat ovat havainneet joitakin pienen molekyylipainon omaavien PEG:ien aiheuttamia vaarallisia ongelmia. Smyth et al. raportoivat PEG-oligomeerin (Mn ∼ 200) kroonisesta oraalisesta myrkyllisyydestä rotilla28,29 , ja haitallisia tuloksia on havaittu myös apinoilla30 , mikä viittaa näiden ”turvallisten” materiaalien mahdollisiin turvallisuusongelmiin. Kun otetaan huomioon PEG-johdannaisten laaja käyttö tutkimusaloilla, näiden PEG-oligomeerien ja PEG-pohjaisten monomeerien systemaattinen sytotoksisuustutkimus on näin ollen välttämätöntä ja tärkeää, jotta niitä voitaisiin jatkossa käyttää biotieteisiin liittyvillä aloilla (Kaavio 1).
Tässä työssä arvioitiin joidenkin PEG-oligomeerien (joilla on eri molekyylipainot) ja kaupallisten PEG-pohjaisten monomeerien (joilla on eri ketjujen loppuryhmät) sytotoksisuutta ihmisen kohdunkaulan syöpäsoluille (HeLa) ja hiiristä johdetulle fibroblastisolulinjalle (L929). PEG-oligomeerien molekyylipainosta riippuvainen sytotoksisuus havaittiin, ja PEG-oligomeerien ja PEG-pohjaisten monomeerien erilaiset sytotoksisuusmekanismit paljastuivat ensimmäistä kertaa. Nämä PEG-johdannaisten sytotoksisuustiedot saattavat olla arvokkaita viitteitä ihmisille, jotka valitsevat PEG:n lähtöaineiksi ja suunnittelevat puhdistusreittejä valmistamaan bioyhteensopivia PEG-pohjaisia materiaaleja biolääketieteellisiä sovelluksia varten.
Materiaalit ja menetelmät
2.1 Kemikaalit
Trietyleeniglykoli (TEG, 97 %, HEOWNS), PEG-400 (Mn ∼ 400, TCI), PEG-1000 (Mn ∼ 1000, Jiangsu Haitian Petrochemical Works), PEG-2000 (Mn ∼ 2000, SCRC), PEG-4000 (Mn ∼ 4000, SCRC), poly(eteeniglykoli)metyylieetteriakrylaatti 480 (mPEGA-480, Mn ∼ 480, Sigma-Aldrich), poly(eteeniglykoli)metyylieetterimetakrylaatti 500 (mPEGMA-500, Mn ∼ 500, Sigma-Aldrich) ja poly(eteeniglykoli)metyylieetterimetakrylaatti 950 (mPEGMA-950, Mn ∼ 950, Sigma-Aldrich) käytettiin suoraan ilman lisäpuhdistusta.
Ihmisen kohdunkaulan syöpäsolut (HeLa) ja hiiristä peräisin oleva fibroblastisolulinja (L929) hankittiin amerikkalaisesta tyyppiviljelykokoelmasta (ATCC). Dulbecco’s modified eagle medium (DMEM, Corning-Cellgro), fosfaattipuskuroitu keittosuolaliuos (Phosphate Buffered Saline, PBS, pH ∼ 7,2-7,4, 0,01 M, Solarbio), naudan sikiöseerumi (fetal bovine serum, FBS, Gibco), Roswell Park Memorial Institute 1640 -viljelysväliaine (Roswell Park Memorial Institute 1640 -viljelysväliaine (RPMI 1640 -viljelysväliaine, Gibco), penisilliinistreptomysiini-ratkaisu liuos (Gibco), trypsiini-EDTA-lisäaineetonta trypsiiniaineita sisältävä liuos (Gibco 0.25 %), 4-(3-(3-(2-metoksi-4-nitrofenyyli)-2-(4-nitrofenyyli)-2H-tetratsoli-3-ium-5-yyli)bentseeni-1,3-disulfonaatti (CCK-8, Beyotime), 2,7-diklooridihydrofluoresceiinidiasetaatti (DCFH-DA, Beyotime), hapettunut glutationi (GSSG, Beyotime), nikotiiniamidiadeniinidinukleotidifosfaattia (NADPH, Beyotime), 5,5′-ditiobis(2-nitrobentsoehappoa) (DTNB, Beyotime), fluoreseiinidiasetaattia (FDA, Sigma) ja propidiumjodidia (PI, 94 %, Sigma) käytettiin ostettuina.
2.2 Soluviljely
Soluviljelyä ylläpidettiin 37 °C:n inkubaattorissa, jossa oli 5 % hiilidioksidia, kasvatusalusta vaihdettiin yhden tai kahden päivän välein solujen eksponentiaalisen kasvun ylläpitämiseksi. HeLa-solut olivat peräisin kohdunkaulan syöpäsoluista, ja niitä kasvatettiin DMEM-mediassa, jota täydennettiin 10 %:lla naudan sikiöseerumilla (FBS) ja 1 %:lla penisilliinillä ja streptomysiinillä. L929-solut olivat peräisin hiiristä ja niitä kasvatettiin RPMI 1640 -mediassa, jota täydennettiin 10 %:lla naudan sikiöseerumilla (FBS) ja 1 %:lla penisilliinillä ja streptomysiinillä.
2.3 Sytotoksisuusanalyysi
Tulokset esitettiin keskiarvona ± keskihajonta (SD), ja PEG-johdannaisten puoliksi maksimaalisen inhiboivan pitoisuuden 50 % (IC50) arvot laskettiin SPSS 15.0:lla.
Aiempien töidemme32,33 mukaan fluoresiinidiasetaattia (FDA) ja propidiumjodidia (PI) voitiin käyttää nopeana ja kätevänä kaksoismustemenetelmänä solujen elinkykyisyyden havainnoimiseen. L929-solut kylvettiin 24-kuoppalevyyn tiheydellä ∼5 × 104 solua millilitrassa. Kiinnittymisen jälkeen solut pestiin PBS:llä ja niitä viljeltiin eri pitoisuuksilla PEG-johdannaisia kasvatusmediassa 24 tunnin ajan, minkä jälkeen medium poistettiin ja solut pestiin PBS:llä. Tämän jälkeen lisättiin PBS-FDA-PI-sekoitusliuosta (FDA: 3 μg ml-1; PI: 3 μg ml-1) ja 24-kuoppalevyä inkuboitiin 37 °C:ssa 15 minuutin ajan. Fluoresenssimikroskooppia (Leica Saksa) käytettiin elävien ja kuolleiden solujen havainnointiin 450-490 nm:n ja 515-560 nm:n kaistanpäästöisellä herätesuodattimella (I3 ja N2.1) (100 W:n elohopealamppu).
Lyhyesti sanottuna L929-solut kylvettiin 24-kuoppalevyyn ja inkuboitiin 0,5 ml:ssa kasvatusmediaa, jossa oli eri pitoisuuksia TEG:tä (A, A′), 1 tunnin ajan (kuva. 1), A1-A6-kuoppia käytettiin glutationin kokonaismäärän (GSH + GSSG) mittaamiseen, kun taas A′1-A′6-kuoppia käytettiin hapettuneen glutationin (GSSG) määrän mittaamiseen TEG:n läsnä ollessa. Solut kerättiin 1 tunnin kuluttua trypsiinin sulatuksella ja sentrifugoinnilla (1000 rpm, 5 min). Sitten lisättiin kolminkertainen tilavuus proteiinien poistoliuosta (50 mg ml-1) meluisten proteiinien poistamiseksi. Kolmen nopean jäädytys-sulatussyklin jälkeen nestemäisessä typessä ja 37 °C:n vesihauteessa suspensio laitettiin jääkaappiin (4 °C) 5 minuutiksi, ja näytteet solujen supernatantista saatiin sentrifugoinnin jälkeen (10 000 rpm, 10 min). Näytteitä A1-A6-kuopista käytettiin kokonaisglutationin (GSH + GSSG) tason mittaamiseen. NADPH-liuosta (0,5 mg ml-1) lisättiin pelkistämään kaikki glutationi GSH:ksi, sitten käytettiin 5,5′-ditiobis(2-nitrobentsoehappoa) (DTNB) GSH:n hapettamiseen, muuttunut absorbanssi 405 nm:ssä rekisteröitiin mikrolevylukijalla (VICTOR™ X3 PerkinElmer 2030 Multilabel Plate Reader).35,36 Näytteitä A′1-A′6-kuopista käytettiin hapettuneen glutationin (GSSG) tason mittaamiseen. GSH:n poistoliuosta käyttämällä näyteliuokseen jäi vain GSSG. Näytteet analysoitiin samalla menetelmällä kuin edellä GSSG:n tason mittaamiseksi. Kokonaisglutationin määrä ja hapettuneen glutationin määrä kerättiin pelkistyneen glutationin tason laskemiseksi, kun taas puhtaassa elatusaineessa olevien solujen GSH-tasoa käytettiin kontrollina. Tulokset esitettiin keskiarvona ± SD.
000 rpm, 10 min). Näytteitä A1-A6-kuopista käytettiin kokonaisglutationin (GSH + GSSG) tason mittaamiseen. NADPH-liuosta (0,5 mg ml-1) lisättiin pelkistämään kaikki glutationi GSH:ksi, sitten käytettiin 5,5′-ditiobis(2-nitrobentsoehappoa) (DTNB) GSH:n hapettamiseen, muuttunut absorbanssi 405 nm:ssä rekisteröitiin mikrolevylukijalla (VICTOR™ X3 PerkinElmer 2030 Multilabel Plate Reader).35,36 Näytteitä A′1-A′6-kuopista käytettiin hapettuneen glutationin (GSSG) tason mittaamiseen. GSH:n poistoliuosta käyttämällä näyteliuokseen jäi vain GSSG. Näytteet analysoitiin samalla menetelmällä kuin edellä GSSG:n tason mittaamiseksi. Kokonaisglutationin määrä ja hapettuneen glutationin määrä kerättiin pelkistyneen glutationin tason laskemiseksi, kun taas puhtaassa elatusaineessa olevien solujen GSH-tasoa käytettiin kontrollina. Tulokset esitettiin keskiarvona ± SD.
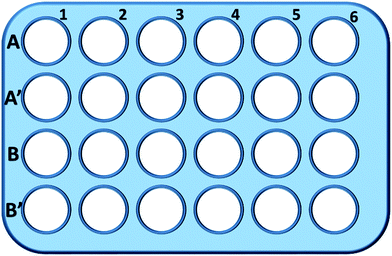
Rivin B ja B′ kuoppia käytettiin GSH:n ja GSSG:n kokonaismäärän testaamiseen mPEGA-480:n läsnä ollessa vastaavasti samalla menettelyllä.
Tulokset ja keskustelu
3.1 Solujen elinkelpoisuustutkimus
Kun käytettiin HeLa-solua (syöpäsolujen malli) (kuva 2A), kaikkien PEG-oligomeerien sytotoksisuus pienissä pitoisuuksissa (≤5 mg ml-1) voitiin jättää huomiotta. Kun pitoisuutta lisättiin (≥10 mg ml-1), havaittiin PEG-näytteiden molekyylipainosta riippuvainen sytotoksisuus. Trietyleeniglykoli (TEG) osoitti selvää sytotoksisuutta yli 10 mg mL-1 (p < 0,05; toisin kuin mikä tahansa muu oligomeeri, kun pitoisuus on yli 5 mg mL-1), ja TEG:n IC50-arvoksi HeLa-soluille laskettiin 19,8 mg mL-1. Samaan aikaan muut PEG-oligomeerit (Mn ∼ 400-4000) osoittivat myös pientä sytotoksisuutta.
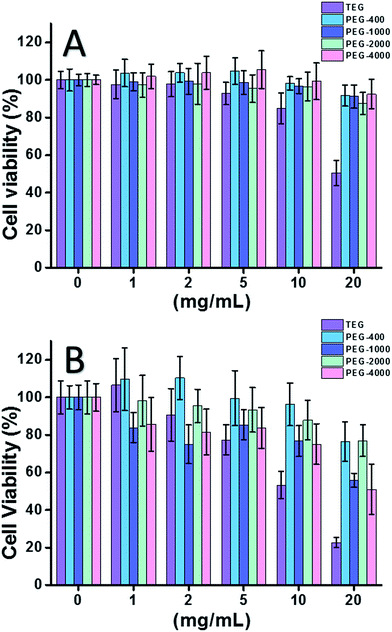
PEG-oligomeerien sytotoksisuutta L929-soluille (normaalien solujen malli) arvioitiin myös (kuva 2B). Solujen elinkelpoisuus väheni PEG-pitoisuuden kasvaessa odotetusti. TEG:n lisäksi jotkin PEG-oligomeerit (PEG-1000, PEG-4000), jotka ovat turvallisia HeLa-soluille, osoittivat myös havaittavaa sytotoksisuutta; TEG:n, PEG-1000:n ja PEG-4000:n IC50-arvot laskettiin 12,4, 22,5 ja 20,0 mg ml-1 L929-soluille, mikä osoittaa myös PEG-oligomeerien molekyylipainosta riippuvan sytotoksisuuden.
Edellä mainitut tulokset viittasivat siihen, että HeLa-solut sietävät paremmin PEG-oligomeerejä kuin L929-solut johtuen syöpäsolujen sitkeästä elinvoimaisuudesta, ja TEG:llä on paljon korkeampi sytotoksisuus kuin muilla PEG-oligomeereillä, joilla on korkeammat molekyylipainot (p < 0,05; vastakohtana mille tahansa muulle oligomeerille, kun konsentraatio on suurempi kuin 5 mg millilitraa-1). Huomataan, että nykyinen tutkimus osoitti PEG-1000:n ja PEG-4000:n kohtalaisen sytotoksisuuden L929-soluille ja PEG-400:n ja PEG-2000:n lähes olemattoman sytotoksisuuden, mikä poikkeaa yleisestä käsityksestä, jonka mukaan suuren molekyylipainon PEG:ien pitäisi olla bioyhteensopivampia kuin pienen molekyylipainon PEG:ien vastineet. Vaikka PEG:n sytotoksisuuden syy ei ole vieläkään selvillä, PEG-400 ja PEG-2000 näyttävät olevan parempia valintoja ihmisille, jotka haluavat syntetisoida bioyhteensopivia materiaaleja.
Kun testattiin mPEGMA-500:a, sekä HeLa-solujen että L929-solujen solujen elinkelpoisuus väheni mPEGMA-500:n pitoisuuden kasvaessa (kuva 3A), eikä kahden solutyypin välillä havaittu ilmeistä eroa. mPEGMA-500:n IC50-arvot ovat 4,7 mg mL-1 HeLa-soluille ja 5,3 mg mL-1 L929-soluille 24 tunnin viljelyn jälkeen, mikä osoittaa mPEGMA-500:n merkittävämpää sytotoksisuutta kuin edellä mainitut PEG-oligomeerit ja viittaa siihen, että PEG-johdannaisten ketjun loppuryhmät ovat ratkaisevia niiden myrkyllisyyden kannalta. Kun mPEGMA-950, toinen PEG-pohjainen metakrylaatti, jolla on sama ketjun loppuryhmä mutta suurempi molekyylipaino, testattiin samalla menetelmällä (kuva 3B), havaittiin, että mPEGMA-950:n sytotoksisuus HeLa-soluille tai L929-soluille oli paljon vähäisempää (p < 0,05; kun konsentraatio on yli 2 mg mL-1), mPEGMA-950:n IC50-arvot ovat HeLa-soluille 20,8 mg mL-1 ja 21.7 mg ml-1 L929-soluille 24 tunnin viljelyn jälkeen, mikä osoittaa myös PEG-pohjaisen metakrylaatin molekyylipainosta riippuvan sytotoksisuuden.
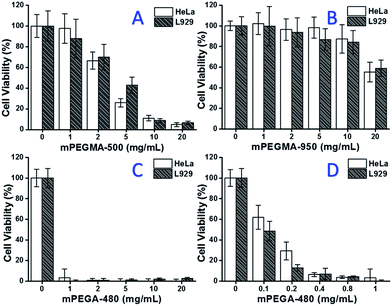
Lisäksi testattiin PEG-pohjaista akrylaattia mPEGA-480. Vaikka mPEGA-480:n ja mPEGMA-500:n ero on vain metyyliryhmä ketjun päässä, mPEGA-480 osoitti akuuttia sytotoksisuutta (kuva 3C). Yli 95 prosenttia soluista menetti elinkykyisyytensä, vaikka elatusaineessa oli 1 mg mPEGA-480:aa. Näin ollen on tehtävä lisäkokeita pienemmillä pitoisuuksilla sen sytotoksisuuden määrittämiseksi (kuva 3D), ja mPEGA-480:n IC50-arvoiksi laskettiin 0,2 mg mL-1 HeLa-soluille ja 0,1 mg mL-1 L929-soluille 24 tunnin viljelyn jälkeen.
Solujen elinkelpoisuuskokeet vahvistivat, että sekä ketjun loppuryhmät että molekyylipaino ovat tärkeitä PEG-johdannaisten sytotoksisuuteen vaikuttavia tekijöitä, ja PEG-pohjaiset monomeerit osoittivat paljon huomattavampaa sytotoksisuutta verrattuna PEG-oligomeereihin.
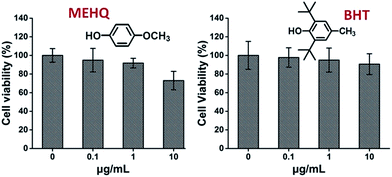
Välillä arvioitiin myös PEG-pohjaisten monomeerien inhibiittoreiden, hydrokinonimetyylieetterin (MEHQ, 100 ppm mPEGA:ssa) ja butyloidun hydroksitolueenin (BHT, 300 ppm mPEGMA:ssa), sytotoksisuutta (kuva 4), ja L929-solut säilyttivät korkean elinkelpoisuuden (≥90 %) matalilla inhibiittorikonsentraatioilla (≤1 μg ml-1). MEHQ:ta on 0,1 μg mL-1 1 mg mL-1 mPEGA-480:ssa ja BHT:tä 3 μg mL-1 10 mg mL-1 mPEGA-500:ssa, kun taas mPEG-480 ja mPEGMA-500 osoittivat selvää sytotoksisuutta näillä pitoisuuksilla. Näin ollen PEG-pohjaisissa monomeereissä olevilla inhibiittoreiden hivenmäärillä näytti olevan vähäinen vaikutus monomeerien sytotoksisuuteen.
3.2 Solumorfologian havainnointi
Optisen mikroskoopin havainnointia käytettiin arvioimaan suoraan PEG-johdannaisten sytotoksisuutta L929-soluille. Optiset kuvat L929-soluista, jotka altistettiin 20 mg mL-1 TEG:lle ja 0,1 mg mL-1 mPEGA:lle 24 tunnin ajan, on esitetty kuvissa 5A ja B.
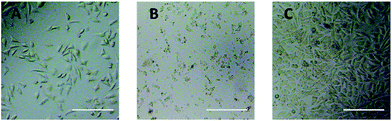
Kuva 5 Optisen mikroskoopin kuvat L929-soluista, joita inkuboitiin 20 mg mL-1 TEG:llä (A) ja 0,1 mg mL-1 mPEGA-480:lla (B) 24 h, sekä soluista puhtaassa elatusaineessa (C, kontrolliryhmä). Mittakaavapalkki = 200 μm.

Kun soluja oli inkuboitu 20 mg mL-1 TEG:llä 24 h, solut säilyttivät samanlaisen morfologian (kuva 5A) kuin kontrolliryhmässä (kuva 5C, solut puhtaassa kasvatusmediassa), mutta solujen määrä väheni dramaattisesti, mikä osoittaa TEG:n sytotoksisuutta suurina pitoisuuksina, mikä johti solujen kuolemaan ja sitä seuranneeseen solujen irtoamiseen mikrolevyn pohjasta. Kuvassa 5B on esitetty L929-solujen morfologia inkuboinnin jälkeen 0,1 mg mL-1 mPEGA-480:n kanssa. Lähes kaikki solut menettivät normaalin morfologian, mikä viittaa mPEGA-480:n akuuttiin sytotoksisuuteen jopa näin pienessä pitoisuudessa.
Lisäksi solut värjättiin myös fluoresceiinilla. FDA/PI-kaksoisvärjäys on nopea, yksinkertainen ja samanaikainen menettely elävien ja kuolleiden solujen havainnoimiseksi.43 FDA voi tunkeutua täydellisiin soluihin ja kerääntyä soluihin, joten täydellinen solukalvo on välttämätön fluoresceiinin solusta vuotamisen estämiseksi. Sitä vastoin PI ei voi läpäistä ehjää solukalvoa, mutta se voi värjätä kuolleiden solujen tuman kulkemalla vaurioituneen solukalvon läpi. Kuten kuvasta 6 kävi ilmi, 20 mg ml-1 TEG:llä inkuboiduissa L929-soluissa on vähemmän elinkelpoisia soluja FDA-värjäyksen jälkeen (kuva 6b) verrattuna kontrolliin (kuva 6a), ja PI-värjäyksen jälkeen voidaan havaita enemmän kuolleita soluja (kuva 6b). mPEGA-480:n akuutti sytotoksisuus havaittiin myös FDA/PI-kaksoisvärjäyksen jälkeen, eikä vihreää signaalia voitu havaita sen jälkeen, kun soluja oli inkuboitu 0,1 mg mL-1 mPEG-480:lla 24 tunnin ajan (kuvat 6c ja c′′).
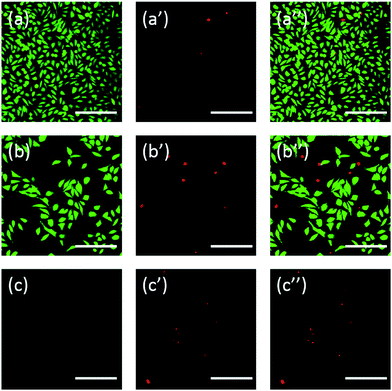
Sekä optiset että fluoresenssikuvat osoittivat intuitiivisesti näiden PEG-johdannaisten sytotoksisuuden, mikä tukee entisestään CCK-8-määrityksillä saatua päätelmää. Huomataan, että mPEGA-480 näytti myrkyllisemmältä FDA/PI-kaksoisvärjäysmäärityksessä, mikä johtuu siitä, että FDA/PI-kaksoisvärjäys erottaa elävän/kuolleen solukalvon täydellisyyden, kun taas CCK-8-määritys havaitsee dehydrogenaasin aktiivisuuden mitokondrioissa, mikä viittaa siihen, että FDA/PI-värjäys on erinomainen lisäys CCK-8-määritykseen, joka tarjoaa yksityiskohtaisempia tietoja solun tilasta.
3.3 Mekanismitutkimus
Solujen elinkelpoisuuskokeiden mukaan laskettiin ja tiivistettiin PEG-oligomeerien ja PEG-pohjaisten monomeerien IC50-arvot HeLa- ja L929-soluille 24 tunnin viljelyn jälkeen (taulukko 1), mikä viittaa siihen, että PEG-pohjaiset monomeerit ovat paljon myrkyllisempiä soluille kuin PEG-oligomeerit, ja mPEGA:lla on korkein sytotoksisuus. Tämän vuoksi analysoitiin ROS:n muodostumista ja GSH:n vähenemistä soluissa, jotka ovat kaksi tärkeintä sytotoksisuuden mekanismia, sytotoksisuuden mahdollisen syyn selvittämiseksi.
| TEG | PEG-400 | PEG-1000 | PEG-2000 | PEG-4000 | mPEGMA-500 | mPEGMA-950 | mPEGA-480 | |
|---|---|---|---|---|---|---|---|---|
| HeLa-solut | 19.7 | 22.5 | 28.7 | 20.0 | 5.3 | 21.7 | 0.1 |
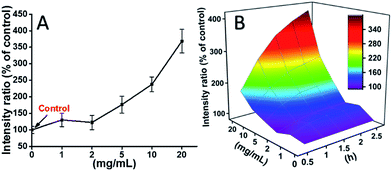
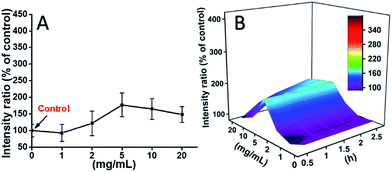
L929-soluja inkuboitiin TEG:n kanssa, ja ROS-tasot eri aikapisteissä (0, 0,5, 1,0, 1,5, 2 h) havaittiin aiempien raporttiemme mukaisesti, ja ne on esitetty kuvassa 7. Esimerkkinä kuvassa 7A on esitetty ROS-tasot sen jälkeen, kun soluja oli inkuboitu eri pitoisuuksilla TEG:llä 2 tunnin ajan. On selvästi nähtävissä, että ROS-tasot pysyivät vakaina alhaisella TEG-konsentraatiolla (≤2 mg ml-1), mutta kasvoivat merkittävästi, kun TEG-konsentraatio on suurempi kuin 2 mg ml-1, mikä on yhdenmukaista kuvassa 2B esitetyn solujen elinkelpoisuuskokeen tuloksen kanssa. Vastaavasti ROS-tasoa ja TEG-konsentraatiota eri aikapisteissä kuvaavat luvut piirrettiin ja yhdistettiin 3D-kartan saamiseksi (kuva 7B). ROS-tasot olivat suurimmillaan 2 tunnin kohdalla 20 mg ml-1 TEG:llä, jolloin havaittiin noin 400 % suurempi ROS-taso kuin kontrollissa (ROS-taso = 100), mikä johti kirkkaimpaan fluoresenssin voimakkuuteen. Nämä tulokset viittaavat siihen, että ROS:n muodostuminen on TEG:n sytotoksisuuden mahdollinen mekanismi, ja TEG:n indusoima korkea ROS-taso saattaa olla tärkein syy solujen apoptoosiin.
Testattiin myös mPEGA-480:n indusoimia ROS-tasoja 2 h:n kuluttua (Kuva 8A). Toisin kuin TEG, mPEGA ei aiheuttanut nopeaa ROS:n lisääntymistä soluissa, vain ∼170 % ROS-lisäys kontrolliin verrattuna havaittiin maksimina. 3D ROS-taso vs. mPEGA & aika (kuva 8B) osoitti mPEGA-480:n indusoiman ROS-tason aaltona ja harjanne ilmestyi mPEGA:n kohtalaisella pitoisuudella (5 mg mL-1), merkittävää ROS:n muodostumista ei voida havaita, mikä viittaa siihen, että ROS:n muodostuminen saattaa vain osittain vaikuttaa mPEGA-480:n sytotoksisuuteen.
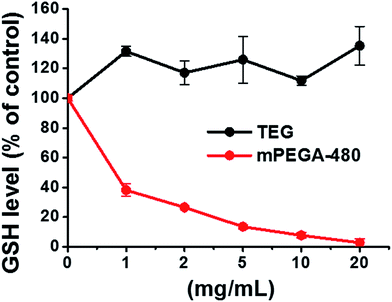
GSH:n pelkistävä tioliryhmä on tärkeä hapettumista estävä lähde eliöissä. MPEGA-480:n sytotoksisuuden mahdollinen mekanismi johtuu tioliryhmän ja vinyylisidoksen välisestä Michaelin additioreaktiosta, joka johtaa solunsisäisen redox-tasapainon rikkoutumiseen ja solujen apoptoosiin. Aiemmissa tutkimuksissa on esitetty, että tiolin ja akrylaatin välinen Michaelin additio on paljon nopeampi kuin tiolin ja metakrylaatin välinen,52 mikä saattaa olla kohtuullinen syy mPEGA-480:n ja mPEGMA-500:n erilaiseen akuuttiin sytotoksisuuteen.
Johtopäätökset
Ensimmäistä kertaa arvioitiin PEG-oligomeerien ja PEG-pohjaisten monomeerien sytotoksisuutta HeLa-soluille ja L929-soluille. PEG-oligomeerien ja PEG-pohjaisten monomeerien pitoisuusriippuvainen sytotoksisuus on vahvistettu ja esitetty IC50-arvoina HeLa- ja L929-soluille. PEG-400 ja PEG-2000 vaikuttavat nykyisessä tutkimuksessa lähes ei-sytotoksisilta. PEG-1000, PEG-4000 ja mPEGMA-950 osoittivat kohtalaista sytotoksisuutta erityisesti suurina pitoisuuksina. TEG ja mPEGMA-500 osoittivat merkittävää sytotoksisuutta, ja mPEGA-480 osoitti akuuttia sytotoksisuutta. Lisäksi solutyypit vaikuttavat myös sytotoksisuustutkimuksen tuloksiin, HeLa-solut sietävät PEG-johdannaisia paremmin kuin L929-solut. Nämä tulokset PEG-johdannaisten sytotoksisuudesta ovat alustavia mutta perustavanlaatuisia niiden tulevan biolääketieteellisen soveltamisen kannalta, ja lisätietoa solujen vasteesta ja käyttäytymisestä muille PEG-johdannaisille tutkitaan edelleen.
Kiitokset
Tätä tutkimusta on tukenut Kiinan kansallinen tiedesäätiö (21574073, 21534006).
- M. V. Cleveland, D. P. Flavin, R. A. Ruben, R. M. Epstein ja G. E. Clark, South. Med. J., 2001, 94, 478-481 CrossRef CAS PubMed.
- J. A. DiPalma, M. V. B. Cleveland, J. McGowan ja J. L. Herrera, Am. J. Gastroenterol., 2007, 102, 1436-1441 CrossRef CAS PubMed.
- B. A. Erickson, J. C. Austin, C. S. Cooper ja M. A. Boyt, J. Urol., 2003, 170, 1518-1520 CrossRef CAS PubMed.
- J. L. Cleland, S. E. Builder, J. R. Swartz, M. Winkler, J. Y. Chang ja D. I. C. Wang, Bio/Technology, 1992, 10, 1013-1019 CrossRef CAS PubMed.
- Z. Liu, J. T. Robinson, X. M. Sun ja H. J. Dai, J. Am. Chem. Soc., 2008, 130, 10876-10877 CrossRef CAS PubMed.
- J. M. Harris ja R. B. Chess, Nat. Rev. Drug Discovery, 2003, 2, 214-221 CrossRef CAS PubMed.
- F. M. Veronese ja G. Pasut, Drug Discovery Today, 2005, 10, 1451-1458 CrossRef CAS PubMed.
- M. J. Roberts, M. D. Bentley ja J. M. Harris, Adv. Drug Delivery Rev., 2002, 54, 459-476 CrossRef CAS PubMed.
- F. M. Veronese, Biomaterials, 2001, 22, 405-417 CrossRef CAS PubMed.
- H. Zhang, T. Zhao, P. Duffy, Y. Dong, A. Ni Annaidh, E. O’Cearbhaill ja W. Wang, Adv. Healthcare Mater., 2015, 4, 2260-2268 CrossRef CAS PubMed.
- Y. Dong, Y. Qin, M. Dubaa, J. Killion, Y. Gao, T. Zhao, D. Zhou, D. Duscher, L. Geever, G. C. Gurtner ja W. Wang, Polym. Chem., 2015, 6, 6182-6192 RSC.
- T. M. Allen, C. Hansen, F. Martin, C. Redemann ja A. Yauyoung, Biochim. Biophys. Acta, Biomembr., 1991, 1066, 29-36 CrossRef CAS.
- Y. L. Zhang, L. Tao, S. X. Li ja Y. Wei, Biomacromolecules, 2011, 12, 2894-2901 CrossRef CAS PubMed.
- Y. L. Zhang, B. Yang, L. X. Xu, X. Y. Zhang, L. Tao ja Y. Wei, Acta Chim. Sin., 2013, 71, 485-492 CrossRef CAS.
- C. C. Luo, Y. H. Zhang, X. W. Zeng, Y. W. Zeng ja Y. G. Wang, J. Colloid Interface Sci., 2005, 288, 444-448 CrossRef CAS PubMed.
- S. Dhar, F. X. Gu, R. Langer, O. C. Farokhzad ja S. J. Lippard, Proc. Natl. Acad. Sci. U. S. A., 2008, 105, 17356-17361 CrossRef CAS PubMed.
- J. Manson, D. Kumar, B. J. Meenan ja D. Dixon, Gold Bull., 2011, 44, 99-105 CrossRef CAS.
- X. Y. Zhang, C. K. Fu, L. Feng, Y. Ji, L. Tao, Q. Huang, S. X. Li ja Y. Wei, Polymer, 2012, 53, 3178-3184 CrossRef CAS.
- X. Y. Zhang, J. F. Hui, B. Yang, Y. Yang, D. D. Fan, M. Y. Liu, L. Tao ja Y. Wei, Polym. Chem., 2013, 4, 4120-4125 RSC.
- D. Bontempo ja H. D. Maynard, J. Am. Chem. Soc., 2005, 127, 6508-6509 CrossRef CAS PubMed.
- K. L. Heredia, Z. P. Tolstyka ja H. D. Maynard, Macromolecules, 2007, 40, 4772-4779 CrossRef CAS.
- H. Hussain, K. Y. Mya ja C. He, Langmuir, 2008, 24, 13279-13286 CrossRef CAS PubMed.
- J. P. Magnusson, S. Bersani, S. Salmaso, C. Alexander ja P. Caliceti, Bioconjugate Chem., 2010, 21, 671-678 CrossRef CAS PubMed.
- F. J. Xu, Y. L. Li, E. T. Kang ja K. G. Neoh, Biomacromolecules, 2005, 6, 1759-1768 CrossRef CAS PubMed.
- L. L. Yu, L. Yao ja K. Yang, J. Porous Mater., 2016, 23, 1581-1589 CrossRef CAS.
- S. Yuan, D. Wan, B. Liang, S. O. Pehkonen, Y. P. Ting, K. G. Neoh ja E. T. Kang, Langmuir, 2011, 27, 2761-2774 CrossRef CAS PubMed.
- S. A, Q. Xu, D. Zhou, Y. Gao, J. M. Vasquez, U. Greiser, W. Wang, W. Liu ja W. Wang, Polym. Chem., 2017, 8, 1283-1287 RSC.
- H. F. Smyth, C. P. Carpenter ja C. S. Weil, J. Am. Pharm. Assoc., 1950, 39, 349-354 CrossRef CAS.
- H. F. Smyth, C. P. Carpenter ja C. S. Weil, J. Am. Pharm. Assoc., 1955, 44, 27-30 CrossRef CAS.
- D. E. Prentice ja S. K. Majeed, Toxicol. Lett., 1978, 2, 119-122 CrossRef CAS.
- H. Tominaga, M. Ishiyama, F. Ohseto, K. Sasamoto, T. Hamamoto, K. Suzuki ja M. Watanabe, Anal. Commun., 1999, 36, 47-50 RSC.
- Y. Li, Y. Zhang, F. Shi, L. Tao, Y. Wei ja X. Wang, Colloids Surf., B, 2016, 149, 168-173 CrossRef PubMed.
- B. Yang, Y. Zhang, X. Zhang, L. Tao, S. Li ja Y. Wei, Polym. Chem., 2012, 3, 3235-3238 RSC.
- H. Wang ja J. A. Joseph, Free Radical Biol. Med., 1999, 27, 612-616 CrossRef CAS PubMed.
- I. K. Smith, T. L. Vieweller ja C. A. Thorne, Anal. Biochem., 1988, 175, 408-413 CrossRef CAS PubMed.
- I. Rahman, A. Kode ja S. K. Biswas, Nat. Protoc., 2006, 1, 3159-3165 CrossRef CAS PubMed.
- R. Jevprasesphant, J. Penny, R. Jalal, D. Attwood, N. B. McKeown ja A. D’Emanuele, Int. J. Pharm., 2003, 252, 263-266 CrossRef CAS PubMed.
- A. K. Gupta ja S. Wells, IEEE Trans. Nanobioscience, 2004, 3, 66-73 CrossRef PubMed.
- D. Luo, K. Haverstick, N. Belcheva, E. Han ja W. M. Saltzman, Macromolecules, 2002, 35, 3456-3462 CrossRef CAS.
- C. W. Chang, E. Bays, L. Tao, S. N. S. Alconcel ja H. D. Maynard, Chem. Commun., 2009, 3580-3582 RSC.
- B. D. Fairbanks, P. A. Gunatillake ja L. Meagher, Adv. Drug Delivery Rev., 2015, 91, 141-152 CrossRef CAS PubMed.
- T. Zhou, Y. Zhu, X. Li, X. Liu, K. W. K. Yeung, S. Wu, X. Wang, Z. Cui, X. Yang ja P. K. Chu, Prog. Mater. Sci., 2016, 83, 191-235 CrossRef CAS.
- K. H. Jones ja J. A. Senft, J. Histochem. Cytochem., 1985, 33, 77-79 CrossRef CAS PubMed.
- M. Hayyan, M. A. Hashim ja I. M. AlNashef, Chem. Rev., 2016, 116, 3029-3085 CrossRef CAS PubMed.
- A. Lankoff, W. J. Sandberg, A. Wegierek-Ciuk, H. Lisowska, M. Refsnes, B. Sartowska, P. E. Schwarze, S. Meczynska-Wielgosz, M. Wojewodzka ja M. Kruszewski, Toxicol. Lett., 2012, 208, 197-213 CrossRef CAS PubMed.
- Y. Chang, S.-T. Yang, J.-H. Liu, E. Dong, Y. Wang, A. Cao, Y. Liu ja H. Wang, Toxicol. Lett., 2011, 200, 201-210 CrossRef CAS PubMed.
- X. Cai, J. Hao, X. Zhang, B. Yu, J. Ren, C. Luo, Q. Li, Q. Huang, X. Shi, W. Li ja J. Liu, Toxicol. Appl. Pharmacol., 2010, 243, 27-34 CrossRef CAS PubMed.
- S. J. Park, Y. C. Park, S. W. Lee, M. S. Jeong, K.-N. Yu, H. Jung, J.-K. Lee, J. S. Kim ja M.-H. Cho, Toxicol. Lett., 2011, 207, 197-203 CrossRef CAS PubMed.
- K. Pulskamp, S. Diabate ja H. F. Krug, Toxicol. Lett., 2007, 168, 58-74 CrossRef CAS PubMed.
- A. M. Studer, L. K. Limbach, L. Van Duc, F. Krumeich, E. K. Athanassiou, L. C. Gerber, H. Moch ja W. J. Stark, Toxicol. Lett., 2010, 197, 169-174 CrossRef CAS PubMed.
- T. Thurnherr, C. Brandenberger, K. Fischer, L. Diener, P. Manser, X. Maeder-Althaus, J.-P. Kaiser, H. F. Krug, B. Rothen-Rutishauser ja P. Wick, Toxicol. Lett., 2011, 200, 176-186 CrossRef CAS PubMed.
- G. Li, R. K. Randev, A. H. Soeriyadi, G. Rees, C. Boyer, Z. Tong, T. P. Davis, C. R. Becer ja D. M. Haddleton, Polym. Chem., 2010, 1, 1196-1204 RSC.
.
