Hyönteisten kerääminen on mielenkiintoinen harrastus monille, mutta siitä on myös paljon hyötyä tieteellisessä tutkimuksessa. Tässä postauksessa kerrotaan, miten hyönteisiä kerätään ja säilytetään, ja näytetään, miten ne tulisi kiinnittää.
Hyönteisten keräilyä voi harrastaa milloin tahansa, vaikka niitä esiintyykin pääasiassa keväällä aina myöhäissyksyyn asti. Kesä on luultavasti parasta aikaa, sillä silloin hyönteisiä on eniten. Lämpiminä, aurinkoisina päivinä on todennäköisesti eniten hyönteisiä, mutta olisi kuitenkin viisasta tarkistaa eri aikoina ja sääolosuhteissa, koska eri hyönteiset ilmestyvät eri aikoina. Yöllä katuvalot ja kuistin valot ovat hyvä paikka etsiä. Lehtikarikkeissa ja kasveissa on todennäköisesti hyönteisiä, ja monet yöaktiiviset hyönteiset pysyttelevät myös poissa valoista.
Keräysvälineet:
- Hyönteisverkko – Näitä voi ostaa tai tehdä itse. Ne tulisi tehdä verkosta, joka on ommeltu musliini- tai kangaskankaaseen, joka kietoutuu langan ympärille. Siitä hyönteinen voidaan siirtää purkkiin joko laittamalla purkki verkkoon tai pitämällä hyönteistä kiinni rintakehästä.
-

Minun tappopurkkini. PC: Colton Weaver Tappopurkki – Tappopurkkeja on hyvä olla 2-3 eri muotoista ja kokoista. Ihannetapauksessa ne ovat korkillisia, mutta tämä voi riippua. Niissä tulisi olla näkyvästi merkintä ”Myrkky”. Purkkiin lisätään kipsiä tai puuvillaa, joka pitää tappavan aineen sisällään. Borror, Delong ja Triplehorn suosittelevat syanidia, mutta myös etyyliasetaattia voidaan käyttää, ja se on huomattavasti turvallisempaa. Myös hiilitetrakloridia tai kloroformia voidaan käyttää.
- Paperilaatikot, joissa on pehmopaperia
- Kirjekuoret tai paperia niiden valmistamiseen – Hyödyllinen väliaikaiseen säilytykseen. Nämä voidaan helposti rakentaa kentällä ja ne pitävät näytteet suhteellisen turvassa.
- Säilytysnesteellä täytetyt injektiopullot
- Pihdit
- Käsilinssi
- Aspiraattori – Näillä pyydystetään pieniä hyönteisiä injektiopulloihin hengityksen avulla. Tyypillisesti niissä on siivilä, joka estää sinua hengittämästä hyönteistä sisään.
- Hakkaava sateenvarjo tai lakana – Lakana tai sateenvarjo asetetaan kasvin alle, jota sitten lyödään tai ravistellaan niin, että pienet hyönteiset putoavat lakanalle.
- Siivilöitsijä – Lehtipölyä voidaan siivilöidä hitaasti valkoiselle kankaalle tai pahville, minkä jälkeen löydetyt hyönteiset voidaan imuroida.
- Ansat – Ansatyyppejä on monia. Berlese-suppilossa on suppilo, jossa on seula ja sen päällä lamppu, jonka pohjalla on alkoholia. Hyönteiset houkutellaan ja putoavat sitten tappopurkkiin. Valoansat voivat olla tehokkaita joihinkin hyönteisiin, ja ne voivat olla niinkin yksinkertaisia kuin tappoainesäiliön yläpuolella oleva valaisin tai kävelevä ansa, johon hyönteiset asettuvat ja joka voidaan kerätä käsin. Kuoppapyydyksiä voidaan käyttää raatokuoriaisiin tai muihin ei-lentäviin hyönteisiin, ja ne ovat yksinkertaisia tölkkejä, joiden pohjalla on syötti. Hyönteiset putoavat sisään eivätkä pääse pakenemaan. Yksinkertainen ansa voi olla pelkkä sokeriliuos, joka levitetään pinnalle.
- Kärkilamppu
- Tuppiveitsi
Saaliin käsittely: Monet pehmeärunkoiset hyönteiset voidaan laittaa suoraan 70-90-prosenttiseen isopropyyli- tai etyylialkoholiin. Tämä koskee monien lajien toukkia ja nymfejä sekä joitakin pienempiä hyönteisiä. Kovarunkoiset hyönteiset on laitettava tappopurkkiin. Kesto riippuu hyönteisestä ja tappoaineesta, ja se voi vaihdella muutamasta minuutista muutamaan tuntiin. Kun hyönteinen on kuollut, se on poistettava mahdollisimman pian, jotta vältetään lisävärjäytyminen. Niitä voidaan säilyttää pillerirasioissa tai edellä kuvatuissa paperikuorissa.
Relaksaatio: Jos näytettä ei voi nipistää ja levittää välittömästi, se todennäköisesti kuivuu. Tässä tilassa se on melko hauras ja murtuu, jos sitä yritetään järjestellä. Tämän korjaamiseksi voit joko käyttää relaksoivaa kammiota, relaksoivaa nestettä tai keittää hyönteisen vedessä (tämä voi kuitenkin vahingoittaa sitä).
Relaksoivat kammiot ovat astioita, joiden sisällä on märkää hiekkaa tai kangasta. Ihannetapauksessa tulisi lisätä karbolihappoa homeen muodostumisen estämiseksi. Päivän tai kahden kuluttua näytettä pitäisi pystyä taas käsittelemään.
Relaksointinestettä voidaan valmistaa erilaisista seoksista, ja yleensä hyönteinen jätetään siihen useiksi minuuteiksi. Yksi seos, joka tunnetaan usein nimellä Barberin neste, on lueteltu alla:
| 95-prosenttinen etyylialkoholi | 50 cm3 |
| Vesi | 50cm3 |
| Etyylialkoholi. asetaatti | 20cm3 |
| Bentseeni | 7cm3 |
Toinen menetelmä, jota voidaan käyttää, on vesijohtoveden injektointi. Tämä toimii moniin perhosiin. Ruiskuta 20-25 millimetrin neulaa käyttäen vettä rintakehään siiven alle, kunnes se on täysin täynnä. 5-20 minuutin kuluttua hyönteisen pitäisi olla rentoutunut.
Säilytys nesteessä: Tätä voidaan käyttää moniin pehmeärunkoisiin hyönteisiin (kuten mayflies, stoneflies, caddisflies jne.), joita ei voi kiinnittää, ellei niitä kuivateta edellä mainitulla tavalla. Se on hyödyllinen myös hyvin pienille näytteille, joita tutkitaan mikroskooppilevyillä, sekä hyönteisten toukille ja nymfeille. Myös muut kuin hyönteisniveljalkaiset tulisi säilyttää tällä tavoin.
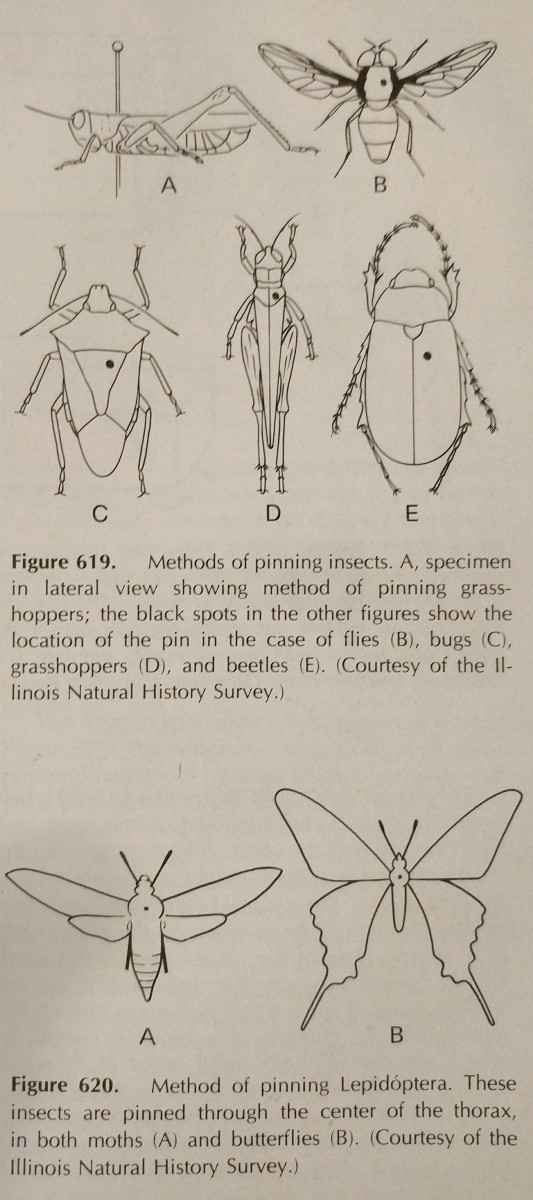
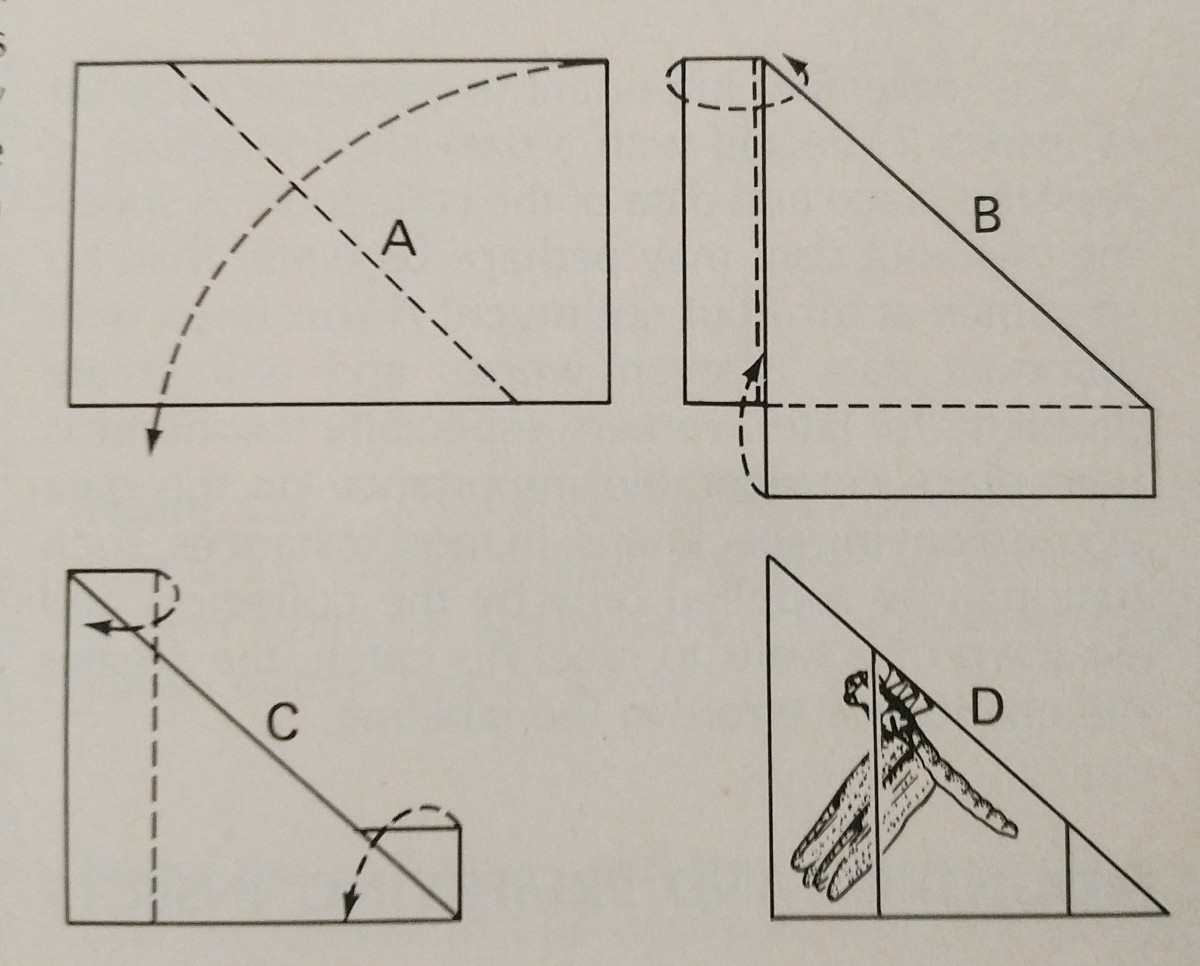
Pinnoitus: Tämä on helpoin tapa säilyttää kovarunkoinen hyönteinen. Värit haalistuvat usein hyönteisen kuivuessa, mutta tätä on vaikea välttää. Kannattaa käyttää erikoishyönteisneuloja, jotka ovat pidempiä eivätkä ruostu. Niitä on saatavana kokoja 00-7, mutta pienempiä voi olla vähemmän käyttökelpoisia. Eri tilaukset tulisi kiinnittää eri alueille, mikä on kuvassa. Jalkoja olisi pidennettävä, samoin kuin siipiä. Usein mehiläisten kieli on ojennettuna tunnistamisen helpottamiseksi.
On parasta, jos kaikki kokoelman lajit on kiinnitetty samalle etäisyydelle. Noin 25 mm pisteen yläpuolella on ihanteellista, ja yhtenäiset etäisyydet voidaan helposti saavuttaa käyttämällä kiinnityspalikkaa, joka on yksinkertaisesti puupalikka, johon on porattu reikiä eri syvyyksille.
Hyönteisten tunnistaminen on pitkälti harjoittelua. Levityslaudan käyttö helpottaa tehtävää huomattavasti,
ja ylimääräisten nuppineulojen ja paperiliuskojen hankkiminen on välttämätöntä. Nastoja voidaan käyttää raajojen ja siipien liikutteluun.
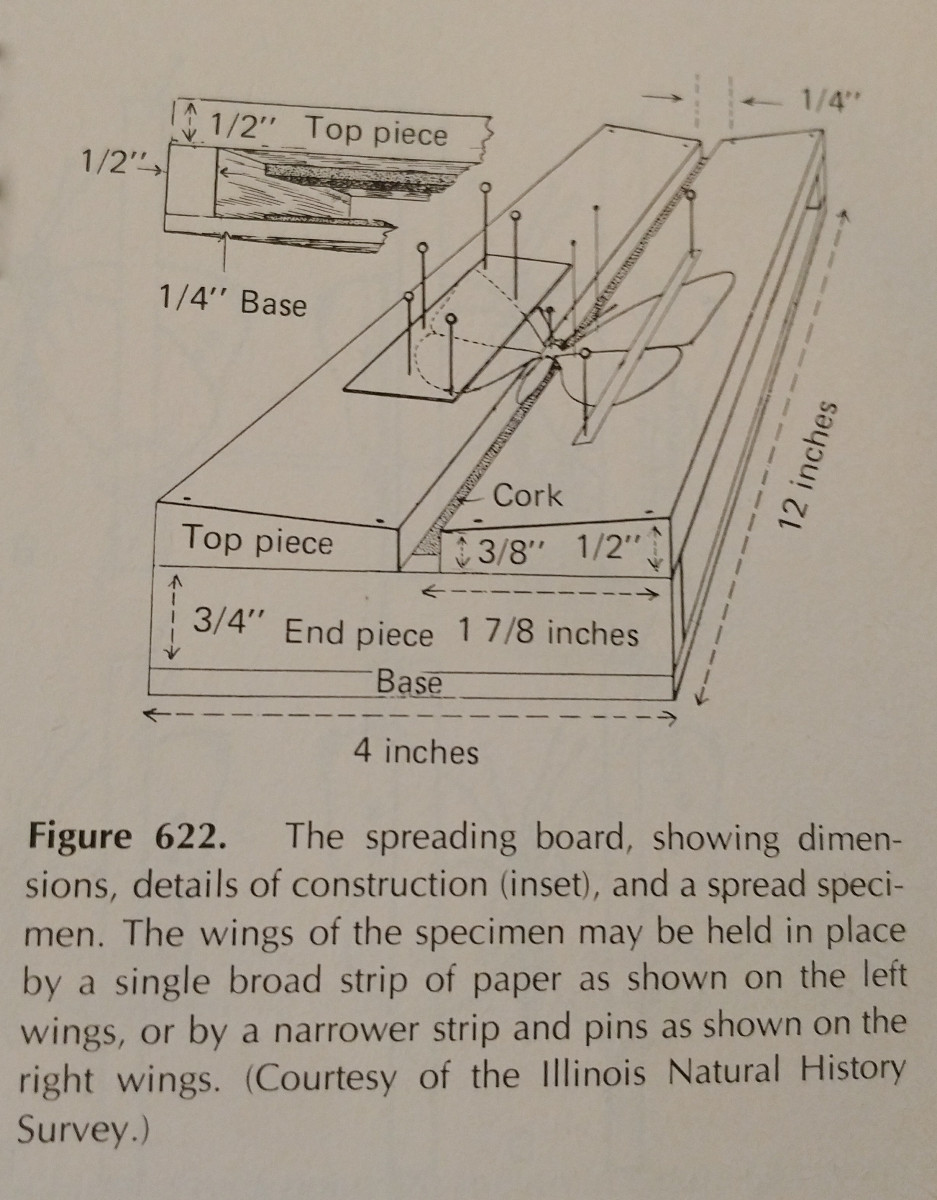
Tyypillisesti painetta olisi kohdistettava siiven etummaiseen marginaaliseen siipisuonistoon, erityisesti Lepidopteroilla. Lepidopteran siipien takareunan tulisi olla suorassa kulmassa rintakehään nähden, ja takasiipien tulisi olla ylhäällä niin, ettei niiden ja etusiipien välissä ole aukkoa, kuten kuvassa. On  tärkeää olla hyvin varovainen ja käyttää hyönteisten käsittelyssä pihtejä. Ne ovat hyvin hauraita, ja usein suomut ja antenni irtoavat helposti. Siipien kiinnittämiseen voi käyttää paperiliuskoja ja nuppineuloja, jolloin ne pysyvät paikoillaan kuivuttuaan.
tärkeää olla hyvin varovainen ja käyttää hyönteisten käsittelyssä pihtejä. Ne ovat hyvin hauraita, ja usein suomut ja antenni irtoavat helposti. Siipien kiinnittämiseen voi käyttää paperiliuskoja ja nuppineuloja, jolloin ne pysyvät paikoillaan kuivuttuaan.
Pienten hyönteisten kiinnittämiseen tarvitaan hieman kekseliäisyyttä, ja ne voidaan liimata kartonkikärjiin, pikkuruisiin nuppineuloihin tai mikroskooppidioihin. Kortin kärki vain nastoitetaan, siihen laitetaan pieni määrä liimaa ja sitten hyönteinen liimataan kiinni.
Kuivuminen: Monet kiinnitetyt hyönteiset voidaan kuivata ilmakuivattuna lämpimässä, kuivassa paikassa. Suuremmat koiperhoset saattavat tarvita kuivauskammion, jonka sisällä on yksi tai useampi hehkulamppu, ja joiltakin suurilta yksilöiltä saatetaan jopa joutua poistamaan vatsaelimet. Ei ole olemassa lopullista aikaa, joka näytteen kuivumiseen kuluu, mutta se tulee kokemuksen myötä.
Pehmeärunkoiset hyönteiset voidaan pakastus- tai tyhjiökuivata ja sen jälkeen kiinnittää, jotta saadaan haurastumaton ja värjäämätön näyte. Tavallisesti ne kutistuisivat, mutta tämä vaihe tekee niistä tarpeeksi kuivia pysyäkseen nastassa.
Tyypillisesti käytetään etyylialkoholiliuosta. Alla on lueteltu joitakin yleisiä.
| Hood’s solution | |
| 70-…80 % etyylialkoholi | 95 cm3 |
| Glyseriini | 5 cm3 |
| Kahlen liuos | |
| 95 %. Etyylialkoholi | 30 cm3 |
| Formaldehydi | 12 cm3 |
| Jääetikkahappo | 4 cm3 |
| Vesi | 60 %. cm3 |
| Alkoholi Bouinin liuos | |
| 80% etyylialkoholi | 150 cm3 |
| Formaldehydi | 60 cm3 |
| Jääetikkahappo | 15 cm3 |
| Pitriinihappo | 1g |
Kun ollaan jo liuoksista puhuttu, Etyyliasetaatti voi usein olla tehoton toukkiin, joten tässä on tappavia aineita, jotka riittävät:
| KAAD-seos | ||
| 95-prosenttinen etyylialkoholi | 70-alkoholia | .100 cm3 |
| Kerosiini (vähentää pehmeärunkoisille toukille, kuten toukille) | 10 cm3 | |
| Jääetikkahappo | 20 cm3 | |
| dioksaani | 10 cm3 |
| XA-seos | |
| 95% etyyliasetaatti | 50 %. cm3 |
| Xyleeni | 50 cm3 |
Kummankin menetelmän pitäisi kestää 1/2 – 4 tuntia. Kaikki tunnetut tappoaineet poistavat väriä, erityisesti vihreitä, sallivat ja punaisia.
Tyypillisesti säilötyt näytteet tulisi tarkastaa kerran tai kahdesti vuodessa, jos nestettä on haihtunut. Jos näin on, se on vaihdettava.
Monistaminen mikroskooppilasille: On olemassa kahdenlaisia mikroskooppitelineitä: pysyviä ja väliaikaisia. Niissä käytetään erilaisia kiinnitysalustoja, ja väliaikaisissa kiinnityksissä näytteet palautetaan yleensä kiinnityksen jälkeen säilöntäaineeseen, jossa niitä voidaan säilyttää loputtomiin. Pysyvät kiinnikkeet kiinnitetään kerran, eikä niitä voi sen jälkeen poistaa, mutta ne voivat säilyä melko pitkään, jopa useita vuosia.
Monet pehmeärunkoiset hyönteiset voidaan laittaa suoraan kiinnitysalustaan, mutta jotkin niistä on kuitenkin ensin puhdistettava erityisnesteessä. Tärkeimmät tähän käytetyt liuokset ovat KOH ja Nesbittin liuos. Tämä prosessi edellyttää usein hyönteisen liotusta useista tunneista moniin päiviin, kun se tehdään kylmänä, vaikka se voidaan tehdä nopeammin käyttämällä lämpöä ja KOH:ta.
Pienet yksilöt voidaan kiinnittää tavalliseen objektilasiin, kun taas suuremmat yksilöt saattavat tarvita syvennyslasia tai tukea peitinlasille.
Väliaikaisiin objektilasien kiinnitysmedioihin käytettäviä väliaikaiseen kiinnitykseen käytettäviä väliaineita ovat mm. vesi, alkoholi, glyseroli ja glyserolihyytelö. Vesi ja alkoholi saattavat kestää vain muutaman minuutin ennen haihtumistaan, joten glyseriiniä käytetään yleensä, jos näytteitä halutaan tutkia pidemmän aikaa.
Niin päättyy tämä viesti ja Borrorin, Delongin ja Triplehornin konservointiosio. Suurin osa tämän SOS:n lopputyöstä on asiakirjojeni ja diojeni kokoamista sekä sen varmistamista, että vuokaaviot ja protokolla ovat kunnossa.
