OPPIMISTAVOITTEET
- Kuvaile kovalenttisen ja ionisen sidoksen energetiikkaa. muodostumista ja katkeamista
- Käytä keskimääräisiä kovalenttisten sidosten energioita arvioidaksesi reaktioiden entalpioita
Sidoksen lujuus kuvaa sitä, kuinka vahvasti kukin atomi on sitoutunut toiseen atomiin, ja näin ollen kuinka paljon energiaa tarvitaan kahden atomin välisen sidoksen katkaisemiseen.
On tärkeää muistaa, että energiaa on lisättävä kemiallisten sidosten katkaisemiseksi (endoterminen prosessi), kun taas kemiallisten sidosten muodostaminen vapauttaa energiaa (eksoterminen prosessi). Tapauksessa ![]() kovalenttinen sidos on hyvin vahva; on lisättävä suuri määrä energiaa, 436 kJ, jotta yhden moolin vetymolekyylin sidokset rikkoutuisivat ja atomit irtoaisivat toisistaan:
kovalenttinen sidos on hyvin vahva; on lisättävä suuri määrä energiaa, 436 kJ, jotta yhden moolin vetymolekyylin sidokset rikkoutuisivat ja atomit irtoaisivat toisistaan:
\text{H}_2 (g) \ \ \ \longrightarrow \ \ \text{2H} (g) \ \ \longrightarrow \ \ \text{H}_2(g) \ \ \ \ \ \ \ \ \ \ \ \ \text{sidosenergia = -436 kJ}
Sidoksen lujuus: Covalent Bonds
Vakaita molekyylejä on olemassa, koska kovalenttiset sidokset pitävät atomit yhdessä. Mittaamme kovalenttisen sidoksen lujuutta sen katkaisemiseen tarvittavalla energialla eli sillä energialla, joka tarvitaan sidoksissa olevien atomien erottamiseen toisistaan. Minkä tahansa sidoksissa olevan atomiparin erottaminen vaatii energiaa. Mitä vahvempi sidos on, sitä suurempi on sen katkaisemiseen tarvittava energia.
Energiaa, joka tarvitaan tietyn kovalenttisen sidoksen katkaisemiseen yhdessä moolissa kaasumolekyylejä, kutsutaan sidosenergiaksi tai sidoksen dissosiaatioenergiaksi. Kaksiatomisen molekyylin sidosenergia, ![]() , määritellään endotermisen reaktion vakioentalpiamuutoksena:
, määritellään endotermisen reaktion vakioentalpiamuutoksena:
![]()
Esimerkiksi puhtaan kovalenttisen H-H-sidoksen sidosenergia, ![]() , on 436 kJ moolia kohti katkaistua H-H-sidosta:
, on 436 kJ moolia kohti katkaistua H-H-sidosta:
![]()
Molekyyleissä, joissa on kolme tai useampia atomeja, on kaksi tai useampia sidoksia. Tällaisen molekyylin kaikkien sidosenergioiden summa on yhtä suuri kuin molekyylin kaikki sidokset katkaisevan endotermisen reaktion vakioentalpiamuutos. Esimerkiksi ![]() neljän C-H-sidoksen energioiden summa, 1660 kJ, on yhtä suuri kuin reaktion vakioentalpiamuutos:
neljän C-H-sidoksen energioiden summa, 1660 kJ, on yhtä suuri kuin reaktion vakioentalpiamuutos:

Keskimääräinen C-H-sidoksen energia, ![]() on 1660/4 = 415 kJ/mol, koska reaktiomoolia kohti katkeaa neljä moolia C-H-sidoksia. Vaikka neljä C-H-sidosta ovat ekvivalentteja alkuperäisessä molekyylissä, ne eivät kaikki vaadi samaa energiaa katkeamiseen; kun ensimmäinen sidos on katkaistu (mikä vaatii 439 kJ/mol), loput sidokset ovat helpompia katkaista. Arvo 415 kJ/mol on keskiarvo, ei tarkka arvo, joka vaaditaan minkään yksittäisen sidoksen katkaisemiseen.
on 1660/4 = 415 kJ/mol, koska reaktiomoolia kohti katkeaa neljä moolia C-H-sidoksia. Vaikka neljä C-H-sidosta ovat ekvivalentteja alkuperäisessä molekyylissä, ne eivät kaikki vaadi samaa energiaa katkeamiseen; kun ensimmäinen sidos on katkaistu (mikä vaatii 439 kJ/mol), loput sidokset ovat helpompia katkaista. Arvo 415 kJ/mol on keskiarvo, ei tarkka arvo, joka vaaditaan minkään yksittäisen sidoksen katkaisemiseen.
Kahden atomin välisen sidoksen lujuus kasvaa, kun sidoksessa olevien elektroniparien määrä kasvaa. Yleensä sidoksen lujuuden kasvaessa sidoksen pituus pienenee. Näin ollen havaitaan, että kolmoissidokset ovat vahvempia ja lyhyempiä kuin kahden saman kahden atomin väliset kaksoissidokset; samoin kaksoissidokset ovat vahvempia ja lyhyempiä kuin kahden saman atomin väliset yksinkertaiset sidokset. Seuraavassa taulukossa esitetään eräiden yleisten sidosten keskimääräiset sidosenergiat ja seuraavassa taulukossa eräiden yleisten sidosten sidospituuksien ja sidosten vahvuuksien vertailu. Kun yksi atomi sitoutuu ryhmän eri atomeihin, sidoksen lujuus yleensä pienenee, kun siirrytään ryhmässä alaspäin. Esimerkiksi ![]() on 439 kJ/mol,
on 439 kJ/mol, ![]() on 330 kJ/mol ja
on 330 kJ/mol ja ![]() on 275 kJ/mol.
on 275 kJ/mol.
| Sidosenergiat (kJ/mol) | |||||||
|---|---|---|---|---|---|---|---|
| Sidos | Sidosenergia | Sidos | Sidosenergia | Sidos | Sidosenergia | ||
| 436 | 260 | 255 | |||||
| 415 | 330 | 235 | |||||
| 390 | 275 | 230 | |||||
| 464 | 240 | 215 | |||||
| 569 | 160 | 225 | |||||
| 395 | 418 | 359 | |||||
| 320 | 946 | 290 | |||||
| 340 | 200 | 215 | |||||
| 432 | 270 | 215 | |||||
| 370 | 210 | 230 | |||||
| 295 | 200 | 330 | |||||
| 345 | 245 | 270 | |||||
| 611 | 140 | 215 | |||||
| 837 | 498 | 215 | |||||
| 290 | 160 | 250 | |||||
| 615 | 370 | 215 | |||||
| 891 | 350 | 243 | |||||
| 350 | 205 | 220 | |||||
| 741 | 200 | 210 | |||||
| 1080 | 160 | 190 | |||||
| 439 | 540 | 180 | |||||
| 360 | 489 | 150 | |||||
| 265 | 285 | ||||||
| Keskimääräiset sidospituudet ja sidosenergiat eräille… Common Bonds | ||
|---|---|---|
| Bond | Bond Length (Å) | Bond Energy (kJ/mol) |
| 1.54 | 345 | |
| 1.34 | 611 | |
| 1.20 | 837 | |
| 1.43 | 290 | |
| 1.38 | 615 | |
| 1.16 | 891 | |
| 1.43 | 350 | |
| 1.23 | 741 | |
| 1.13 | 1080 | |
Sidosenergia on energiaminimin (joka tapahtuu sidosetäisyydellä) ja kahden erotetun atomin energian erotus. Tämä on se energiamäärä, joka vapautuu sidoksen muodostuessa. Vastaavasti sama energiamäärä tarvitaan sidoksen katkaisemiseen. Yllä olevassa taulukossa esitetyn ![]() -molekyylin tapauksessa 74 pm:n sidosetäisyydellä systeemin energia on 7,24 × 10-19 J pienempi kuin kahden erotetun vetyatomin energia. Tämä saattaa vaikuttaa pieneltä luvulta. Kuten opimme kuitenkin myöhemmin tarkemmin, sidosenergioista puhutaan usein molekyylikohtaisesti. Esimerkiksi yhden H-H-sidoksen katkaisemiseen tarvitaan 7,24 × 10-19 J, mutta yhden moolin H-H-sidoksen katkaisemiseen tarvitaan 4,36 × 105 J. Joidenkin sidospituuksien ja energioiden vertailu on esitetty yllä olevissa taulukoissa. Monia näistä sidoksista esiintyy monissa eri molekyyleissä, ja tässä taulukossa esitetään keskimääräisiä arvoja. Esimerkiksi
-molekyylin tapauksessa 74 pm:n sidosetäisyydellä systeemin energia on 7,24 × 10-19 J pienempi kuin kahden erotetun vetyatomin energia. Tämä saattaa vaikuttaa pieneltä luvulta. Kuten opimme kuitenkin myöhemmin tarkemmin, sidosenergioista puhutaan usein molekyylikohtaisesti. Esimerkiksi yhden H-H-sidoksen katkaisemiseen tarvitaan 7,24 × 10-19 J, mutta yhden moolin H-H-sidoksen katkaisemiseen tarvitaan 4,36 × 105 J. Joidenkin sidospituuksien ja energioiden vertailu on esitetty yllä olevissa taulukoissa. Monia näistä sidoksista esiintyy monissa eri molekyyleissä, ja tässä taulukossa esitetään keskimääräisiä arvoja. Esimerkiksi ![]() :n ensimmäisen C-H-sidoksen katkaiseminen vaatii 439,3 kJ/mol, kun taas
:n ensimmäisen C-H-sidoksen katkaiseminen vaatii 439,3 kJ/mol, kun taas ![]() :n (tavallinen maalin ohentaja) ensimmäisen C-H-sidoksen katkaiseminen vaatii 375 kJ/mol.5 kJ/mol.
:n (tavallinen maalin ohentaja) ensimmäisen C-H-sidoksen katkaiseminen vaatii 375 kJ/mol.5 kJ/mol.
Kuten yllä olevista taulukoista nähdään, keskimääräinen hiili-hiiliyksinkertainen sidos on 347 kJ/mol, kun taas hiili-hiili kaksoissidoksessa ![]() -sidos lisää sidoksen lujuutta 267 kJ/mol. Lisäsidoksen
-sidos lisää sidoksen lujuutta 267 kJ/mol. Lisäsidoksen ![]() lisääminen lisää lujuutta vielä 225 kJ/mol. Voimme nähdä samanlaisen kaavan, kun vertaamme muita
lisääminen lisää lujuutta vielä 225 kJ/mol. Voimme nähdä samanlaisen kaavan, kun vertaamme muita ![]() – ja
– ja ![]() -sidoksia. Jokainen yksittäinen
-sidoksia. Jokainen yksittäinen ![]() -sidos on siis yleensä heikompi kuin vastaava
-sidos on siis yleensä heikompi kuin vastaava ![]() -sidos kahden saman atomin välillä.
-sidos kahden saman atomin välillä. ![]() -sidoksessa on enemmän orbitaalien päällekkäisyyttä kuin
-sidoksessa on enemmän orbitaalien päällekkäisyyttä kuin ![]() -sidoksessa.
-sidoksessa.
Voidaan käyttää sidosenergioita laskettaessa likimääräisiä entalpian muutoksia reaktioille, joissa muodostumisen entalpioita ei ole saatavilla. Tämäntyyppiset laskelmat kertovat myös, onko reaktio eksoterminen vai endoterminen. Eksoterminen reaktio (ΔH negatiivinen, tuotettu lämpö) syntyy, kun tuotteiden sidokset ovat vahvempia kuin reagoivien aineiden sidokset. Endoterminen reaktio (ΔH positiivinen, absorboitunut lämpö) syntyy, kun tuotteiden sidokset ovat heikompia kuin reaktanttien sidokset.
Kemiallisen reaktion entalpiamuutos ΔH on suunnilleen yhtä suuri kuin kaikkien reaktanttien kaikkien sidosten katkaisemiseen vaaditun energian summa (energia ”sisään”, positiivinen merkki) plus energia, joka vapautuu, kun kaikki sidokset muodostuvat tuotteisiin (energia ”ulos”, negatiivinen merkki). Tämä voidaan ilmaista matemaattisesti seuraavalla tavalla:
![]()
Tässä lausekkeessa symboli ![]() tarkoittaa ”summa” ja D edustaa sidosenergiaa kilojouleina moolia kohti, joka on aina positiivinen luku. Sidosenergia saadaan taulukosta, ja se riippuu siitä, onko kyseinen sidos kerta-, kaksois- vai kolmoissidos. Näin ollen entalpioita tällä tavoin laskettaessa on tärkeää ottaa huomioon kaikkien reaktanttien ja tuotteiden sidokset. Koska D-arvot ovat tyypillisesti keskiarvoja yhden sidostyypin sidoksille monissa eri molekyyleissä, tämä laskutoimitus antaa karkean arvion, ei tarkkaa arvoa, reaktioentalpiasta.
tarkoittaa ”summa” ja D edustaa sidosenergiaa kilojouleina moolia kohti, joka on aina positiivinen luku. Sidosenergia saadaan taulukosta, ja se riippuu siitä, onko kyseinen sidos kerta-, kaksois- vai kolmoissidos. Näin ollen entalpioita tällä tavoin laskettaessa on tärkeää ottaa huomioon kaikkien reaktanttien ja tuotteiden sidokset. Koska D-arvot ovat tyypillisesti keskiarvoja yhden sidostyypin sidoksille monissa eri molekyyleissä, tämä laskutoimitus antaa karkean arvion, ei tarkkaa arvoa, reaktioentalpiasta.
Tarkastellaan seuraavaa reaktiota:
![]()
tai
![]()
muodostetaan kaksi moolia ![]() , on rikottava yksi mooli H-H-sidoksia ja yksi mooli Cl-Cl-sidoksia. Näiden sidosten katkaisemiseen tarvittava energia on H-H-sidoksen (436 kJ/mol) ja Cl-Cl-sidoksen (243 kJ/mol) sidosenergioiden summa. Reaktion aikana muodostuu kaksi moolia H-Cl-sidoksia (sidosenergia = 432 kJ/mol), jolloin vapautuu 2 × 432 kJ eli 864 kJ. Koska tuotteiden sidokset ovat vahvempia kuin reaktanttien sidokset, reaktio vapauttaa enemmän energiaa kuin se kuluttaa:
, on rikottava yksi mooli H-H-sidoksia ja yksi mooli Cl-Cl-sidoksia. Näiden sidosten katkaisemiseen tarvittava energia on H-H-sidoksen (436 kJ/mol) ja Cl-Cl-sidoksen (243 kJ/mol) sidosenergioiden summa. Reaktion aikana muodostuu kaksi moolia H-Cl-sidoksia (sidosenergia = 432 kJ/mol), jolloin vapautuu 2 × 432 kJ eli 864 kJ. Koska tuotteiden sidokset ovat vahvempia kuin reaktanttien sidokset, reaktio vapauttaa enemmän energiaa kuin se kuluttaa:
Tämä ylimääräinen energia vapautuu lämpönä, joten reaktio on eksoterminen. Liitteessä G annetaan arvo vakiomolaariselle muodostumisentalpialle ![]() ,
, ![]() , on -92,307 kJ/mol. Kaksinkertainen arvo on -184,6 kJ, mikä vastaa hyvin aiemmin saatua vastausta kahden mooli HCl:n muodostumiselle.
, on -92,307 kJ/mol. Kaksinkertainen arvo on -184,6 kJ, mikä vastaa hyvin aiemmin saatua vastausta kahden mooli HCl:n muodostumiselle.
LÄHTEET
Sidosenergioiden käyttäminen likimääräisten entalpianmuutosten laskemiseen
Metanoli, ![]() , voi olla erinomainen vaihtoehtoinen polttoaine. Höyryn ja hiilen korkean lämpötilan reaktiossa syntyy hiilimonoksidin,
, voi olla erinomainen vaihtoehtoinen polttoaine. Höyryn ja hiilen korkean lämpötilan reaktiossa syntyy hiilimonoksidin, ![]() ja vedyn,
ja vedyn, ![]() , josta voidaan valmistaa metanolia. Laske edellä olevissa taulukoissa olevien sidosenergioiden avulla likimääräinen entalpiamuutos ΔH tässä reaktiossa:
, josta voidaan valmistaa metanolia. Laske edellä olevissa taulukoissa olevien sidosenergioiden avulla likimääräinen entalpiamuutos ΔH tässä reaktiossa:
![]()
Liuos
Aluksi on kirjoitettava reaktanttien ja tuotteiden Lewis-rakenteet:

Tästä nähdään, että tämän reaktion ΔH sisältää energian, joka tarvitaan C-O-kolmisidoksen ja kahden H-H-yksisidoksen katkaisemiseen, sekä energian, joka syntyy kolmen C-H-yksisidoksen, C-O-yksisidoksen ja O-H-yksisidoksen muodostumisesta. Tämä voidaan ilmaista seuraavasti:
Taulukon sidosenergia-arvoja käyttäen, saadaan:
Voidaan verrata tätä arvoa liitteen G ![]() tietojen perusteella laskettuun arvoon:
tietojen perusteella laskettuun arvoon:
Huomaa, että kahdella eri menetelmällä laskettujen arvojen välillä on melko suuri ero. Tämä johtuu siitä, että D-arvot ovat eri sidoslujuuksien keskiarvoja; siksi ne antavat usein vain karkean yhdenmukaisuuden muiden tietojen kanssa.
Check Your Learning
Etyylialkoholi, ![]() , oli yksi ensimmäisistä ihmisen tarkoituksellisesti syntetisoimista orgaanisista kemikaaleista. Sillä on monia käyttötarkoituksia teollisuudessa, ja se on alkoholijuomien sisältämä alkoholi. Sitä voidaan saada fermentoimalla sokeria tai syntetisoida etyleenin hydratoimalla seuraavassa reaktiossa:
, oli yksi ensimmäisistä ihmisen tarkoituksellisesti syntetisoimista orgaanisista kemikaaleista. Sillä on monia käyttötarkoituksia teollisuudessa, ja se on alkoholijuomien sisältämä alkoholi. Sitä voidaan saada fermentoimalla sokeria tai syntetisoida etyleenin hydratoimalla seuraavassa reaktiossa:

Laskekaa taulukon sidosenergioiden avulla likimääräinen entalpianmuutos ΔH tälle reaktiolle.
-35 kJ
Ionisen sidoksen voimakkuus ja ristikon energia
Ioninen yhdiste on stabiili sen positiivisten ja negatiivisten ionien välisen sähköstaattisen vetovoiman vuoksi. Yhdisteen ristikon energia on tämän vetovoiman voimakkuuden mitta. Ionisen yhdisteen ristikkoenergia (ΔHlattice) määritellään energiana, joka tarvitaan yhden moolin kiinteän aineen erottamiseen kaasumaisiksi ioneiksi. Ioniselle kiinteälle aineelle MX ristikon energia on prosessin entalpian muutos:
![]()
Huomaa, että käytämme konventiota, jossa ioninen kiinteä aine on erotettu ioneiksi, joten ristikkoenergiat ovat endotermisiä (positiivisia arvoja). Joissakin teksteissä käytetään vastaavaa, mutta päinvastaista konventiota, jossa ristikon energia määritellään energiaksi, joka vapautuu, kun erilliset ionit yhdistyvät muodostaen ristikon, ja annetaan negatiivisia (eksotermisiä) arvoja. Jos siis etsit ristikkoenergioita toisesta viitteestä, tarkista, mitä määritelmää käytetään. Molemmissa tapauksissa ristikon energian suurempi arvo osoittaa, että ioniyhdiste on vakaampi. Natriumkloridille ![]() . Näin ollen yhden moolin kiinteän \text{NaCl}:n erottaminen vaatii 769 kJ. kaasumaisiksi
. Näin ollen yhden moolin kiinteän \text{NaCl}:n erottaminen vaatii 769 kJ. kaasumaisiksi ![]() ja
ja ![]() ioneiksi. Kun yksi mooli kumpaakin kaasumaista
ioneiksi. Kun yksi mooli kumpaakin kaasumaista ![]() ja
ja ![]() -ioneja muodostaa kiinteän \text{NaCl} , jolloin vapautuu 769 kJ lämpöä.
-ioneja muodostaa kiinteän \text{NaCl} , jolloin vapautuu 769 kJ lämpöä.
Ristikon energia ![]() ionikide voidaan ilmaista seuraavalla yhtälöllä (johdettu Coulombin laista, joka säätelee sähkövarausten välisiä voimia):
ionikide voidaan ilmaista seuraavalla yhtälöllä (johdettu Coulombin laista, joka säätelee sähkövarausten välisiä voimia):
![]()
jossa C on vakio, joka riippuu kiderakennetyypistä; Z+ ja Z- ovat ionien varaukset; ja Ro on ionien välinen etäisyys (positiivisten ja negatiivisten ionien säteiden summa). Näin ollen ionikiteen hilan energia kasvaa nopeasti, kun ionien varaukset kasvavat ja ionien koot pienenevät. Kun kaikki muut parametrit pidetään vakiona, sekä kationin että anionin varauksen kaksinkertaistaminen nelinkertaistaa hilan energian. Esimerkiksi \text{LiF}:n \text{LiF}:n ristikon energia on kaksinkertainen. (Z+ ja Z- = 1) on 1023 kJ/mol, kun taas \text{MgO}:n \text{MgO} (Z+ ja Z- = 2) on 3900 kJ/mol (Ro on lähes sama – noin 200 pm molemmille yhdisteille).
Eriatomien väliset etäisyydet tuottavat erilaiset ristikon energiat. Voimme esimerkiksi verrata ![]() (2957 kJ/mol) ristikon energiaa
(2957 kJ/mol) ristikon energiaa ![]() (2327 kJ/mol) ristikon energiaan havaitaksemme F-:n pienemmän ionikoon vaikutuksen ristikon energiaan verrattuna I-:een.
(2327 kJ/mol) ristikon energiaan havaitaksemme F-:n pienemmän ionikoon vaikutuksen ristikon energiaan verrattuna I-:een.
ESIMERKKI
Ristikkoenergian vertailu
Jalokivirubiini on alumiinioksidia, ![]() , joka sisältää pieniä määriä
, joka sisältää pieniä määriä ![]() . Yhdistettä
. Yhdistettä ![]() käytetään joidenkin puolijohdekomponenttien valmistuksessa. Kummalla on suurempi hilan energia,
käytetään joidenkin puolijohdekomponenttien valmistuksessa. Kummalla on suurempi hilan energia, ![]() vai
vai ![]() ?
?
Ratkaisu
Näissä kahdessa ioniyhdisteessä varaukset Z+ ja Z- ovat samat, joten hilan energian ero riippuu Ro:sta. ![]() -ioni on pienempi kuin
-ioni on pienempi kuin ![]() ioni. Näin ollen
ioni. Näin ollen ![]() :llä olisi lyhyempi interioninen etäisyys kuin
:llä olisi lyhyempi interioninen etäisyys kuin ![]() :llä, ja
:llä, ja ![]() :llä olisi suurempi ristikon energia.
:llä olisi suurempi ristikon energia.
Check Your Learning
Sinkkioksidilla, \text{ZnO} , on erittäin tehokas aurinkosuoja-aine. Miten \text{ZnO}:n \text{ZnO}:n ristikon energia olisi suurempi? verrattuna \text{NaCl}:n \text{NaCl} ?
\text{ZnO} \text{ZnO} olisi suurempi ristikon energia, koska sekä kationin että anionin Z-arvot \text{ZnO}:ssa ovat suuremmat. ovat suurempia ja \text{ZnO}:n interioninen etäisyys on suurempi. on pienempi kuin \text{NaCl}:ssä. .
KESKEISET TEKIJÄT
Kovalenttisen sidoksen lujuutta mitataan sen sidoksen dissosiaatioenergialla eli sillä energiamäärällä, joka tarvitaan kyseisen sidoksen katkaisemiseen moolissa molekyylejä. Moninkertaiset sidokset ovat vahvempia kuin yksittäiset sidokset samojen atomien välillä. Reaktion entalpia voidaan arvioida sidosten katkaisemiseen tarvittavan energian ja uusien sidosten muodostuessa vapautuvan energian perusteella. Ionisidosten osalta hilan energia on energia, joka tarvitaan yhden moolin yhdisteen erottamiseen kaasufaasin ioneiksi. Gitterienergia kasvaa ioneilla, joiden varaukset ovat suurempia ja ionien väliset etäisyydet lyhyempiä.
- Diaatomisen molekyylin sidosenergia:
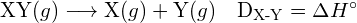
- Entalpia muutos:

- Tyhjän MX:n ristikon energia:
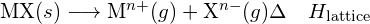
- Ionikiteen hilan energia:
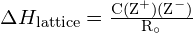
KAPPALEEN LOPPU HARJOITUKSET
- Mikä sidos kussakin seuraavassa esitetyistä sidospareista on vahvin? (a)
 tai
tai 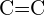 b)
b) 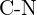 tai
tai 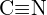 c)
c) 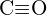 tai
tai 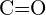 d)
d) 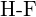 tai
tai 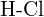 (e)
(e) 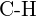 tai
tai 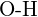 f)
f) 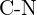 tai
tai 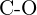
- Määritä taulukossa olevien sidosenergioiden avulla likimääräinen entalpian muutos jokaiselle seuraavista reaktioista: (a)
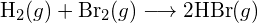 b)
b) 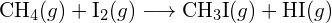 (c)
(c) 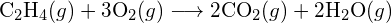 (a) -114 kJ; (b) 30 kJ; (c) -1055 kJ
(a) -114 kJ; (b) 30 kJ; (c) -1055 kJ - Määritä taulukossa olevien sidosenergioiden avulla likimääräinen entalpiamuutos kullekin seuraavista reaktioista: (a)
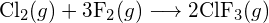 (b)
(b) 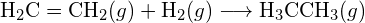 (c)
(c) 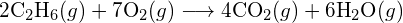
- Piirrä käyrä, joka kuvaa sellaisen systeemin energiaa, jossa H- ja Cl-atomit ovat eri etäisyyksillä. Etsi sitten tämän käyrän pienin energia kahdella tavalla. a) Käytä taulukoista löytyvää sidosenergiaa laskeaksesi yhden yksittäisen
 sidoksen (Vihje: Kuinka monta sidosta on mooliin?)(b) Käytä reaktioentalpia ja H2:n ja Cl2:n sidosenergioita ratkaistaksesi yhden moolin
sidoksen (Vihje: Kuinka monta sidosta on mooliin?)(b) Käytä reaktioentalpia ja H2:n ja Cl2:n sidosenergioita ratkaistaksesi yhden moolin  sidoksia.
sidoksia.
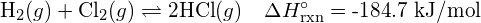
Erittele, miksi sidokset syntyvät tietyillä keskimääräisillä sidosetäisyyksillä sen sijaan, että atomit lähestyisivät toisiaan äärettömän läheltä.
Tietyllä keskimääräisellä sidosetäisyydellä tarkoitetaan matalimman energian etäisyyttä. Sidosetäisyyttä pienemmillä etäisyyksillä kahden ytimen positiiviset varaukset hylkivät toisiaan ja kokonaisenergia kasvaa. - Kun molekyyli voi muodostaa kaksi erilaista rakennetta, se rakenne, jossa on vahvemmat sidokset, on yleensä vakaampi muoto. Ennusta hydroksyyliamiinimolekyylin oikea rakenne sidosenergioiden avulla:
 Vasemmanpuoleisessa kuvassa on suurempi sidosenergia. Se on stabiilimpi muoto.
Vasemmanpuoleisessa kuvassa on suurempi sidosenergia. Se on stabiilimpi muoto. - Miten sidosenergia on \text{HCl} (g) eroaa \text{HCl}:n muodostumisen vakioentalpiasta. (g) ?
- Osoita lisäyksessä G olevien muodostumisen vakioentalpiatietojen avulla, miten
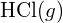 voidaan käyttää sidosenergian määrittämiseen.
voidaan käyttää sidosenergian määrittämiseen.
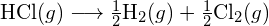
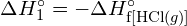
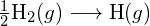
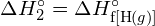
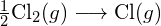
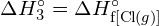
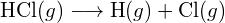
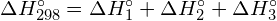
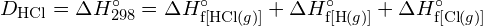
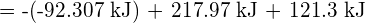
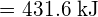
- Laskekaa hiili-rikki kaksoissidoksen sidosenergia \text{CS}_2 hiili-rikki kaksoissidoksen \text{CS}_2 \text{CS}_2 \text{CS}_2 \text{CS}_2 \text{CS}_2 \text{CS}_2 \text{CS{CS}_2 \text{CS{CS}_2} sidosenergia lisäyksen G mukaisien vakioentalpiadataa käyttäen.
- Määritä liitteen G muodostumisen vakioentalpiatietojen avulla, kumpi sidos on vahvempi: S-F-sidos kohdassa
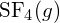 vai kohdassa
vai kohdassa 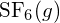 ?
S-F-sidos kohdassa
?
S-F-sidos kohdassa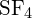 on vahvempi.
on vahvempi. - Määritä lisäyksessä G esitettyjen muodostumisen vakioentalpiatietojen avulla, kumpi sidos on vahvempi: P-Cl-sidos kohdassa \text{PCl}_3 (g) vai kohdassa P-cl-sidos kohdassa \text{PCl}_3 (g) ?
- Täydennä seuraava Lewisin rakenne lisäämällä sidoksia (ei atomeja) ja merkitse sitten pisin sidos:

 C-C-yksisiteet ovat pisimpiä.
C-C-yksisiteet ovat pisimpiä. - Käytä sidosenergiaa laskeaksesi ΔH:n likiarvon seuraavalle reaktiolle. Kumpi on
 :n stabiilimpi muoto?Kahden Lewisin rakenteen välissä on oikealle osoittava nuoli. Vasemmanpuoleisessa rakenteessa typpiatomi on kaksoissidoksessa happiatomin kanssa, jolla on kaksi yksinäistä elektroniparia. Se on myös sitoutunut fluoriatomiin ja toiseen happiatomiin, joilla kummallakin on kolme yksinäistä elektroniparia. Oikeanpuoleisessa rakenteessa happiatomi, jolla on kaksi yksinäistä elektroniparia, on kaksoissidoksessa typpiatomin kanssa, jolla on yksi yksinäinen elektronipari. Tämä typpiatomi on yksisidoksissa happiatomiin, jolla on kaksi yksinäistä elektroniparia. Happiatomi on yksisidoksissa fluoriatomiin, jolla on kolme yksinäistä elektroniparia.
:n stabiilimpi muoto?Kahden Lewisin rakenteen välissä on oikealle osoittava nuoli. Vasemmanpuoleisessa rakenteessa typpiatomi on kaksoissidoksessa happiatomin kanssa, jolla on kaksi yksinäistä elektroniparia. Se on myös sitoutunut fluoriatomiin ja toiseen happiatomiin, joilla kummallakin on kolme yksinäistä elektroniparia. Oikeanpuoleisessa rakenteessa happiatomi, jolla on kaksi yksinäistä elektroniparia, on kaksoissidoksessa typpiatomin kanssa, jolla on yksi yksinäinen elektronipari. Tämä typpiatomi on yksisidoksissa happiatomiin, jolla on kaksi yksinäistä elektroniparia. Happiatomi on yksisidoksissa fluoriatomiin, jolla on kolme yksinäistä elektroniparia. - Käytä atomirakenteen periaatteita vastataksesi kuhunkin seuraavista kysymyksistä:1 a) Ca-atomin säde on 197 pm;
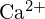 ionin säde on 99 pm. Selitä ero. (b) \text{CaO} \text{CaO} (s) on -3460 kJ/mol; \text{K}_2\text{O}:n
ionin säde on 99 pm. Selitä ero. (b) \text{CaO} \text{CaO} (s) on -3460 kJ/mol; \text{K}_2\text{O}:n
Elementti Ensimmäinen ionisaatioenergia (kJ/mol) Toinen ionisaatioenergia (kJ/mol) K 419 3050 Ca 590 1140 (d) Mg:n ensimmäinen ionisaatioenergia on 738 kJ/mol ja Al:n 578 kJ/mol. Selitä tämä ero.
(a) Kun kaksi elektronia poistetaan valenssikuoresta, Ca-säde menettää uloimman energiatason ja palaa alemmalle n = 3 -tasolle, jonka säde on paljon pienempi.(b) Kalsiumin +2-varaus vetää happea paljon lähemmäs K:hon verrattuna, mikä kasvattaa ristikon energiaa suhteessa vähemmän varattuun ioniin.
(c) Ca:n 4s:n elektronin poistuminen vaatii enemmän energiaa kuin K:n 4s:n elektronin poistuminen, koska ytimen vetovoima on voimakkaampi ja elektronien pariliitoksen katkaisemiseen tarvitaan ylimääräistä energiaa. K:n toinen ionisaatioenergia edellyttää elektronin poistamista alemmalta energiatasolta, jossa ytimen vetovoima elektroniin on paljon voimakkaampi. Lisäksi tarvitaan energiaa kahden elektronin parin irrottamiseen täydellä orbitaalilla. Ca:n osalta toinen ionisaatiopotentiaali edellyttää vain yksinäisen elektronin poistamista altistuneelta ulommalta energiatasolta.
(d) Al:ssa poistettu elektroni on suhteellisen suojaamaton ja parittamaton p-orbitaalissa. Mg:n korkeampi energia heijastaa lähinnä 2s-elektronin parittomuutta.
- Mille seuraavista aineista tarvitaan vähiten energiaa, jotta yksi mooli kiinteää ainetta muuttuu erillisiksi ioneiksi? (a) \text{MgO} b)
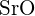 c)
c) 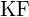 d)
d) 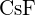 (e)
(e) 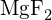 (d)
(d) - Metallin,
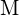 , ja halogeeni,
, ja halogeeni, 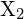 , etenee eksotermisenä reaktiona tämän yhtälön osoittamalla tavalla:
, etenee eksotermisenä reaktiona tämän yhtälön osoittamalla tavalla: 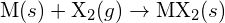 . Ilmoita kunkin seuraavan vaihtoehdon kohdalla, mikä vaihtoehto tekee reaktiosta eksotermisemmän. Selitä vastauksesi. (a) suuri säde vs. pieni säde varten
. Ilmoita kunkin seuraavan vaihtoehdon kohdalla, mikä vaihtoehto tekee reaktiosta eksotermisemmän. Selitä vastauksesi. (a) suuri säde vs. pieni säde varten 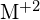 (b) suuri ionisaatioenergia vs. pieni ionisaatioenergia, kun kyseessä on
(b) suuri ionisaatioenergia vs. pieni ionisaatioenergia, kun kyseessä on 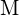 (c) kasvava sidosenergia halogeenille (d) laskeva elektroniaffiniteetti halogeenille (e) halogeenin muodostaman anionin koon kasvaminen
(c) kasvava sidosenergia halogeenille (d) laskeva elektroniaffiniteetti halogeenille (e) halogeenin muodostaman anionin koon kasvaminen - \text{LiF} on 1023 kJ/mol, ja Li-F:n etäisyys on 201 pm. \text{MgO} kiteytyy samaan rakenteeseen kuin \text{LiF} , mutta Mg-O-etäisyys on 205 pm. Mikä seuraavista arvoista lähentää parhaiten \text{MgO}:n \text{MgO}:n hilan energiaa. : 256 kJ/mol, 512 kJ/mol, 1023 kJ/mol, 2046 kJ/mol vai 4008 kJ/mol? Selitä valintasi.
4008 kJ/mol; molemmat ionit \text{MgO}:ssa \text{MgO} on kaksi kertaa niin suuri varaus kuin ionien \text{LiF} ; sidospituus on hyvin samankaltainen ja molemmilla on sama rakenne; energian nelinkertaistuminen on odotettavissa ristikkoenergian yhtälön
- perusteella Minkä yhdisteen kussakin seuraavista pareista ristikkoenergia on suurempi? Huomautus:
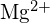 ja
ja 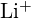 ovat säteeltään samanlaisia;
ovat säteeltään samanlaisia; 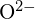 ja
ja 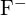 on samanlaiset säteet. Selitä valintasi. (a) \text{MgO} tai
on samanlaiset säteet. Selitä valintasi. (a) \text{MgO} tai 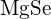 b) \text{LiF} tai \text{MgO} c)
b) \text{LiF} tai \text{MgO} c) 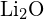 tai
tai 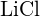 d)
d) 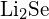 tai \text{MgO}
tai \text{MgO} - Millä yhdisteellä kussakin seuraavista pareista on suurempi hilan energia? Huomautus:
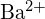 ja
ja 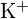 ovat säteeltään samanlaisia;
ovat säteeltään samanlaisia; 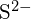 ja
ja 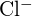 on samanlaiset säteet. Selitä valintasi. (a) \text{K}_2\text{O} tai
on samanlaiset säteet. Selitä valintasi. (a) \text{K}_2\text{O} tai 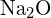 b)
b) 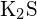 tai
tai  c)
c) 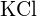 tai
tai  (d)
(d)  tai
tai 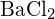 (a)
(a)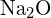 ;
; 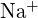 säde on pienempi kuin
säde on pienempi kuin 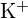 ; (b)
; (b)  ;
; 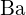 on suurempi varaus kuin
on suurempi varaus kuin 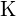 ; (c)
; (c)  ;
; 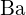 ja
ja 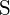 on suurempi varaus; (d)
on suurempi varaus; (d)  ;
; 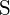 on suurempi varaus
on suurempi varaus - Mikä seuraavista yhdisteistä vaatii eniten energiaa yhden moolin kiinteän aineen muuttamiseen erillisiksi ioneiksi? (a) \text{MgO} b)
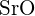 c)
c) 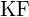 d)
d) 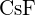 (e)
(e) 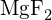
- Mikä seuraavista yhdisteistä vaatii eniten energiaa yhden moolin kiinteän aineen muuttamiseen erillisiksi ioneiksi? (a)
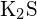 (b) \text{K}_2\text{O} c)
(b) \text{K}_2\text{O} c) 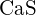 d)
d) 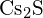 e)
e) 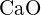 (e)
(e)
Footnotes
- 1 Tämä kysymys on peräisin Chemistry Advanced Placement Examination -kokeesta, ja sitä on käytetty Educational Testing Servicen luvalla.
Sanasto
sidosenergia (myös, bond dissociation energy) energia, joka tarvitaan kovalenttisen sidoksen katkaisemiseen kaasumaisessa aineessa lattice energy (ΔHlattice) energia, joka tarvitaan yhden moolin ionisen kiinteän aineen erottamiseen komponentteihinsa. kaasumaiset ionit
energia, joka tarvitaan yhden mooli ionisen kiinteän aineen erottamiseen sen osiksi kaasumaiset ionit
