Kun tasaisesti virtaava kaasu kulkee ahtauman, esimerkiksi aukon tai venttiilin, läpi, sen lämpötila yleensä muuttuu. Tämä johtuu osittain liike-energian muutoksista, mutta toinen osa johtuu kaasun epäideaalisuudesta. Jos ylävirran ja alavirran kanavat ovat riittävän suuria, jotta kineettinen energia on merkityksettömän pieni näissä asemissa, ylävirran ja alavirran lämpötilat mitataan riittävän kaukana ahtauman aiheuttamasta häiriöstä ja järjestelmä on adiabaattinen; mitattu vaikutus johtuu pelkästään epäideaalisuudesta. Termodynamiikan ensimmäisen lain perusteella tällainen prosessi on isenthalpinen, ja voidaan hyödyllisesti määritellä Joule-Thomsonin kerroin seuraavasti:
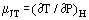
Mittana lämpötilan muutoksesta, joka aiheutuu paineen laskusta supistuksen läpi.
Useimmille todellisille kaasuille suunnilleen ympäröivissä olosuhteissa μ on positiivinen eli lämpötila laskee kulkiessaan supistuksen läpi. Vedylle ja heliumille se on negatiivinen ja lämpötila nousee. Korkeammissa lämpötiloissa useimmilla kaasuilla μ laskee ja voi jopa muuttua negatiiviseksi, μ voi myös muuttua negatiiviseksi paineen avulla, jopa ympäristön lämpötilassa, mutta tähän tarvitaan yleensä yli 200 barin paineita.
