- Methodology
- Kuva1:Kuvantamispolku
- Diagnostinen lähestymistapa ja alkututkimus
- Virtsan sytologia
- Alustava kuvantaminen matalan riskin potilailla
- Kuva2:Transitional-cell-carcinoma-of-the-bladder-(US)
- Kuva3:Munuaisten siirtymäsolusyöpä (US ja RPUG)
- Riskipotilaiden alkukuvantaminen
- Kuva4:Virtsarakon ja munuaisten TCC-(CTU)
- Kuva5:Virtsarakon TCC (MRI)
- Kuva6:Virtsanjohtimen TCC (CTU)
- Kuva7:Virtsarakon kasvain (kystoskopia)
- Muut kuvantamistutkimukset
- Kliininen seuranta
- Taulukko2: Lähettämisindikaatiot
Methodology
Elokuun ja syyskuun 2015 välisenä aikana tehdyllä elektronisella haulla MEDLINE-verkkopalvelusta PubMedin kautta ja Cochrane Database of Systematic reviews -tietokannasta löydettiin merkityksellisiä alkuperäisartikkeleita, järjestelmällisiä katsauksia ja näyttöön perustuvia ohjeita ajanjaksolta 2008-syyskuu 2015, jotka otettiin mukaan. Seuraavia termejä käytettiin yhdessä kirjallisuuskatsauksen aikana, jotta saatiin luettelo tarkastetuista artikkeleista: ”kivuton”, ”makroskooppinen”, ”näkyvä” JA ”hematuria”, ”munuaiset”, ”virtsaputket”, ”virtsarakko”, ”virtsarakon syöpä”, ”virtsateiden syöpä”, ”virtsateiden syöpä”, ”sytologia”, ”diagnostinen kuvantaminen”, ”röntgenkuvaus”, ”ultraäänitutkimus”, ”ultraääni”, ”pyelografia”, ”tomography, X-ray computed” AND ”urography”, ”magnetic resonance” AND ”urography”, ”intravenous” OR ”excretory” AND ”urography”, ”urology” OR ”nephrology” AND ”referral” OR ”consultation”, ”cystoscopy”, ”guidelines”.
Katsausta varten tehtiin myös manuaalinen haku muiden relevanttien julkaisujen tunnistamiseksi haetuista tutkimuksista. Yhteensä 84 kokotekstiartikkelia poimittiin ja arvioitiin niiden kelpoisuutta. Alkuperäistutkimuksia, näyttöön perustuvia ohjeita tai järjestelmällisiä katsauksia kuvaavat artikkelit otettiin mukaan, kun taas pediatriset ja eläinkokeet jätettiin pois. Myös artikkelit, jotka eivät olleet englanninkielisiä tai joiden teksti oli suppea, jätettiin pois, minkä jälkeen mukaan otettiin 59 lopullista artikkelia, jotka luokiteltiin Oxford Centre for Evidence-Based Medicine Levels of Evidence -standardin mukaisesti. Diagnostic Imaging Pathways (DIP) -julkaisun asiantuntijapaneelin jäsenet tuottivat ja tarkistivat näyttöön perustuvat polut tavanomaisten DIP-prosessien (http://www.imagingpathways.health.wa.gov.au/index.php/production/processes-for-creating-and-managing-content) mukaisesti kuullen päätoimittajaa, urologia ja nefrologia. Lopullinen algoritmi (kuva 1), joka on saatavilla myös Imaging Pathways -verkkopalvelussa (Online clinical decision-making tool: Dulku G. Kivuton makroskooppinen hematuria. Diagnostic Imaging Pathways; syyskuu 2015), antaa ohjeita ja kuvantamissuosituksia aikuispotilaille, joilla on selittämätöntä, kivutonta, näkyvää hematuriaa.
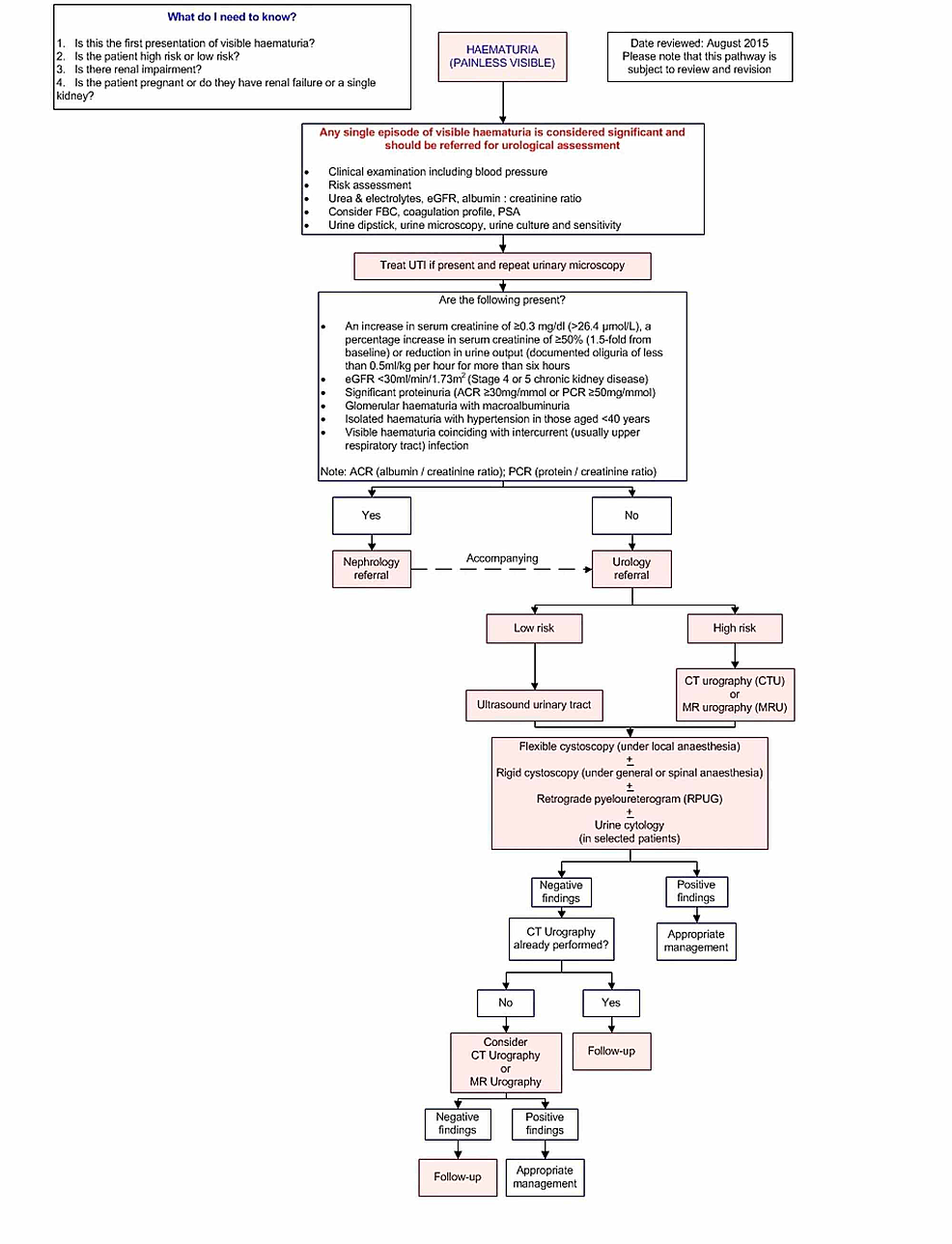
Kuva1:Kuvantamispolku
Tässä kuvantamispolussa annetaan ohjeita kuvantamisesta aikuispotilaille, joilla on selittämätöntä kivutonta, näkyvää hematuriaa.
eGFR: Estimoitu glomerulussuodatusnopeus (Estimated glomerular filtration rate); FBC: PSA: Prostataspesifinen antigeeni; ACR: Albumiinin ja kreatiniinin suhde; PCR: Protein/creatinine ratio; UTI: Virtsatieinfektio.
Katsauksessamme ei analysoitu kuvantamisohjeita virtsateiden kivien havaitsemiseksi hematurian syynä, koska tyypillisesti tähän liittyy kipua. Keskityimme ensisijaisesti kuvantamisohjeisiin ja niitä tukevaan kirjallisuuteen, jotka koskevat kivutonta näkyvää hematuriaa, jonka mahdollisena syynä ovat urologiset pahanlaatuiset kasvaimet.
Diagnostinen lähestymistapa ja alkututkimus
British Association of Urological Surgeons (BAUS) ja Interregional Chiefs of Urology Service (IRCUS), Kaiser Permanente, Amerikka ehdottivat, että mitä tahansa yksittäistä VH-episodia pidetään merkittävänä, ja se olisi ohjattava urologiseen arviointiin, johon lähes kaikissa tapauksissa kuuluu kystoskopia .
Välillä voidaan tehdä tutkimuksia ohimenevien, hoidettavissa olevien syiden tunnistamiseksi ja järjestää ensisijainen kuvantaminen. Potilaat, joilla on VH ja todettu virtsatieinfektio, olisi silti tutkittava samanaikaisen pahanlaatuisen sairauden varalta, koska pahanlaatuinen sairaus esiintyy usein samanaikaisesti infektion kanssa tai toimii infektion leviämisympäristönä. Virtsatieinfektio olisi hoidettava ennen kystoskopiaa, koska on olemassa urosepsiksen riski, jos kystoskopia tehdään aktiivisen virtsatietulehduksen yhteydessä.
VH:n esiintymistä ei myöskään pitäisi liittää antikoagulantti- tai trombosyyttilääkitykseen, ja nämä potilaat olisi arvioitava myös näistä lääkkeistä riippumatta, sillä kahdessa erillisessä tutkimussarjassa raportoitiin 24 %:lla ja 7 %:lla potilaista taustalla olevasta pahanlaatuisesta taudista .
Kuvantamisen ensisijaisena tehtävänä on siis tunnistaa ne potilaat, joilla on pahanlaatuinen syy hematuriaan. Kuvantamismenetelmän valinta riippuu kuitenkin useista yksittäisistä potilastekijöistä (esim. ikä, pahanlaatuisuuden riskitekijät, munuaisten toiminta ja raskaus) ja muista tekijöistä, kuten paikallisista toimintaperiaatteista ja käytännöistä, kustannustehokkuudesta ja resurssien saatavuudesta .
Perinteisesti ensilinjan tutkimuksiin on kuulunut tavanomainen röntgenkuvaus, munuaisten ultraäänitutkimus (UÄ) ja/tai laskimonsisäinen pyelogrammi (IVP) yhdistettynä virtsankarkailuun. Jälkimmäinen on tärkeää, koska monet vuotavat virtsateiden vauriot syntyvät virtsarakon alueella, eikä kuvantamismenetelmien ole vielä todistettu olevan yhtä herkkiä kuin kystoskopia useimpien niistä diagnosoinnissa .
Toisen linjan tutkimuksiin ovat kuuluneet monidetectorinen tietokonetomografiaurografia (MDCTU) ja magneettiresonanssiurografia (MRU), jotka tehdään usein vain, jos ensimmäisen linjan testeissä havaitaan poikkeavuuksia.
IRCUS on suositellut, että potilailla, joilla on merkittävää hematuriaa, tehdään modifioitu tietokonetomografiaurografia (CTU) tai IVP, johon liittyy samanaikainen munuaistutkimus. Munuaistietokonetomografiaa ei tarvita laskimonsisäisessä urografiassa (IVU), jos samanaikainen munuaisten US tehdään. Tämä lähestymistapa vähentää altistumista ionisoivalle säteilylle .
Suositellessaan kuvantamista VH:n arvioimiseksi Cowan oli ehdottanut, että käytettävän kuvantamismenetelmän tyyppi perustuisi riskipisteytykseen siten, että potilaille, jotka ovat >40-vuotiaita, tehtäisiin tietokonetomografia, kun taas potilaille, jotka ovat <40-vuotiaita, tehtäisiin ensimmäisenä kuvantamismenetelmänä ultraääni . European Society of Urogenital Radiology (ESUR) on ehdottanut, että matalan riskin potilaiden tutkiminen edellyttää ultraäänitutkimusta ja kystoskopiaa ja korkean riskin potilaiden tutkiminen edellyttää CTU:ta ja kystoskopiaa munuaisten ja virtsateiden perusteellista kuvantamista varten .
Virtsan sytologia
Virtsan sytologia, vaikka se on kiistanalainen, on välttämätön ylempien virtsateiden uroteelisolusyövän (UUT-UCC) arvioinnissa, ja Euroopan urologiyhdistyksen (EAU) ohjeissa suositellaan, että virtsan sytologia olisi suoritettava osana vakiodiagnostiikkaa . Virtsan sytologian herkkyys on 25 %, spesifisyys 91 %, positiivinen ennustearvo korkea mutta negatiivinen ennustearvo matala.
Virtsan sytologian väärien negatiivisten tulosten osuus pahanlaatuisen kasvaimen havaitsemisessa on kuitenkin korkea, eikä negatiivinen sytologia voi koskaan täysin sulkea pois virtsarakon kasvaimen esiintymistä, vaan kystoskopia on perusteltu kaikissa tapauksissa.
Lukuisia kaupallisesti saatavilla olevia virtsasta saatavia virtsan biomarkkereita mittaavia testejä ovat muun muassa BTA TRAK, ImmunoCyt/uCyt+, CxBladder, Nuclear Matrix Protein 22 (NMP-22) ja UroVysion (FISH), vaikkakin näillä testeillä saattaa jäädä havaitsematta merkittävä osa potilaista, joilla on virtsarakon syöpä, etenkin kun sen tarkkuus on huono matalan asteen kasvainten osalta . Näistä syistä ei päästy yhteisymmärrykseen virtsan sytologian ja/tai virtsarakon kasvainmerkkien merkityksestä hematuriapotilaiden arvioinnissa .
Alustava kuvantaminen matalan riskin potilailla
ESUR oli ehdottanut, että matalan riskin potilaiden tutkimiseen tarvitaan US ja kystoskopia ja korkean riskin potilaiden tutkimiseen tarvitaan CTU ja kystoskopia munuaisten ja virtsateiden perusteellista kuvantamista varten . USA:n herkkyys ei kuitenkaan riitä poistamaan kystoskopian tarvetta, koska sen herkkyys ei riitä havaitsemaan pieniä virtsarakon kasvaimia, erityisesti halkaisijaltaan alle 0,5 cm:n kasvaimia.
Ultraäänitutkimus (US) on tärkeä hematurian alkuvaiheen arvioinnissa, ja sen lisäksi, että sitä on helposti saatavilla ja se on edullinen, se ei aiheuta altistumista ionisoivalle säteilylle eikä se ole erityisen käyttökelpoinen säteilylle herkissä väestöryhmissä, kuten lapsissa ja raskaana olevissa tai hedelmällisessä iässä olevissa naisissa. Ultraääni mahdollistaa myös rajoittamattoman määrän kuvaustasoja, mikä mahdollistaa munuaisten ja virtsarakon hyvän visualisoinnin. Lisäksi Doppler-tutkimukset voivat antaa lisätietoa massojen verisuonistosta (kuva 2A, 2B).
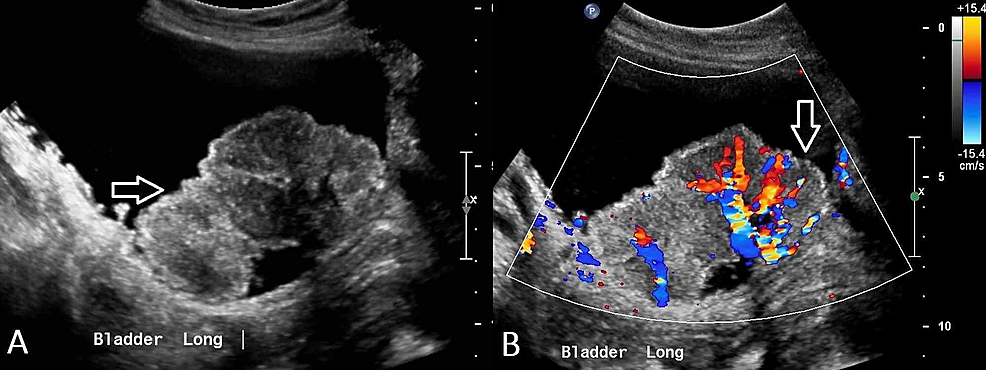
Kuva2:Transitional-cell-carcinoma-of-the-bladder-(US)
(A) Lantion ultraäänitutkimuksessa nähdään epäsäännöllinen, heterogeeninen virtsarakon sisällä sijaitseva epäsäännöllinen, heterogeeninen ja sen läheisyydessä näkyvät useat pienemmät polypoidaaliset leesiot, mikä viittaa virtsarakon syöpään. (B) Tämän massan sisällä osoitetaan verisuonitusta.
UUT-kasvainten toteamisessa US:lla on vaihteleva herkkyys uroteelikarsinoomien havaitsemisessa, ja sen herkkyys on kohtalainen (82 %) munuaissolusyövän havaitsemisessa ja heikko herkkyys (12 %) virtsajohtimen uroteelikarsinooman havaitsemisessa . Verrattaessa IVP:hen UUT:n poikkeavuuksien havaitsemisessa hematuriapotilailla US on kuitenkin herkempi munuais- ja virtsarakon kasvainten havaitsemisessa, sillä sen herkkyys on suurempi (96 % vs. 25 %) ja negatiivinen ennustearvo suurempi (98 % vs. 91 %).
Lisäksi US:lla voidaan havaita myös hydronefroosi ja/tai hydroureteri, jotka voivat olla seurausta rakkokasvaimista, jotka tukkivat virtsarakon- ja virtsankarkaisijan liittymäkohdan (kuva 3). Verrattuna poikkileikkauskuvantamiseen, kuten MDCTU- tai MRU-kuvaukseen, US:n herkkyys virtsateiden poikkeavuuksien havaitsemisessa on kuitenkin alhaisempi.
Ultraäänitutkimuksella voidaan kuitenkin erinomaisesti määrittää, onko massa kystinen vai ei, ja onko kystinen leesio pelkkä kysta vai minimaalisesti komplisoitunut tai komplisoitunut. Vauriot, jotka eivät ole yksinkertaisia kystia, vaativat lisätutkimuksia CT:llä tai MRI:llä. Kontrastia vahvistava ultraäänitutkimus (CEUS) on lupaava vaihtoehto munuaiskasvainten alkututkimuksessa. CEUS:n raportoitu suorituskyky epäiltyjen kiinteiden tai monimutkaisten kystisten massojen arvioinnissa viittaa siihen, että CEUS:llä on samanlainen arvo kuin CT:llä. CEUS:n etuina ovat nefrotoksisuuden puuttuminen, ionisoivan säteilyn puuttuminen ja kyky arvioida paksuuntumiskuvio reaaliajassa – ja tämä voidaan tehdä potilaan ensimmäisen US-käynnin yhteydessä. CEUS:n paikkaa diagnostisessa algoritmissa on kuitenkin vielä selvitettävä.
Näin ollen USA:n käyttäminen ensisijaisena kuvantamismenetelmänä hematurian arvioinnissa vaikuttaa perustellulta. Koska pelkkä ultraäänitutkimus saattaa mahdollisesti jättää huomaamatta virtsanjohtimen ja uroteelin vauriot, lisäarviointi kystoskopialla on tarpeen, ja retrogradinen pyelo-ureterografia on hyödyllinen lisä (kuva 3) .
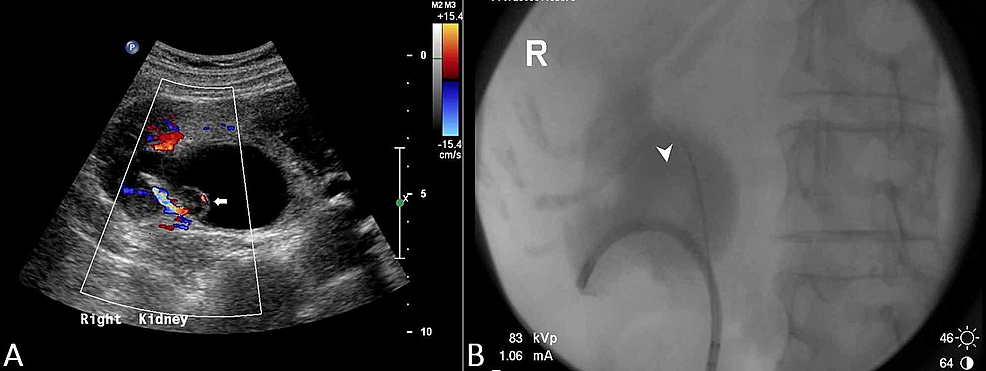
Kuva3:Munuaisten siirtymäsolusyöpä (US ja RPUG)
(A) Lantion ultraäänitutkimus osoittaa diffuusisti paksuuntuneen proksimaalisen oikean virtsanjohtimen, jossa on oikean munuaisaltaan sisällä näkyvä papillaarinen leesio (nuoli) ja siitä johtuva oikea hydronefroosi. (B) Tämä vastaa retrogradisen pyelo-ureterogrammin (RPUG) löydöksiä (nuolenkärki), jotka viittaavat tukkeutuvaan oikean ylemmän virtsateiden siirtymäsolusyöpään.
Riskipotilaiden alkukuvantaminen
CT-urografia
CT-urografia (kutsutaan myös CT-IVP:ksi, vaikkakin CTU on suositeltavampi termi) päihittää US:n, IVU:n, ja röntgenkuvausta munuaisparenkyymin massojen ja virtsateiden kivien arvioinnissa, ja niiden herkkyys ja spesifisyys ylempien uroteelien pahanlaatuisten kasvainten suhteen on 67-100 % ja 93-99 % .
Optimaalinen diagnostinen strategia korkean riskin potilaiden tutkimiseksi sen jälkeen, kun virtsatietulehdus on suljettu pois, on yhdistetty strategia, jossa käytetään CTU:ta ja joustavaa kystoskopiaa . Potilaat, joilla on CTU:lla virtsarakon syöpään viittaavia vaurioita, olisi ohjattava suoraan jäykkään kystoskopiaan ja vältettävä siten joustavaa kystoskopiaa, jolloin joustavien kystoskopioiden määrä vähenee 17 % .
Kaikissa muissa potilasryhmissä, mukaan lukien nuoremmat potilaat ja potilaat, joilla on enemmän hyvänlaatuisia indikaatioita ja alhaisemmat syövän todennäköisyydet ennen testiä, US on ensisijainen kuvantamismenetelmä . CT-urografian tutkimustekniikan muutoksia, jotka koostuvat rajoitetuista pöytäkirjoista ja skannausvaiheiden yhdistelmistä, voitaisiin käyttää vaihtoehtoisesti tai täydentävästi muiden kuvantamistutkimusten kanssa .
Tutkimusprotokollaan olisi sisällyttävä: ei-kontrastitutkimus, nefrografinen (90-100 sekuntia kontrastin antamisen jälkeen) ja erittymisvaihe (tai pyelografinen) (5-15 minuuttia kontrastin antamisen jälkeen) . Kortiko-medullaarinen vaihe on hyödyllinen tietyissä tapauksissa, esim. jos epäillään pseudoaneurysmaa tai pseudotuumoria. Rutiininomainen otto tämän vaiheen aikana ei välttämättä ole perusteltua. Kontrastittomat kuvat ovat hyödyllisiä munuaiskivien havaitsemiseksi. Nefrografiavaiheella on suurin herkkyys munuaismassojen havaitsemisessa, ja korrelaatio vahvistamattomien kuvien kanssa on tarpeen, jotta voidaan osoittaa yksiselitteinen vahvistuminen. Pyelografista/eritteistä vaihetta käytetään keräysjärjestelmän, virtsanjohtimien ja virtsarakon arviointiin, ja virtsanjohtimien laajentamistekniikoiden, kuten kompression, laskimonsisäisen suolaliuosboluksen ja diureettien, käyttö tuottaa vaihtelevia tuloksia. CT-urografialla voidaan havaita myös virtsateiden ulkopuolinen sairaus.
Uroteelikasvaimiin verrattuna monet potilaat, joilla on munuaisten pahanlaatuinen kasvain, pysyvät oireettomina taudin myöhäisvaiheeseen asti, koska valtaosa munuaissyövistä on pieniä ja ne havaitaan satunnaisesti. Lisäksi munuaiskasvaimet tunkeutuvat harvoin keräysjärjestelmään. Näin ollen munuaissolusyövän (RCC) klassinen kolmikko, joka koostuu kylkikivusta, hematuriasta ja palpoitavasta vatsan alueen munuaismassasta, esiintyy korkeintaan 6-9 prosentilla potilaista, ja kun se esiintyy, se viittaa vahvasti paikallisesti pitkälle edenneeseen tautiin ja huonoon ennusteeseen. Tässä yhteydessä suositellaan CT- ja MRI-kuvausta, ja niitä pidetään tasavertaisina vaiheistuksen ja diagnoosin kannalta (kuvat 4 ja 5). Vertailututkimuksia CT:n ja suurikenttäisen magneettikuvauksen välillä odotetaan kuitenkin vielä. Tällä välin magneettikuvausta voidaan käyttää valikoiduissa tapauksissa ongelmanratkaisuun. Diffuusiopainotteisesta magneettikuvauksesta (DWI) voi myös olla hyötyä leesioiden havaitsemisessa ja kuvaamisessa, mutta systemaattiset katsaukset osoittavat vain kohtalaista tarkkuutta .
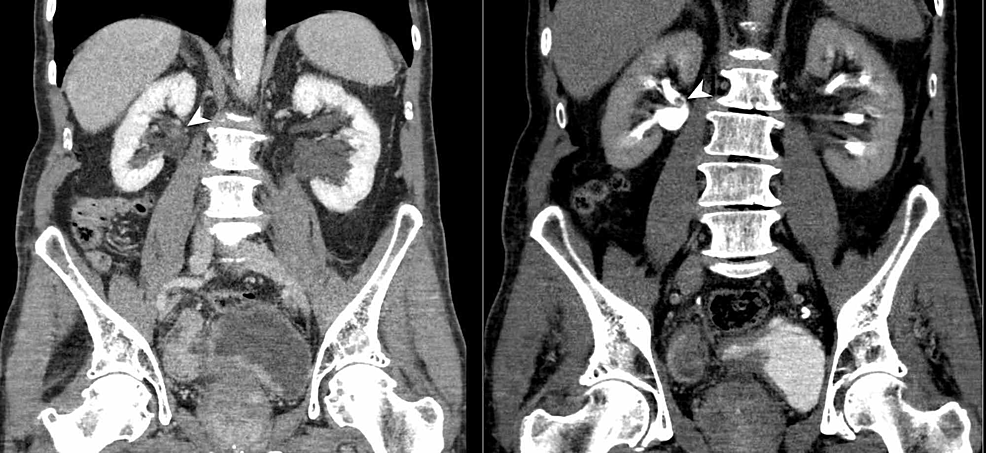
Kuva4:Virtsarakon ja munuaisten TCC-(CTU)
CT-urografiassa (koronaalinen reformaatti) näkyy epäsäännöllinen virtsarakon seinämän paksuuntuminen sekä lisäksi oikean munuaisaltaan takapuolella sessiili polypoidaalinen täyttövaurio (nuolenkärjet). Löydökset viittaavat multifokaaliseen virtsateiden siirtymäsolusyöpään (TCC).
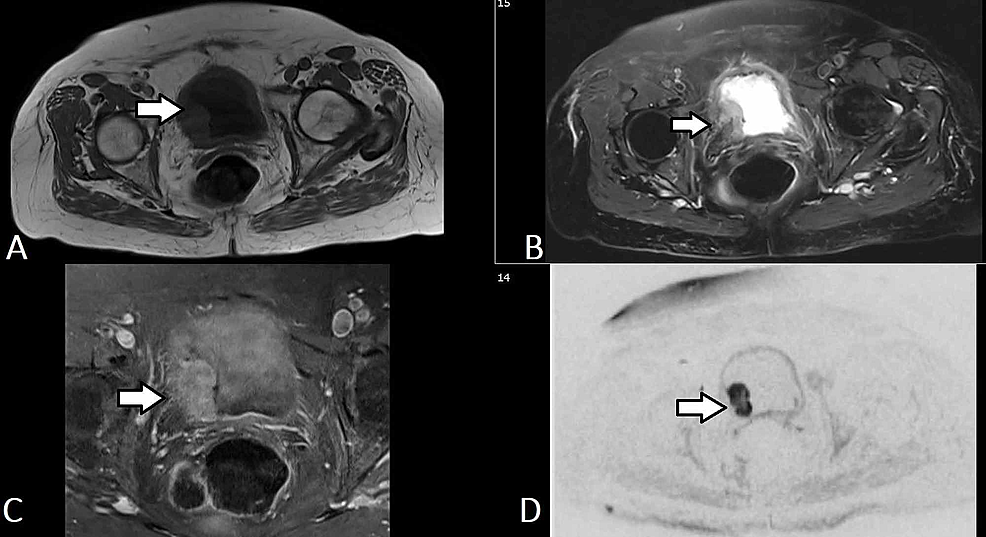
Kuva5:Virtsarakon TCC (MRI)
(A-D) Saman potilaan valikoidut aksiaaliset MR-urografiakuvat osoittavat virtsarakon oikeasta lateraaliseinämästä lähtevän liuskaisen massan (nuoli), joka ulottuu trigoniin ja tunkeutuu virtsarakon seinämään käsittäen ulomman kerroksen ulottumatta perivesikaaliseen rasvaan. Massan T1-signaalin intensiteetti on matala ja T2-signaalin intensiteetti korkea. Massassa on suhteellisen homogeeninen, diffuusi kontrastin voimistuminen ja selvä diffuusion rajoitus (b50/400/800). Löydösten yhdistelmä kuvastaa virtsarakon kasvainta, joka todennäköisesti luokitellaan T2b No Mx:ksi.
TCC: Transitional cell carcinoma
Munuaisten kystisten massojen Bosniak-luokitus perustuu kontrastilla tehostetun tietokonetomografian kuvantamisominaisuuksiin, ja siitä on apua pahanlaatuisuusriskin ennakoinnissa ja hoidon ohjeistuksessa. Bosniakin 1, 2, 2F, 3 ja 4 kystisten leesioiden pahanlaatuisuuden riski on 0 %, 0 %, 25 %, 54 % ja 100 %.
CT-urografia voi olla tehokas myös virtsarakon kasvainten diagnostiikassa. Tulokset voivat kuitenkin vaihdella riippuen tutkittavasta erityispopulaatiosta. Korkean riskin ryhmässä yksiselitteiset CTU-tulokset olivat 93 % herkkiä ja 99 % spesifisiä virtsarakon syövän havaitsemiseksi, ja niiden negatiivinen ennustearvo (NPV) oli 95 %. CTU:n korkea NPV saattaa välttää kystoskopian näillä valikoiduilla potilailla, vaikka kystoskopia onkin edelleen kultainen standardi alempien virtsateiden kasvainten, myös virtsarakon uroteelikasvainten, havaitsemisessa, sillä IVP:n tai MDCTU:n herkkyys ei ole johdonmukaisesti riittävän suuri sulkemaan pois virtsarakon limakalvon poikkeavuuksia.
Säteilyannokset aiheuttavat huolta MDCTU:n yhteydessä, ja niitä voidaan pienentää rajoittamalla kuvantamisvaiheiden määrää käyttämällä kaksoisenergiatietokonetomografiaa (DECT) tai split-bolus-tekniikkaa . Lisäksi (25) tehostamattoman kuvauksen poisjättäminen vähentää säteilyaltistusta lähes 50 % .
DECT tarjoaa tietoa siitä, miten aineet käyttäytyvät eri energioilla, mahdollisuuden luoda virtuaalisia tehostamattomia tietokokonaisuuksia ja parantaa jodia sisältävien aineiden havaitsemista matalaenergisissä kuvissa . Muita DECT:n etuja ovat hyvä ajallinen ja alueellinen rekisteröinti ja hyvä spektrinen erottelu korkea- ja matalaenergisten kuvien välillä, jotka on helppo tasata annoksen ja kohinan suhteen . Prospektiivinen tutkimus osoitti, että yksivaiheinen DECT-urografia, johon liittyy synkroninen nefrografiavaiheen ja erittävän vaiheen tehostaminen, on tarkka ”all-in-one”-lähestymistapa, jossa säteilyannoksen säästö on jopa 45 % verrattuna tavanomaiseen kaksivaiheiseen protokollaan, jossa on hyvä peittävyys 86 .9 %:ssa tapauksista ja erinomaiset tai hyvät virtuaaliset tehostamattomat kuvat (VUE) 83,3 %:ssa tapauksista .
Toisaalta split-bolus MDCTU tarjoaa vähintään 50 %:n peittävyyden suurimmassa osassa UUT:n segmenteistä suurella herkkyydellä (88.9-100 %), spesifisyys (99-99,5 %) ja tarkkuus (98,5-99,5 %) ylempien virtsateiden kasvainten havaitsemisessa (kuva 6) .
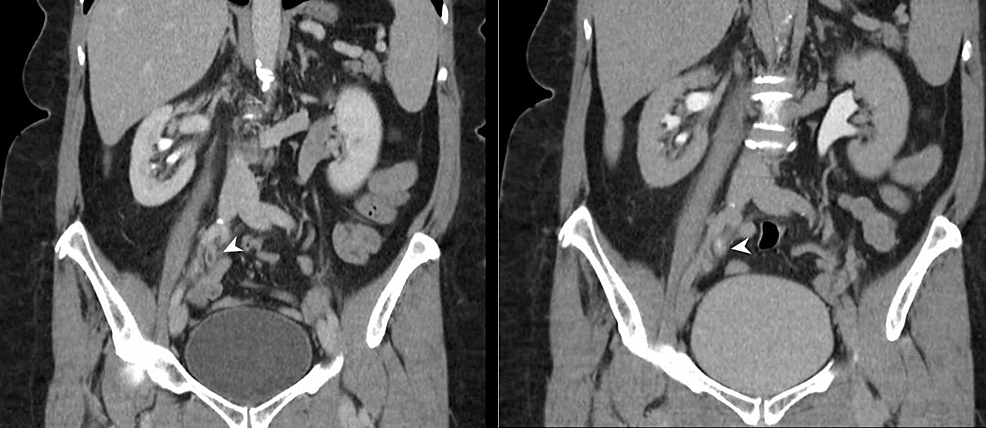
Kuva6:Virtsanjohtimen TCC (CTU)
CT-urografiassa (koronaaliset uudismuodosteet) näkyy 4 cm:n pituinen uroteelin ympärysmittainen paksuuntunut segmentti virtsanjohtimen keski- ja distaalisen oikeanpuoleisen osan yhtymäkohdassa (nuolenkärjet), jossa on epänormaali virtsanjohtimen tehostuminen. Oikean keräysjärjestelmän sekundaarinen tukkeutuminen ja siirtymäkohta on havaittu epänormaalin uroteelin paksuuntumisen kohdalla, mikä on erittäin epäilyttävää oikeanpuoleisen uroteelin TCC:n kannalta.
TCC: Siirtymäsolusyöpä
Magneettiresonanssiurografia
Magneettiresonanssikuvantaminen on hyödyllistä munuaisten, virtsarakon ja eturauhasen pahanlaatuisten kasvainten diagnosoinnissa ja porrastuksessa sekä munuaisten toiminnan arvioinnissa. Se on vaihtoehtoinen kuvantamistekniikka säteilylle herkälle väestölle, kuten lapsille ja raskaana oleville naisille, niille, jotka tarvitsevat toistuvia virtsateiden tutkimuksia, ja niille, joilla on vasta-aihe jodipitoisten kontrastiaineiden käytölle.
Kokonaisvaltaista magneettiresonanssikuvantamisprotokollaa voidaan käyttää munuaisten ja virtsateiden keräysjärjestelmän kaikkien osien kuvantamiseen yhdellä kuvantamiskerralla. MR-urografia suoritetaan kahdella päämenetelmällä: staattisen nesteen urografia ultranopeilla T2-painotetuilla sekvensseillä, jotka ovat samanlaisia kuin magneettiresonanssikolangiopankreatografiassa (MRCP) käytettävät sekvenssit, ja T1-painotetut sekvenssit erittävän urografian IV-gadolinium-kontrastin antamisen jälkeen .
Staattista nestemäistä MRU:ta suositaan erittävän MRU:n sijaan kuvantamisessa potilailla, joiden munuaisten toiminta on heikentynyt, raskaana olevilla potilailla ja potilailla, joilla on virtsanjohtimen tukos, erityisesti silloin, kun on olemassa kohtuullinen nefrogeenisen systeemisen fibroosin riski . Koska T2-painotteiset sekvenssit suoritetaan kuitenkin ilman suonensisäistä kontrastin antoa, virtsanjohtimen kuvantamisen optimoimiseksi tarvitaan usein kuvantamismuutoksia.
Virtsanjohtimen kuvantamista voidaan myös parantaa erityisesti erittävällä MRU:lla, kun virtsanjohtimeen annetaan suonensisäistä kontrastiainetta, keittosuolaliuosta ja diureettia kontrastin tasaisemman jakaantumisen aikaansaamiseksi . Vaikka todisteet osoittavat, että DWI osoittaa vain kohtalaista tarkkuutta munuaisten pahanlaatuisuuden ennustamisessa, sen suorituskykyä itsenäisenä testinä ei ole vielä testattu . DWI:n lisääminen T1- ja T2-painotteiseen kuvantamiseen lisää herkkyyttä UUT-syövän tunnistamisessa, ja tarkkailijoiden välinen yksimielisyys on erinomainen. Erityisesti T2WI+DWI-yhdistelmä osoittaa 92-98 prosentin herkkyyttä virtsarakon kasvainten diagnosoinnissa (kuva 5).
MRU:n haittapuolia ovat sen kustannukset, saatavuus, pidempi hankinta-aika, liikeartefaktien aiheuttama kuvan huononeminen, pienempi spatiaalinen erottelukyky ja pienempi diagnostinen varmuus uroteelin pahanlaatuisen kasvaimen havaitsemisessa CTU:hun verrattuna. Nopeampien sekvenssien kehittämisen ja 3-T magneettikuvausprotokollien optimoinnin odotetaan kuitenkin ratkaisevan nämä ongelmat.
Kystoskopia
Kystoskopia on edelleen valintamenetelmä virtsarakon arvioinnissa, eikä sitä pitäisi korvata millään erittävällä kuvantamistekniikalla . Tuoreissa EAU:n ohjeissa suositellaan myös, että kystoskopia olisi suoritettava samanaikaisen virtsarakon kasvaimen poissulkemiseksi (kuva 7), kun UUT-syöpä on diagnosoitu, erityisesti kun kirjoittajat ovat osoittaneet huomattavia vääriä positiivisia ja vääriä negatiivisia tuloksia CTU:lla ja MRU:lla virtsarakon kasvainten havaitsemisessa verrattuna histopatologiaan potilailla, joilla on näkyvää hematuriaa . Kystoskopia olisi tehtävä lähes kaikille potilaille, joilla on kivuton näkyvä hematuria .
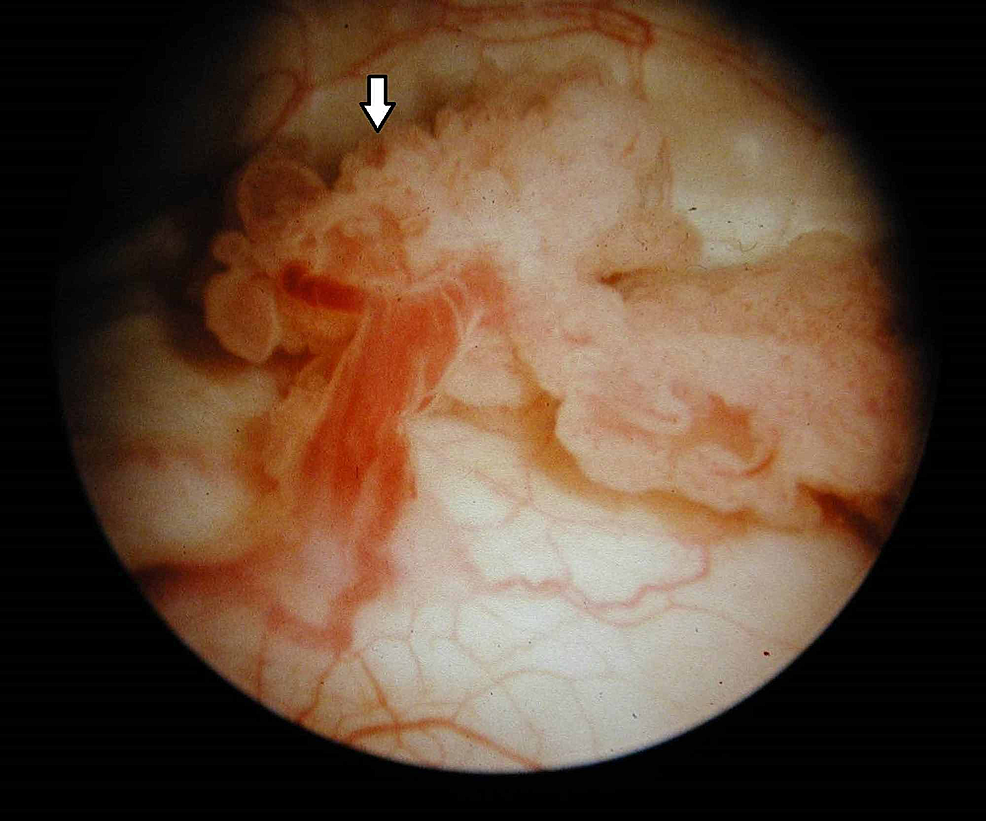
Kuva7:Virtsarakon kasvain (kystoskopia)
Kystoskopiassa havaitaan eksofyyttinen, kukkakaalimainen kasvain, jossa on hentoja lonkeroita ja virtsarakon pahanlaatuiseen kasvaimeen sopivia haavauma-alueita (nuoli).
Joustava kystoskopia on yksinkertainen, nopea ja turvallinen toimenpide, joka tehdään paikallispuudutuksessa päiväkirurgisena toimenpiteenä, joka antaa luotettavan varmuuden ja mahdollistaa operatiivisen potilaan diagnoosin ja leikkaukseen valmistautumisen samalla käynnillä .
Jäykkä kystoskopia sen sijaan tehdään yleis- tai selkäydinpuudutuksessa erityisesti silloin, kun odotetaan monimutkaisempia lisätoimenpiteitä. Retrogradinen pyelo-ureterografia (RPUG) voidaan tehdä jäykän kystoskopian yhteydessä ylempien traktien kuvaamiseksi, jos CTU:ta ei ole jo tehty .
Muut kuvantamistutkimukset
Retrogradinen pyelo-ureterografia
CT-urogrammilla on todettu olevan RPUG:ää parempi diagnostinen tarkkuus uroteelimuutosten havaitsemisessa . Siksi on perusteltua, että CTU:ta käytetään ennen RP:tä, koska se on yksi ainoa, ei-invasiivinen ja kattava testi, joka mahdollistaa samanaikaisen diagnoosin ja/tai staging-tutkimuksen.
Retrogradista pyelografiaa voidaan edelleen käyttää toisen linjan tutkimuksena, jotta voidaan tarkemmin luonnehtia täyttymishäiriöitä, jotka on havaittu muilla menetelmillä, ei-diagnostisella CTU:lla tai potilailla, joilla on munuaisten vajaatoiminta, tai potilailla, joilla on kontrastialtistemuotoisen lääkeaineen aiheuttama allergia. Retrogradisella pyelo-ureterografialla voidaan näyttää vain virtsanjohtimen luumen, eikä sillä voida suoraan kuvata ulkoisia poikkeavuuksia (kuva 3).
Munuaisten, virtsanjohtimien ja virtsarakon röntgenkuvaus (Plain X-ray KUB)
Plain X-ray KUB:llä on tällä hetkellä vain vähän arvoa tutkittaessa potilaita, joilla on kivutonta hematuriaa, ja sitä ei käytetä ensimmäisenä kuvantamismenetelmänä .
Excretorinen urografia/Intravenoosinen urografia (IVU)
Intravenoosinen urografia on hyvä valinta uroteelisairauksien ja intraluminaalisten sairauksien arvioinnissa, mutta se ei ole riittävän herkkä havaitsemaan munuaismassoja, jotka ovat kooltaan <2-3 cm, ja se on nyt korvattu CTU:lla UUT:n kuvantamisessa . Suuren riskin potilaiden hematurian tutkimista pelkällä IVU:lla ei enää suositella .
Sen tärkein etu on, että IVU kuvaa koko UUT:n korkealla spatiaalisella resoluutiolla ja antaa myös rakenteellista tietoa sekä rajoitetusti toiminnallista tietoa. Se on usein kustannustehokkain tutkimus monissa keskuksissa .
InvU:n haittapuolia ovat kuitenkin pitkä kuvausaika, mahdolliset vaaralliset kontrastireaktiot, suolen valmistelua vaativa valmistelu ja altistuminen huomattavalle säteilykuormitukselle. Sen suurin puute on sen suhteellinen epätarkkuus, ja se on pian vanhentunut.
Kliininen seuranta
Riski on, että 1-3 %:lla potilaista, joiden tutkimus on negatiivinen, kehittyy pahanlaatuinen kasvain kolmen vuoden kuluessa, jos se jätetään hoitamatta . American Urological Associationin (AUA) parhaita käytäntöjä käsittelevä paneeli suosittelee, että perusterveydenhuollon lääkärit tarkistavat VH:n, uusien virtsaamisoireiden ja positiivisen sytologian kuuden kuukauden välein kolmen vuoden ajan, ja jos löydökset ovat siihen mennessä johdonmukaisesti negatiivisia, seuranta voidaan lopettaa . BAUS suosittelee, että urologian erikoislääkäriin ohjataan uudelleen, jos perusterveydenhuollon seurannan aikana ilmenee VH:ta tai oireista ei-näkyvää hematuriaa (NVH), jonka kestoa ei ole selkeästi määritelty . Best Practice Advocacy Centre New Zealand on suositellut vuosittaista seurantaa nefrologisten syiden osalta virtsanäytteen, verenpaineen, eGFR:n ja virtsan albumiini-kreatiniini-suhteen/proteiini-kreatiniini-suhteen (ACR/PCR) avulla, kun hematuria jatkuu, ja vuosittain kahden vuoden ajan urologisten syiden osalta virtsanäytteen, eGFR:n, virtsan ACR:n/PCR:n ja sytologian avulla. Tämä aloite mahdollistaa perusterveydenhuollon seurannan, jonka avulla voidaan rauhoittaa potilaita, jotka ovat huolissaan jatkuvasta hematuriasta, joka voi olla ajoittaista mutta jatkuvaa negatiivisesta tutkimuksesta huolimatta. Taulukkoon 2 on koottu nefrologian ja urologian lähetteen indikaatiot .
Nefrologian lähete
Seerumin kreatiniinin nousu ≥0.3 mg/dl (>26,4 µmol/l), seerumin kreatiniinin prosentuaalinen nousu ≥50 % (1,5-kertainen lähtötasosta) tai virtsanerityksen väheneminen (dokumentoitu oliguria alle 0.5 ml/kg tunnissa yli kuuden tunnin ajan
Merkittävä proteinuria (ACR ≥30 mg/mmol tai PCR ≥50 mg/mmol) hematurian lisäksi herättää epäilyn sisäisestä munuaistaudista
Glomerulaarinen hematuria, johon liittyy makroalbuminuria
Isoloitunut hematuria (ts, ilman merkittävää proteinuriaa), johon liittyy verenpainetauti <40-vuotiailla
Näkyvä hematuria samanaikaisesti samanaikaisen (yleensä ylähengitysteiden) infektion kanssa
Urologin lähete
Näkyvä hematuria kaikilla potilailla (iästä riippumatta)
Potilaat, joilla on mikä tahansa oireileva muu kuinnäkyvä hematuria ilman virtsatietulehdusta tai muita ohimeneviä syitä (iästä riippumatta)
Potilaat, joilla on oireeton ei-näkyvä hematuria
Kaikki potilaat, joilla on oireeton ei-näkyvä hematuria ja muita riskitekijöitä
Taulukko2: Lähettämisindikaatiot
† Dysmorfisten punasolujen, proteinurian, solukipsin ja/tai munuaisten vajaatoiminnan esiintyminen tai muu munuaisparenkyymin sairauteen viittaava kliininen indikaattori oikeuttaa samanaikaiseen nefrologiseen tutkimukseen, mutta ei sulje pois urologisen arvioinnin tarvetta.
‡ Naiset, joilla on oireeton ei-näkyvä hematuria ja jotka ovat <40-vuotiaita, eivät tarvitse urologista lähetettä.
