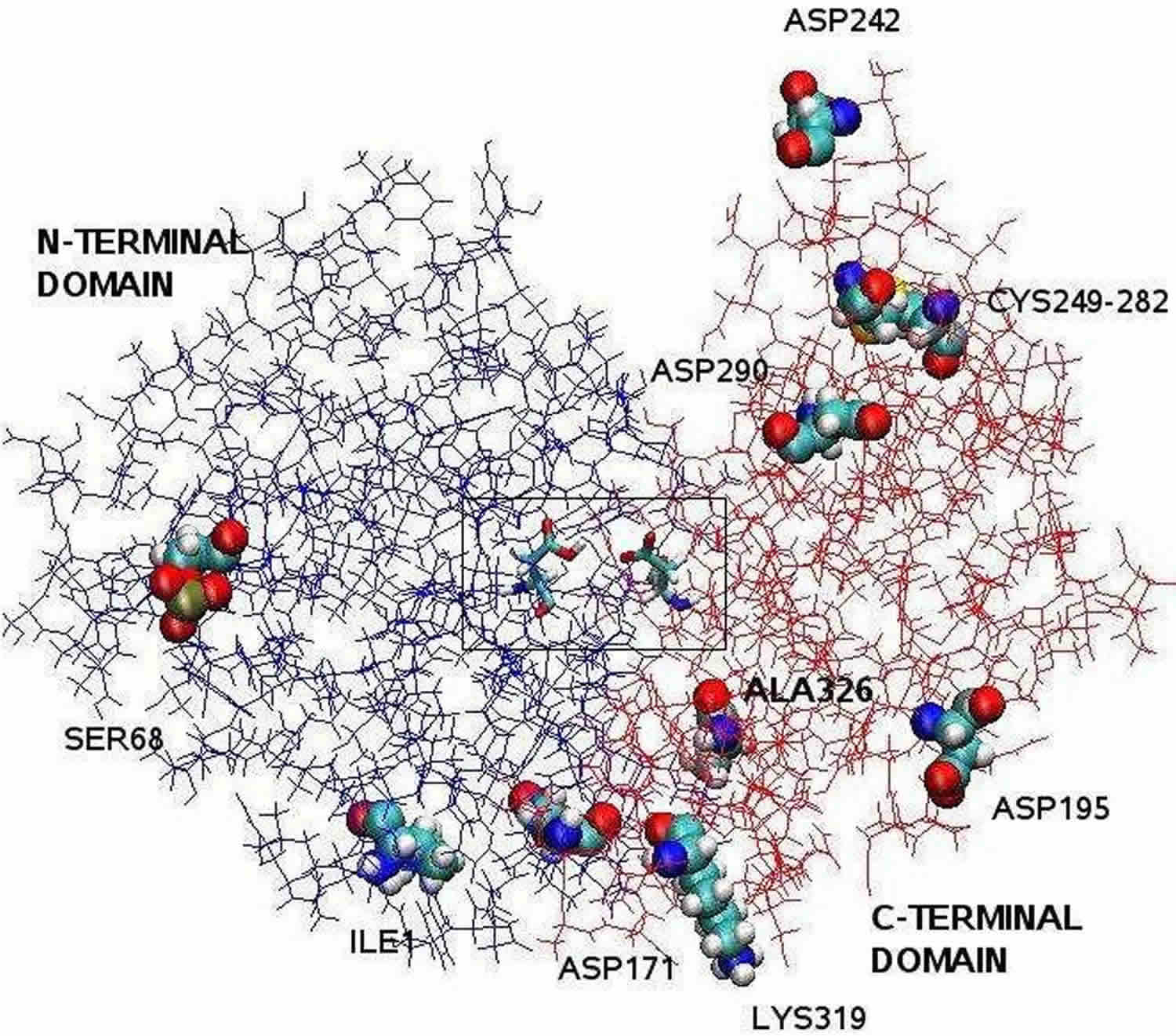
 Alaviite: Röntgenkristallografian avulla selvitetty pepsiini-entsyymin rakenne on bilobaalinen, ja sen kahden lohkon välissä on suuri aktiivisen alueen rako. Jäännökset 1-175 muodostavat N-terminaalisen domainin, kun taas jäännökset 176-326 muodostavat C-terminaalisen domainin. Kaksi aspartaattia raon keskellä, Asp32 ja Asp215, toimivat katalyyttisina jäännöksinä. Asp32:n ja Asp215:n muodostama katalyyttinen kohta sijaitsee halkion keskellä. Proteiinin pinnalla sijaitsevat varatut aminohappojäännökset ovat Asp171, Asp195, Asp242, Asp290, Lys319, Ile1 (N-terminaalinen), Ala326 (C-terminaalinen). Fosforyloitu Ser68 on täysin alttiina liuottimelle, ja Cys 249:n ja Cys 282:n välinen disulfidisilta sijaitsee proteiinin pinnalla.
Alaviite: Röntgenkristallografian avulla selvitetty pepsiini-entsyymin rakenne on bilobaalinen, ja sen kahden lohkon välissä on suuri aktiivisen alueen rako. Jäännökset 1-175 muodostavat N-terminaalisen domainin, kun taas jäännökset 176-326 muodostavat C-terminaalisen domainin. Kaksi aspartaattia raon keskellä, Asp32 ja Asp215, toimivat katalyyttisina jäännöksinä. Asp32:n ja Asp215:n muodostama katalyyttinen kohta sijaitsee halkion keskellä. Proteiinin pinnalla sijaitsevat varatut aminohappojäännökset ovat Asp171, Asp195, Asp242, Asp290, Lys319, Ile1 (N-terminaalinen), Ala326 (C-terminaalinen). Fosforyloitu Ser68 on täysin alttiina liuottimelle, ja Cys 249:n ja Cys 282:n välinen disulfidisilta sijaitsee proteiinin pinnalla.
Pepsiinillä on asparagiiniproteaasina hyvin matala pH-optimi. Kondjoyan, Daudin ja Santé-Lhoutellier 9) tutkivat myofibrillaaristen proteiinien sulavuutta ja havaitsivat pepsiinin aktiivisuuden olevan suurimmillaan pH:n ollessa noin 2. Pletschke, Naudé ja Oelofsen 10) tutkivat hemoglobiinin hydrolyysia sian ja strutsin pepsiinillä ja havaitsivat myös pepsiiniaktiivisuuden pH-optimin olevan 2,0. Kun pepsiini-entsyymi on aktivoitunut pH:lla <4,5, se denaturoituu helposti pH:n ollessa yli 7,0, mikä muodostaa pepsiinin ominaisuuksia määrittävät ominaisuudet 11).
Toisin kuin pH:n vaikutuksesta, ionivahvuuden vaikutuksesta entsyymiaktiivisuuteen keskustellaan harvemmin. Dalen ja Whiten 12) aiemmat työt osoittivat, että ionivahvuuden lisääminen vähentää selvästi immobilisoidun haiman ribonukleaasin reaktionopeutta, kun taas Butré, Wierenga ja Gruppen 13) tutkivat heraproteiini-isolaatin entsymaattista hydrolyysiä alkalaasin ja neutraasin toimesta ja havaitsivat myös, että läsnäolo 05M NaCl vähensi hydrolyysinopeutta.
Tunnetaan kaksi voimakasta luonnossa esiintyvää pepsiinin inhibiittoria: pepstatiini, Streptomycesistä peräisin oleva pentapeptidi, ja Ascariksesta peräisin oleva ainutlaatuinen proteiinipitoinen inhibiittori. Pepsiinillä on myös takaisinkytkentäinhibitio; proteiinin ruuansulatuksen tuote hidastaa reaktiota inhiboimalla pepsiiniä 14).
Missä pepsiiniä tuotetaan?
Pääsolut erittävät pepsiiniä inaktiivisena entsyymin esiasteena, jota kutsutaan pepsinogeeniksi. Kun pepsinogeeni joutuu kosketuksiin parietaalisolujen suolahapon kanssa, se hajoaa nopeasti muodostaen pepsiinin 15). Pepsiini aloittaa lähes kaikenlaisten ravintoproteiinien pilkkomisen polypeptideiksi. Tämä entsyymi on aktiivisimmillaan happamassa ympäristössä, jonka tarjoaa mahamehun suolahappo.
Kuva 2. Mahalaukun solut (mahalaukun rauhaset)
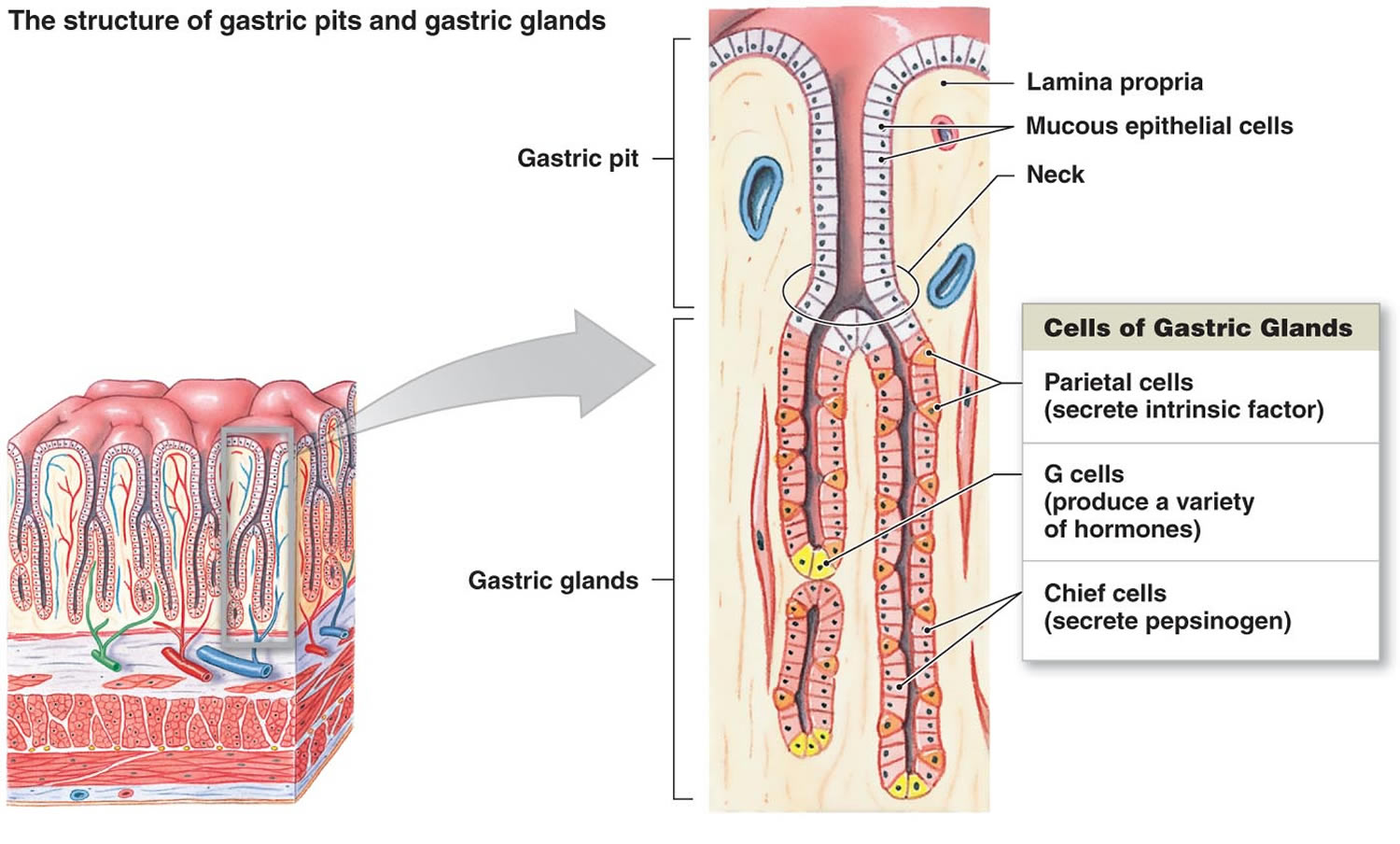 Alaviite: Mahalaukun limakalvo. Mahalaukun rauhasiin kuuluvat limakalvosolut, parietaalisolut ja pääsolut. Mahalaukun limakalvolla on mahalaukun kuoppia, jotka ovat mahalaukun rauhasten aukkoja.
Alaviite: Mahalaukun limakalvo. Mahalaukun rauhasiin kuuluvat limakalvosolut, parietaalisolut ja pääsolut. Mahalaukun limakalvolla on mahalaukun kuoppia, jotka ovat mahalaukun rauhasten aukkoja.
Mitä pepsiini tekee?
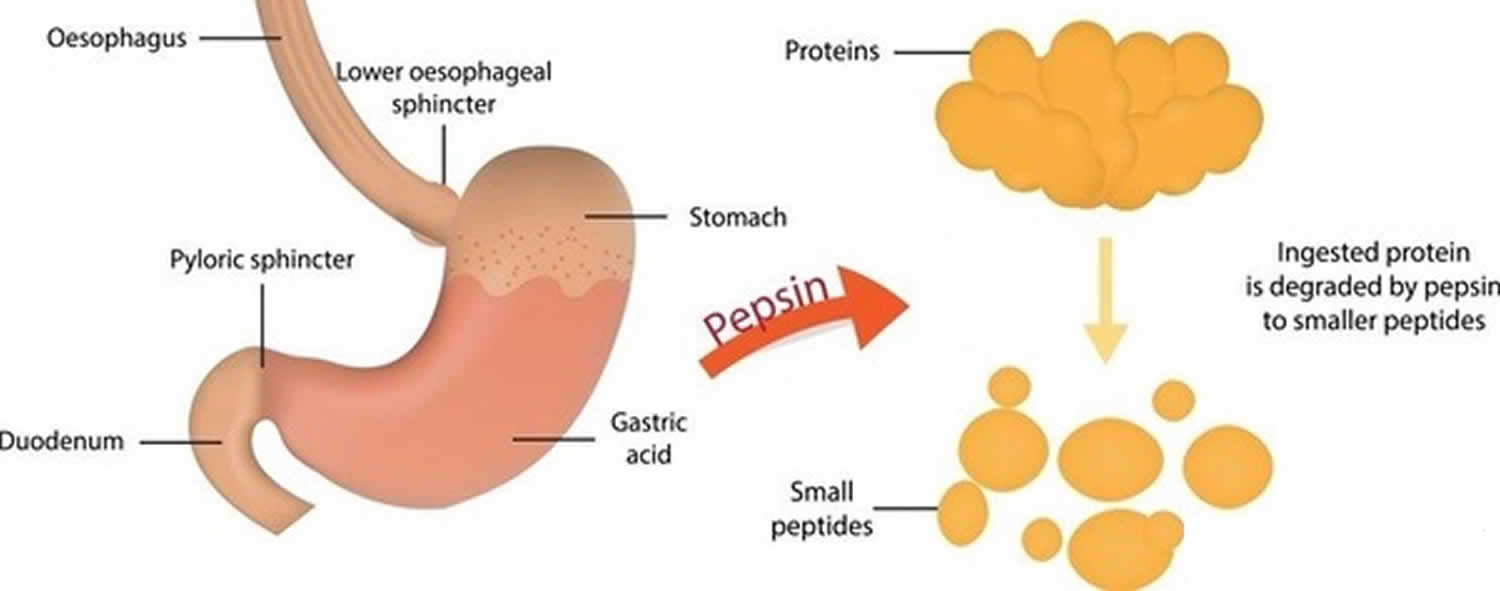
Pepsiini, joka muodostuu pepsinogeenistä (pepsiinin inaktiivisesta muodosta) suolahapon läsnä ollessa, pilkkoo lähes kaikenlaiset ravintoproteiinit polypeptideiksi (pienemmiksi proteiiniyhdisteiksi). Pepsiini pilkkoo proteiineja voimakkaassa mahahapossa. Pepsiini on optimoitu ruoan pilkkomiseen mahalaukun happamassa ympäristössä, ja se on ensimmäinen proteaasi, jonka ruoan proteiinit kohtaavat ruoansulatuskanavassa. Pepsiini on aktiivisimmillaan happamissa ympäristöissä 37 °C:n ja 42 °C:n välillä 16).
Pepsiinin spesifisyyteen (eli peptidisidosten pilkkomistodennäköisyyteen pepsiinin toimesta) vaikuttavat pääasiassa P1- ja P1′-asemassa olevat aminohappojäämät, kun taas myös muissa alapaikoissa olevilla aminohappojäännöksillä voi olla merkitystä. Yleisesti ottaen pepsiini halkaisee mieluiten fenyylialaniinin, leusiinin ja metioniinin jälkeen, kun taas histidiinin, lysiinin, proliinin ja arginiinin jälkeen se halkaisee harvoin 17). Aromaattiset jäännökset tyrosiini, tryptofaani ja fenyylialaniini ovat suosittuja asemassa P1′. Proliini on voimakkaasti epäsuotuisa P2-, P2′- ja P3′-asemassa, kun taas histidiini, lysiini ja arginiini ovat epäsuotuisia P3-asemassa. P4- ja P4′-asemilla on vain vähän vaikutusta 18).
Kuva 3. Pepsiinin toiminta
.
