![]()
Persoonat, jotka käyttävät apuvälineteknologiaa, eivät välttämättä pysty käyttämään tämän tiedoston tietoja täysimääräisesti. Jos tarvitset apua, lähetä sähköpostia osoitteeseen: [email protected]. Kirjoita sähköpostin otsikkoriville 508 Accommodation ja raportin otsikko.
![]() PDF
PDF
Rokotuskäytäntöjä käsittelevä neuvoa-antava komitea (ACIP) tarkastelee vuosittain suositeltua aikuisten immunisaatioaikataulua varmistaakseen, että aikataulu heijastaa nykyisiä suosituksia lisensoitujen rokotteiden käytöstä. Kesäkuussa 2005 ACIP hyväksyi aikuisten rokotusohjelman lokakuuksi 2005-syyskuuksi 2006. Myös American Academy of Family Physicians ja American College of Obstetricians and Gynecologists ovat hyväksyneet tämän aikataulun.
Muutokset lokakuun 2005-syyskuun 2006 aikataulussa
Vuosien 2005-2006 aikataulu eroaa edellisestä aikataulusta seuraavasti:
- Ikään perustuvassa aikataulussa (kuva 1) luetellut rokotteet näkyvät siten, että rutiinikäyttöön suositellut rokotteet voidaan erottaa niistä rokotteista, joita suositellaan sellaisille aikuisille, joilla on tietyt riski-indikaattorit (samalla tavalla kuin lapsuusiän immunisaatioaikataulussa). Tätä havainnollistetaan sekä värimaailmalla että katkoviivalla.
- Keltaiset palkit (”Kaikille tähän ryhmään kuuluville henkilöille”) ja vihreät palkit (”Henkilöille, joilta puuttuu rokotusta koskeva dokumentaatio tai näyttöä taudista”) aiemmasta aikataulusta on yhdistetty yhdeksi keltaiseksi palstaksi, jossa lukee nyt: ”Kaikille tähän ryhmään kuuluville henkilöille, jotka täyttävät ikää koskevat vaatimukset ja joilta puuttuu näyttöä immuniteetista (esim, joilla ei ole todisteita rokotuksesta tai joilla ei ole näyttöä aiemmasta tartunnasta).”
- Violetti palkki on muutettu muotoon ”Henkilöille, joilla on riski (esim. lääketieteelliset/altistumisindikaatiot)” muotoon ”Suositellaan, jos jokin muu riskitekijä on olemassa (esim. lääketieteellisten, ammatillisten, elämäntapaan liittyvien tai muiden indikaatioiden perusteella).”. Tuhkarokko-, sikotauti- ja vihurirokkorokotteen (MMR) ikäryhmäsarakkeisiin 50–64 vuotta ja >65 vuotta lisättiin violetti palkki.
- Sarake ”Diabetes, sydänsairaus, krooninen keuhkosairaus tai krooninen maksasairaus, mukaan lukien krooninen alkoholismi” on siirretty sarakkeeseen ”Synnynnäinen immuunipuutos, leukemia, lymfooma, yleistynyt pahanlaatuinen kasvain, hoito alkyloivilla aineilla, antimetaboliiteilla, aivo-selkäydinnesteen vuodot, säteily tai suuret määrät kortikosteroideja” lääketieteellisiä/muita indikaatioita koskevassa taulukossa (kuvio 2) niin, että MMR- ja suvunvihurirokkorokotteiden vasta-aiheet ovat nyt vierekkäin.
- Varicella-rokotetta koskeva rivi on siirretty ylöspäin molemmissa kuvioissa (ts, heti MMR-rokotteen jälkeen), koska rokotetta suositellaan nyt yleisesti tietyille ikäryhmille.
- Meningokokkirokote on lisätty lääketieteellisten/muiden indikaatioiden luetteloon (kuva 2). Alaviite on tarkistettu siten, että siihen on sisällytetty tätä rokotetta koskevat äskettäin julkaistut ACIP:n suositukset (1).
- Jäykkäkouristus- ja kurkkumätä-aiheinen alaviite (1) on muotoiltu uudelleen.
- Varicella-aiheinen alaviite (3) on muotoiltu uudelleen kesäkuussa 2005 hyväksyttyjen ACIP:n suositusten mukaisesti.
- Influenssan alaviitettä (#4) on tarkistettu siten, että siihen on lisätty uusin korkean riskin tila: neuromuskulaariset tilat, jotka heikentävät hengitystoimintaa (2).
- Kymmenes alaviite on lisätty koskien Haemophilus influenzae b -tyypin rokottamista väestöryhmille, joilla on korkea riski (esim, henkilöt, joilla on asplenia, leukemia ja ihmisen immuunikatovirusinfektio).
Aikuisten rokotusohjelma on saatavilla englanniksi ja espanjaksi osoitteessa http://www.cdc.gov/nip/recs/adult-schedule.htm. Yleistä tietoa aikuisten rokottamisesta, mukaan lukien HIV:tä ja muita immunosuppressiivisia sairauksia sairastavien henkilöiden rokottamista koskevat suositukset, on saatavissa osavaltioiden ja paikallisilta terveysviranomaisilta sekä kansallisesta rokotusohjelmasta osoitteessa http://www.cdc.gov/nip. Rokotustiedotteet ovat saatavilla osoitteessa http://www.cdc.gov/nip/publications/vis. ACIP:n lausuntoja kustakin suositellusta rokotteesta voi tarkastella, ladata ja tulostaa kansallisen rokotusohjelman verkkosivustolta osoitteesta http://www.cdc.gov/nip/publications/acip-list.htm. Ohjeet haittatapahtumien ilmoittamisesta rokotteiden haittavaikutusilmoitusjärjestelmään ovat saatavilla osoitteessa http://www.vaers.hhs.gov tai puhelimitse 800-822-7967.
- CDC. Meningokokkitautien ehkäisy ja torjunta: rokotuskäytäntöjä käsittelevän neuvoa-antavan komitean (ACIP) suositukset. MMWR 2005;54(No. RR-7).
- CDC. Influenssan ehkäisy ja torjunta: rokotuskäytäntöjä käsittelevän neuvoa-antavan komitean (ACIP) suositukset. MMWR 2005;54(No. RR-8).
Kuvio 1
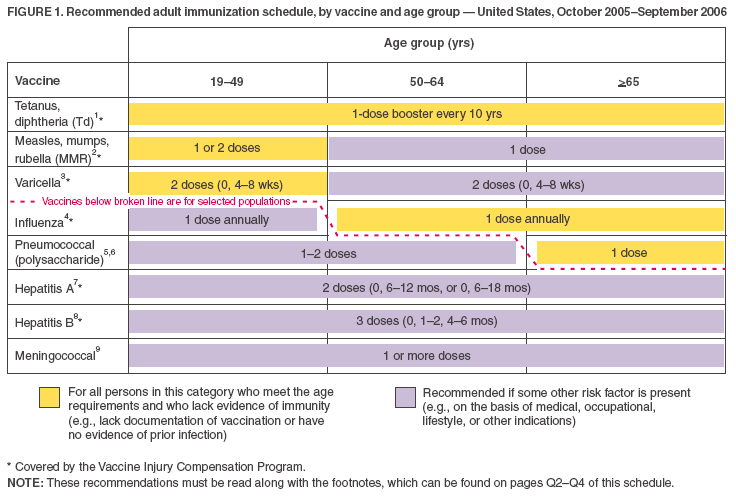
Palaa alkuun.
Kuvio 2

Palaa alkuun.
Hyväksynyt Advisory Committee on Immunization Practices, American College of Obstetricians and Gynecologists ja American Academy of Family Physicians
1. Jäykkäkouristus- ja kurkkumätärokotus (Td-rokotus). Aikuisille, joilla on epävarma tausta täydellisestä perusrokotussarjasta kurkkumätä- ja jäykkäkouristustoksoidia sisältävillä rokotteilla, olisi annettava perusrokotussarja, jossa käytetään yhdistettyä Td-toksoidia. Aikuisten perusrokotussarjaan kuuluu kolme annosta; kaksi ensimmäistä annosta annetaan vähintään neljän viikon välein ja kolmas annos 6-12 kuukauden kuluttua toisesta annoksesta. Annetaan 1 annos, jos henkilö on saanut ensisijaisen rokotussarjan ja jos viimeinen rokotus on saatu >10 vuotta sitten. Katso ACIP:n lausunnosta suositukset Td:n antamisesta profylaksiana haavanhoidossa (http://www.cdc.gov/mmwr/preview/mmwrhtml/00041645.htm). American College of Physicians Task Force on Adult Immunization tukee toista vaihtoehtoa Td:n käytölle aikuisilla: yksi Td-kertauskertauskertaus 50 vuoden iässä henkilöille, jotka ovat suorittaneet koko pediatrisen rokotussarjan, mukaan lukien teini-ikäisten/nuorten aikuisten kertauskertauskertaus. Aikuisille on saatavilla äskettäin hyväksytty jäykkäkouristus-difteria-soluinen hinkuyskärokote. ACIP:n suositukset sen käytöstä julkaistaan.
2. Tuhkarokko, sikotauti, vihurirokko (MMR). Tuhkarokkokomponentti: Ennen vuotta 1957 syntyneitä aikuisia voidaan pitää immuunina tuhkarokkoa vastaan. Vuoden 1957 aikana tai sen jälkeen syntyneiden aikuisten tulisi saada >1 annos MMR-rokotetta, ellei heillä ole lääketieteellistä vasta-aihetta, dokumentoitua >1 annosta, terveydenhuoltohenkilöstön diagnoosiin perustuvaa tuhkarokkoanamneesia tai laboratorionäyttöä immuniteetista. Toista MMR-annosta suositellaan aikuisille, jotka 1) ovat äskettäin altistuneet tuhkarokolle tai taudinpurkauksen yhteydessä; 2) jotka on aiemmin rokotettu tapetulla tuhkarokkorokotteella; 3) jotka on rokotettu tuntemattomalla tuhkarokkorokotetyypillä vuosina 1963-1967; 4) jotka ovat opiskelijoita keskiasteen jälkeisissä oppilaitoksissa; 5) jotka työskentelevät terveydenhuollon laitoksessa; tai 6) jotka aikovat matkustaa kansainvälisesti. Älkää antako MMR- tai muita tuhkarokkoa sisältäviä rokotteita HIV-tartunnan saaneille henkilöille, joilla on vaikea immunosuppressio. Sikotautikomponentti: Yksi annos MMR-rokotetta riittää suojaamaan vuoden 1957 aikana tai sen jälkeen syntyneitä henkilöitä, joilla ei ole ollut sikotautia terveydenhuollon tarjoajan diagnoosin perusteella tai joilla ei ole laboratoriotodisteita immuniteetista. Vihurirokko: annetaan 1 annos MMR-rokotetta naisille, joiden vihurirokkorokotushistoria ei ole luotettava tai joilla ei ole laboratorionäyttöä immuniteetista. Hedelmällisessä iässä oleville naisille on syntymävuodesta riippumatta määritettävä rutiininomaisesti vihurirokkoimmuniteetti ja neuvottava naisia synnynnäisestä vihurirokko-oireyhtymästä. Älä rokota naisia, jotka ovat raskaana tai jotka saattavat tulla raskaaksi 4 viikon kuluessa rokotteen saamisesta. Naisten, joilla ei ole näyttöä immuniteetista, on saatava MMR-rokote raskauden päätyttyä tai päättyessä ja ennen terveydenhuoltolaitoksesta kotiutumista.
3. Varicella-rokotus. Varicella-rokotusta suositellaan kaikille aikuisille, joilla ei ole näyttöä immuniteetista varicellaa vastaan. Erityistä huomiota olisi kiinnitettävä henkilöihin, jotka 1) ovat läheisessä kosketuksessa henkilöihin, joilla on suuri riski sairastua vakavaan tautiin (terveydenhuollon työntekijät ja immuunipuutteisten henkilöiden perhekontaktit), tai 2) joilla on suuri altistumis- tai tartuntariski (esim. pienten lasten opettajat, lastenhoitohenkilöstö, laitosten asukkaat ja henkilökunta, mukaan lukien vankeinhoitolaitokset, korkeakouluopiskelijat, armeijan henkilökunta, nuoret ja aikuiset, jotka asuvat kotitalouksissa, joissa on lapsia, ei-raskaana olevat, hedelmällisessä iässä olevat naiset ja kansainväliset matkustajat). Aikuisten varicella-immuniteetin osoittamiseen kuuluu jokin seuraavista: 1) dokumentoitu iänmukainen varicella-rokotus (eli yksi annos ennen 13 vuoden ikää tai kaksi annosta 13 vuoden iän jälkeen); 2) Yhdysvalloissa ennen vuotta 1966 syntyneet tai ennen vuotta 1966 esiintynyt varicella-tauti, jos kyseessä on muu kuin yhdysvaltalainen….syntyneiden henkilöiden osalta; 3) varicella-historia, joka perustuu terveydenhuollon tarjoajan diagnoosiin tai vanhempien tai omaan ilmoitukseen tyypillisestä varicella-taudista vuosina 1966-1997 syntyneiden henkilöiden osalta (epätyypillisestä, lievästä tautitapauksesta raportoivan potilaan osalta terveydenhuollon tarjoajien on etsittävä joko epidemiologista yhteyttä tyypilliseen varicella-tapaukseen tai todisteita laboratoriovahvistuksesta, jos se on tehty akuutin taudin aikana); 4) herpes zoster -tauti, joka on sairastettu aiemmin terveydenhuollon tarjoajan diagnoosin perusteella; tai 5) laboratoriotodisteet immuniteetista. Älä rokota naisia, jotka ovat raskaana tai jotka saattavat tulla raskaaksi 4 viikon kuluessa rokotteen saamisesta. Arvioi raskaana olevilta naisilta todisteet varicella-immuniteetista. Naisten, joilla ei ole näyttöä immuniteetista, on saatava annos 1 varicella-rokotetta raskauden päätyttyä tai päättyessä ja ennen terveydenhuoltolaitoksesta kotiutumista. Annos 2 on annettava 4–8 viikkoa annoksen 1 jälkeen.
4. Influenssarokotus. Lääketieteelliset indikaatiot: sydän- ja verenkiertoelimistön tai keuhkojärjestelmän krooniset sairaudet, mukaan lukien astma; krooniset aineenvaihduntasairaudet, mukaan lukien diabetes mellitus, munuaisten toimintahäiriöt, hemoglobinopatiat tai immunosuppressio (mukaan lukien lääkkeiden tai HIV:n aiheuttama immunosuppressio); mikä tahansa tila (esim, kognitiivinen toimintahäiriö, selkäydinvamma, kouristushäiriö tai muu neuromuskulaarinen häiriö), joka heikentää hengitystoimintaa tai hengitysteiden eritteiden käsittelyä tai joka voi lisätä aspiraatioriskiä; ja raskaus influenssakauden aikana. Vakavan tai komplisoituneen influenssataudin riskistä aspleniaa sairastavilla henkilöillä ei ole tietoja; influenssa on kuitenkin riskitekijä sekundaarisille bakteeri-infektioille, jotka voivat aiheuttaa vakavan taudin aspleniaa sairastaville henkilöille. Ammatilliset indikaatiot: Terveydenhuollon työntekijät ja pitkäaikaishoitolaitosten ja hoivakotien työntekijät. Muut käyttöaiheet: hoitokotien ja muiden pitkäaikaishoidon ja avustetun asumisen laitosten asukkaat; henkilöt, jotka todennäköisesti levittävät influenssaa suuressa riskissä oleville henkilöille (esim. kotikontaktit ja 0-23 kuukauden ikäisten lasten hoitajat tai kaikenikäiset henkilöt, joilla on riskialttiita sairauksia), ja kaikki, jotka haluavat saada rokotuksen. Terveille, ei-raskaana oleville 5-49-vuotiaille henkilöille, joilla ei ole korkean riskin sairauksia ja jotka eivät ole erityishoitoyksiköissä olevien vakavasti immuunipuutteisten henkilöiden kontakteja, voidaan inaktivoidun rokotteen sijasta antaa intranasaalisesti annettava influenssarokote (FluMist®).
5. Pneumokokin polysakkaridirokotus. Lääketieteelliset käyttöaiheet: Krooniset keuhkosairaudet (pois lukien astma); sydän- ja verisuonitaudit; diabetes mellitus; krooniset maksasairaudet, mukaan lukien alkoholin väärinkäytöstä johtuva maksasairaus (esim. kirroosi); krooninen munuaisten vajaatoiminta tai nefroottinen oireyhtymä; toiminnallinen tai anatominen asplenia (esim, sirppisolusairaus tai pernan poisto ); immunosuppressiiviset tilat (esim. synnynnäinen immuunipuutos, HIV-infektio , leukemia, lymfooma, multippeli myelooma, Hodgkinin tauti, yleistynyt pahanlaatuinen sairaus tai elin- tai luuydinsiirto); kemoterapia, jossa käytetään alkyloivia aineita, antimetaboliitteja tai pitkäkestoisia systeemisiä kortikosteroideja; ja sisäkorvaistutteet. Muut käyttöaiheet: Alaskan alkuperäisväestö ja tietyt Amerikan intiaaniväestöt; vanhainkotien ja muiden pitkäaikaishoitolaitosten asukkaat.
6. Uudelleenrokotus pneumokokki-polysakkaridirokotteella. Kertaluonteinen uusintarokotus 5 vuoden kuluttua henkilöille, joilla on krooninen munuaisten vajaatoiminta tai nefriittinen oireyhtymä; toiminnallinen tai anatominen asplenia (esim. sirppisolusairaus tai pernanpoisto); immunosuppressiiviset tilat (esim, synnynnäinen immuunipuutos, HIV-infektio, leukemia, lymfooma, multippeli myelooma, Hodgkinin tauti, yleistynyt pahanlaatuinen sairaus tai elin- tai luuydinsiirto); tai kemoterapia, jossa käytetään alkyloivia aineita, antimetaboliitteja tai pitkäaikaisia systeemisiä kortikosteroideja. >65-vuotiaille henkilöille kertaluonteinen uusintarokotus, jos heidät on rokotettu >5 vuotta aikaisemmin ja he olivat <65-vuotiaita perusrokotuksen aikaan.
7. Hepatiitti A -rokotus. Lääketieteelliset indikaatiot: henkilöt, joilla on hyytymistekijähäiriöitä tai krooninen maksasairaus. Käyttäytymiseen liittyvät indikaatiot: miesten kanssa seksiä harrastavat miehet tai laittomien huumeiden käyttäjät. Ammatilliset indikaatiot: Henkilöt, jotka työskentelevät A-hepatiittiviruksen (HAV) tartunnan saaneiden kädellisten kanssa tai HAV:n kanssa tutkimuslaboratorioympäristössä. Muut käyttöaiheet: henkilöt, jotka matkustavat tai työskentelevät maissa, joissa hepatiitti A:n endeemisyys on suuri tai keskisuuri (luettelo maista, ks. http://www.cdc.gov/travel/diseases.htm#hepa), sekä kaikki henkilöt, jotka haluavat saada immuniteetin. Nykyiset rokotteet on annettava kahden annoksen sarjana joko 0 ja 6-12 kuukauden tai 0 ja 6-18 kuukauden iässä. Jos käytetään yhdistettyä A- ja B-hepatiittirokotetta, annetaan 3 annosta 0, 1 ja 6 kuukauden iässä.
8. B-hepatiittirokotus. Lääketieteelliset indikaatiot: hemodialyysipotilaat (käytä erityisvalmistetta tai kahta 20 µg/ml annosta) tai potilaat, jotka saavat hyytymistekijäkonsentraatteja. Ammatilliset käyttöaiheet: terveydenhoitohenkilöstö ja julkisen sektorin työntekijät, jotka altistuvat verelle työpaikalla, sekä lääketieteellisissä, hammaslääketieteellisissä, sairaanhoito-, laboratorioteknisissä ja muissa terveydenhuollon alaan kuuluvissa ammateissa opiskelevat henkilöt. Käyttäytymiseen liittyvät indikaatiot: ruiskuhuumeiden käyttäjät, henkilöt, joilla on ollut useampi kuin yksi seksikumppani viimeisten 6 kuukauden aikana, henkilöt, joilla on äskettäin saatu sukupuolitauti, ja miehet, jotka harrastavat seksiä miesten kanssa. Muut käyttöaiheet: kroonista hepatiitti B -virusinfektiota (HBV) sairastavien henkilöiden kotikontaktit ja seksikumppanit; kehitysvammalaitosten asiakkaat ja henkilökunta; kaikki sukupuolitautiklinikoiden asiakkaat; vankeinhoitolaitosten vangit; ja ulkomaanmatkustajat, jotka oleskelevat yli 6 kuukautta maissa, joissa krooninen HBV-infektio on yleistynyt voimakkaasti tai keskivaikeasti (maaluettelo ks. kohdasta http://www.cdc.gov/travel/diseases.htm#hepa).
9. Meningokokkirokotus. Lääketieteelliset indikaatiot: aikuiset, joilla on anatominen tai toiminnallinen asplenia tai terminaalinen komplementtikomponentin puutos. Muut käyttöaiheet: asuntoloissa asuvat ensimmäisen vuoden opiskelijat; mikrobiologit, jotka altistuvat rutiininomaisesti Neisseria meningitidis -isolaateille; armeijan alokkaat; ja henkilöt, jotka matkustavat tai asuvat maissa, joissa meningokokkitauti on hyperendeminen tai epidemia (esim. Saharan eteläpuolisen Afrikan ”aivokalvontulehdusvyöhyke” kuivana kautena), erityisesti jos kosketus paikalliseen väestöön on pitkäaikainen. Saudi-Arabian hallitus vaatii rokottamista kaikilta Mekkaan matkustavilta vuosittaisen Hajjin aikana. Meningokokkikonjugaattirokotetta suositellaan aikuisille, jotka täyttävät jonkin edellä mainituista käyttöaiheista ja ovat <55-vuotiaita, vaikka meningokokkipolysakkaridirokote (MPSV4) on hyväksyttävä vaihtoehto. Rokottamisen uusiminen 5 vuoden kuluttua saattaa olla aiheellista aikuisille, jotka on aiemmin rokotettu MPSV4-rokotteella ja joilla on edelleen suuri tartuntariski (esim. henkilöt, jotka asuvat alueilla, joilla tauti on epidemia).
10. Valitut tilat, joihin Haemophilus influenzae tyyppi b (Hib) -rokotetta voidaan käyttää. Hib-konjugaattirokotteet on hyväksytty 6–71 kuukauden ikäisille lapsille. Käytettävissä ei ole tehoa koskevia tietoja, joiden perusteella voitaisiin antaa suositus Hib-rokotteen käytöstä vanhemmille lapsille ja aikuisille, joilla on kroonisia sairauksia, joihin liittyy suurentunut riski sairastua Hib-tautiin. Tutkimukset viittaavat kuitenkin hyvään immunogeenisuuteen potilailla, joilla on sirppisolusairaus, leukemia tai HIV-infektio tai joille on tehty pernanpoisto; rokotteen antaminen näille potilaille ei ole vasta-aiheista.
Suositeltu aikuisten immunisaatioaikataulu on hyväksytty neuvoa-antavassa rokotuskäytäntöjä käsittelevässä komiteassa (Advisory Committee on Immunization Practices), amerikkalaisessa synnytys- ja naistentautilääkäreiden kollegiumissa (American College of Obstetricians and Gynecologists) ja amerikkalaisessa perhelääkäreiden akatemiassa. MMWR:n tavanomaista alaviitteiden muotoa on muutettu tämän aikataulun julkaisemista varten.
Esitetty viittaus: Centers for Disease Control and Prevention. Recommended Adult Immunization Schedule—United States, October 2005–September 2006. MMWR 2005;54:Q1–Q4.
Tässä aikataulussa ilmoitetaan suositellut ikäryhmät ja lääketieteelliset indikaatiot tällä hetkellä hyväksyttyjen rokotteiden rutiininomaiselle antamiselle >19-vuotiaille henkilöille. Lisensoituja yhdistelmärokotteita voidaan käyttää aina, kun mikä tahansa yhdistelmän komponentti on aiheellinen ja kun rokotteen muut komponentit eivät ole vasta-aiheisia. Yksityiskohtaiset suositukset löytyvät valmistajien pakkausselosteista ja ACIP:n täydellisistä lausunnoista (http://www.cdc.gov/nip/publications/acip-list.htm).
Raportoi kaikki kliinisesti merkittävät rokotuksen jälkeiset reaktiot Vaccine Adverse Event Reporting System (VAERS) -järjestelmään. Raportointilomakkeita ja ohjeita VAERS-raportin tekemiseen saa puhelimitse numerosta 800-822-7967 tai VAERS:n verkkosivuilta osoitteesta http://www.vaers.hhs.gov.
Tietoa rokotevahinkojen korvausohjelman korvaushakemuksen tekemisestä saa osoitteesta http://www.hrsa.gov/osp/vicp tai puhelimitse numerosta 800-338-2382. Rokotevahinkoa koskevan korvausvaatimuksen voi tehdä osoitteessa U.S. Court of Federal Claims, 717 Madison Place, N.W., Washington, DC 20005, puhelin 202-357-6400.
Lisätietoa edellä luetelluista rokotteista ja rokotusten vasta-aiheista saa myös osoitteesta http://www.cdc.gov/nip tai CDC-INFO-yhteyskeskuksesta numerosta 800-CDC-INFO (232-4636) englanniksi ja espanjaksi 24 tuntia vuorokaudessa, 7 päivää viikossa.
Kauppanimien ja kaupallisten lähteiden käyttö on vain tunnistamistarkoituksessa, eikä se tarkoita sitä, että Yhdysvaltain terveysministeriö (U.S. Department of Health and Human Services) olisi antanut niille hyväksyntänsä.Viittaukset muihin kuin CDC:n sivustoihin Internetissä tarjotaan palveluna MMWR:n lukijoille, eivätkä ne merkitse CDC:n tai Yhdysvaltain terveysministeriön (U.S. Department of Health and Human Services) hyväksyntää tai sitä, että CDC tai Yhdysvaltain terveysministeriö (U.S. Department of Health and Human Services) olisi hyväksynyt näitä organisaatioita tai niiden ohjelmia. CDC ei ole vastuussa näillä sivustoilla olevien sivujen sisällöstä. MMWR:ssä luetellut URL-osoitteet olivat voimassa julkaisupäivänä.
Disclaimer Kaikki MMWR:n artikkelien HTML-versiot ovat sähköisiä muunnoksia ASCII-tekstistä HTML-muotoon. Tämä muuntaminen on saattanut aiheuttaa HTML-versiossa merkkien käännös- tai muotovirheitä. Käyttäjien ei pidä luottaa tähän HTML-dokumenttiin, vaan he saavat virallisen tekstin, kuvat ja taulukot sähköisestä PDF-versiosta ja/tai MMWR:n alkuperäisestä paperiversiosta. Tämän numeron alkuperäisen paperikappaleen voi saada Superintendent of Documentsista, U.S. Government Printing Office (GPO), Washington, DC 20402-9371; puhelin: (202) 512-1800. GPO:lta voi tiedustella voimassa olevia hintoja.
**Kysymykset tai viestit, jotka koskevat muotoiluvirheitä, on osoitettava osoitteeseen [email protected].
Viimeisin tarkistettu: 10/13/2005
