La circulación uterina es exquisitamente sensible a la estimulación de los estrógenos, respondiendo con un grado de vasodilatación sin parangón en ningún otro órgano del cuerpo a ningún otro estímulo.2 Durante el ciclo ovárico, se producen patrones repetitivos de UBF que reflejan el efecto de la secreción de estrógenos y los efectos moduladores de la progesterona. Estos patrones cíclicos se demuestran de forma más dramática en animales con fases de ciclo preovulatorio cortas, como la vaca, la cerda y la oveja, y se ilustran en la Figura 1 con los niveles periféricos de estrógeno y progesterona.3, 4, 5 Tras la concepción en estas especies, los patrones de UBF son similares a los de los animales no preñados hasta que se produce la interdigitación de los tejidos maternos y fetales entre 17 y 28 días después; entonces, se produce un aumento definitivo y progresivo de la UBF que continúa hasta la gestación a término. Dado que la erosión del endometrio por el trofoblasto fetal se produce mucho antes tras la concepción en los primates, es razonable suponer que la UBF aumenta antes en estas especies, aunque nunca se han observado estas respuestas. En la figura 2 se ilustran los patrones generales de la UBF total, la UBF por unidad de peso del útero y su contenido, la fracción de la UBF que abastece a la placenta y el peso fetal a lo largo de la gestación ovina. El periodo comprendido entre los 17 y los 70 días de gestación se asocia con los cambios más rápidos en la UBF y la PBF y se corresponde con el momento de la placentación definitiva en esta especie. Por mecanismos incompletos, los vasos sanguíneos que irrigan la placenta se dilatan progresivamente durante este periodo, provocando simultáneamente un aumento absoluto de la UBF total y la derivación de esta sangre de los tejidos no placentarios a la placenta.* Con la posterior maduración de la placenta, la fracción de UBF que irriga la placenta y la cantidad absoluta de PBF aumentan, pero a ritmos más similares a los del crecimiento fetal; así, durante la última mitad de la gestación, la UBF por unidad de peso del útero y su contenido es esencialmente constante. Durante este mismo tiempo, la cantidad de oxígeno extraída de cada mililitro de sangre es constante y, por lo tanto, la cantidad de oxígeno entregada por peso dado de útero grávido también es constante.6 Estudios correlativos en mujeres indican patrones homeostáticos similares desde las 10 hasta las 40 semanas de gestación y un consumo de oxígeno similar (aproximadamente 10 ml/kg).7 Dado que las mujeres entregan la misma cantidad de oxígeno a tasas de UBF más bajas que la oveja (~150 frente a ~270 ml/kg), se deduce que la placenta humana es más eficiente en este sentido. Así, para fetos de peso similar, se requiere menos UBF absoluta y la carga de la gestación sobre el corazón disminuye.
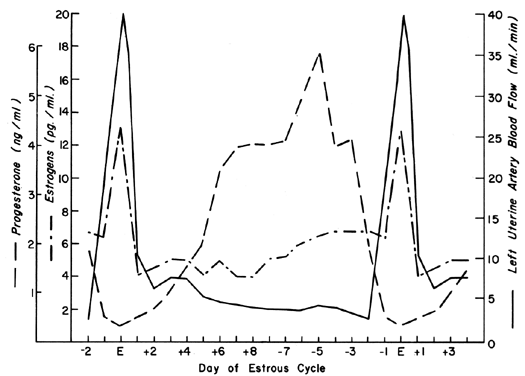 Fig. 1. Patrón de flujo sanguíneo uterino unilateral durante el ciclo estral ovino mostrado con los niveles séricos de estrógenos y progesterona reportados.(Adaptado de Greiss FC, Jr, Anderson SG: Am J Obstet Gynecol 103:629, 1969; Yuthasastrakosol P et al: J Reprod Fertil 43:57, 1975.)
Fig. 1. Patrón de flujo sanguíneo uterino unilateral durante el ciclo estral ovino mostrado con los niveles séricos de estrógenos y progesterona reportados.(Adaptado de Greiss FC, Jr, Anderson SG: Am J Obstet Gynecol 103:629, 1969; Yuthasastrakosol P et al: J Reprod Fertil 43:57, 1975.)
 Fig. 2. Patrones longitudinales del flujo sanguíneo uterino y su distribución durante la gestación ovina.
Fig. 2. Patrones longitudinales del flujo sanguíneo uterino y su distribución durante la gestación ovina.
Los cambios en la PBF se llevan a cabo mediante una vasodilatación cada vez mayor de los vasos sanguíneos que irrigan la placenta a lo largo de la gestación. Sin embargo, en cualquier momento durante el segundo y el tercer trimestre, básicamente no puede producirse una vasodilatación aguda de estos vasos. Por lo tanto, para mantener un suministro de oxígeno constante durante los episodios de reducción de la FBP, debe producirse un aumento de la extracción de oxígeno (Fig. 3). Basándose en los datos comunicados, parece que el límite del aumento de la extracción es doble. Por lo tanto, la PBF tiene que reducirse más del 50% antes de que el suministro de oxígeno disminuya. Estas consideraciones suponen que la tasa de PBF homeostática era óptima antes de la reducción del flujo. Sin embargo, sabemos que los niveles homeostáticos pueden ser subóptimos, ya sea de forma subaguda, como en la toxemia, o de forma crónica, como en las nefropatías. En tales casos, el factor de seguridad, es decir, el porcentaje que puede reducirse la FBP antes de que se vea comprometido el suministro de oxígeno, se reduce. Esto debe tenerse siempre en cuenta cuando se evalúa el efecto de un estímulo agudo sobre el feto.
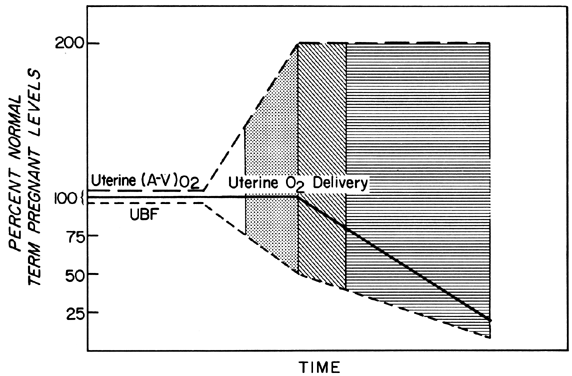 Fig. 3. Cambios en la extracción de oxígeno arteriovenosa uterina -(A-V)02- en respuesta a las reducciones del flujo sanguíneo uterino durante la segunda mitad de la gestación ovina. Dado que el (A-V)02 puede duplicarse, el suministro de 02 uterino se mantendrá en niveles homeostáticos hasta que el flujo sanguíneo uterino se reduzca más del 50%. Las áreas claras, punteadas y rayadas indican grados hipotéticos de reserva fetal cuando se definen en función del flujo sanguíneo placentario óptimo y se utilizan para indicar niveles similares de reserva fetal en ilustraciones posteriores. (Adaptado de Huckabee WE, Metcalfe J, Prystowsky H et al: Blood flow and oxygen consumption of the pregnant uterus. Physiol 200:274, 1961.)
Fig. 3. Cambios en la extracción de oxígeno arteriovenosa uterina -(A-V)02- en respuesta a las reducciones del flujo sanguíneo uterino durante la segunda mitad de la gestación ovina. Dado que el (A-V)02 puede duplicarse, el suministro de 02 uterino se mantendrá en niveles homeostáticos hasta que el flujo sanguíneo uterino se reduzca más del 50%. Las áreas claras, punteadas y rayadas indican grados hipotéticos de reserva fetal cuando se definen en función del flujo sanguíneo placentario óptimo y se utilizan para indicar niveles similares de reserva fetal en ilustraciones posteriores. (Adaptado de Huckabee WE, Metcalfe J, Prystowsky H et al: Blood flow and oxygen consumption of the pregnant uterus. Physiol 200:274, 1961.)
*En el hombre y los primates subhumanos, las arteriolas espirales que abastecerán el espacio intervelloso (aproximadamente una por cotiledón placentario) pierden sus conexiones capilares y se dilatan unas diez veces como resultado de la sustitución de las paredes de los vasos por trofoblastos. Este proceso puede extenderse hasta o por debajo de la unión mioendometrial, convirtiendo literalmente las arteriolas espirales en arterias espirales. La sangre que fluye a través de estos vasos sanguíneos modificados hacia el espacio intervelloso constituye la FBP.
En la especie ovina, en el estado no gestante se presentan múltiples áreas discretas de endometrio llamadas carúnculas. Durante la gestación, la interdigitación de los tejidos fetales y maternos se produce en estas carúnculas, que se agrandan para convertirse en cotiledones placentarios individuales. La sangre que fluye hacia estas zonas constituye colectivamente la PBF. Aunque los vasos sanguíneos arteriales de los cotiledones se dilatan significativamente, no contienen elementos trofoblásticos, la transferencia materno-fetal se produce por una interfaz capilar-capilar y no hay espacio intervelloso.
Respuestas dinámicas de la circulación uterina
Los vasos sanguíneos del útero no gestante responden de forma similar a los de cualquier otro órgano muscular, con la excepción de su singular reactividad a la estimulación estrogénica, su respuesta a los agentes anestésicos locales y, posiblemente, su respuesta a las prostaglandinas (Tabla 1). Durante el embarazo, los vasos sanguíneos que irrigan la placenta se dilatan progresivamente, alcanzando un estado en el que puede producirse una dilatación aguda mínima o nula.24 Por lo tanto, los estímulos que evocan la vasodilatación en el útero no gestante son ineficaces una vez que se ha producido la placentación definitiva. Sin embargo, los vasos placentarios conservan su capacidad de vasoconstricción como en el estado no gestante. Dado que la PBF se aproxima al 80% o 90% de la UBF total en el embarazo a término, las respuestas vasculares uterinas totales aparecerán como las de los vasos placentarios. Este punto se interpreta a menudo de forma errónea, y hay que recordar que las respuestas de los vasos no placentarios son las mismas tanto si hay embarazo como si no.
TABLA 1. Respuestas de la vasculatura uterina no embarazada*
|
Vasoconstricción |
Vasodilatación |
|
α-Estimulación adrenérgica |
Estimulación beta-adrenérgica |
|
(dopamina, epinefrina, |
(isoproterenol, epinefrina)8,9,16 |
|
norepinefrina)8,9,10 |
Acetilcolina y agentes parasimpaticomiméticos23 |
|
Agentes simpaticomiméticos 11 |
Adenosinas17 |
|
(fármacos vasopresores) |
Bradiquinina17,18 |
|
Hipoxemia(grave)12 |
Cianuro19 |
|
Agentes anestésicos locales |
Sustancias estrogénicas |
|
(administración intraarterial)13,14 |
(efecto retardado pero prolongado)2 |
|
Nicotina |
Glucosamina |
|
(mediación α-adrenérgica)15 |
(? efecto osmótico)21 |
|
Hipoxemia (leve)12 |
|
|
Esquemia19 |
|
|
Nitroglicerina19 |
|
|
Prostaglandinas E1, E2, y I18,22 |
|
|
Polipéptido intestinal vasoactivo20 |
* La marcada dilatación de los vasos sanguíneos que irrigan la placenta y la distribución preponderante del flujo sanguíneo uterino a la placenta obliteran las respuestas gravídicas; Por lo tanto, los efectos de los estímulos vasodilatadores durante el embarazo son controvertidos. Cuando se comprueban, las respuestas vasculares no placentarias son similares a las respuestas no embarazadas.
La estructura hemocorial de la placenta humana añade un factor único a los que normalmente controlan el flujo sanguíneo en otros lechos vasculares. Es decir, la sangre atraviesa las arterias espirales para entrar en el espacio intervelloso de tipo pantanoso, perfunde las vellosidades fetales y luego vuelve a la circulación general por muchas venas colectoras en la placa basal. En efecto, la sangre abandona los canales vasculares normales para circular por un nuevo espacio extravascular injertado en el útero mientras dure el embarazo. Dado que el espacio intervelloso se encuentra dentro de la cavidad uterina y que la placenta es una estructura flexible, la presión generada por la contracción del miometrio se transmitirá por igual a la cavidad amniótica y al espacio intervelloso. Así pues, un factor ajeno al control vascular habitual, la actividad del miometrio, puede modificar la presión del espacio intervelloso e influir en la FBP por sus efectos sobre la presión de perfusión. En la figura 4 se muestra una representación esquemática del flujo sanguíneo hacia los tejidos no placentarios y hacia un cotiledón único, junto con las fórmulas pertinentes para el control de cada uno de ellos. Cabe señalar que estas fórmulas son sólo aplicaciones de la ley de Ohm a estas situaciones cardiovasculares individuales.
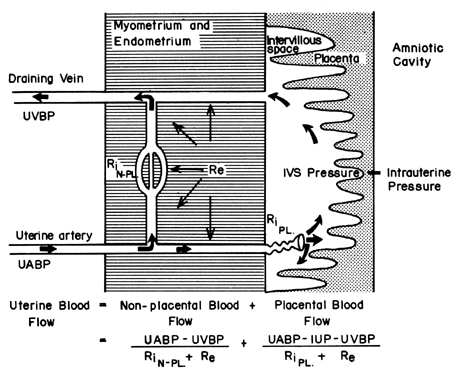 Fig. 4. Circulaciones no placentaria y placentaria y los factores que afectan a cada una de ellas en el útero de los primates. La relación entre estos factores y el flujo sanguíneo distribuido se define en la ecuación adjunta. UABP, presión arterial uterina; UVBP, presión venosa uterina; Re, resistencia vascular extrínseca; RiN-PL y RiPL, resistencia vascular intrínseca causada por las reactividades de las arteriolas no placentarias y placentarias, respectivamente.(De Greiss FC, Jr: MCV/Q, 8:52, 1972.)
Fig. 4. Circulaciones no placentaria y placentaria y los factores que afectan a cada una de ellas en el útero de los primates. La relación entre estos factores y el flujo sanguíneo distribuido se define en la ecuación adjunta. UABP, presión arterial uterina; UVBP, presión venosa uterina; Re, resistencia vascular extrínseca; RiN-PL y RiPL, resistencia vascular intrínseca causada por las reactividades de las arteriolas no placentarias y placentarias, respectivamente.(De Greiss FC, Jr: MCV/Q, 8:52, 1972.)
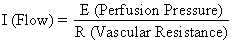
La presión de perfusión que lleva la sangre a los tejidos no placentarios es la diferencia entre las presiones arterial y venosa del útero. Sin embargo, la presión de perfusión que lleva sangre al espacio intervelloso es la diferencia entre la presión arterial uterina y la presión del espacio intervelloso. Esta última se aproxima mejor a la presión del líquido amniótico (IUP). En un órgano muscular, los factores de resistencia incluirán la resistencia procedente de la reactividad del músculo liso vascular, o resistencia intrínseca (Ri), y la compresión impartida a los vasos sanguíneos cuando atraviesan el miometrio en contracción, o resistencia extrínseca (Re). Por lo tanto, debería ser evidente que las contracciones uterinas pueden afectar a la FBC mediante dos mecanismos: aumentando la Re y reduciendo la presión de perfusión de la placenta.
En la práctica clínica, son importantes tres características principales del control vascular de la placenta. Estas incluyen la relación entre la presión de perfusión y el flujo, las respuestas de las arterias espirales a los estímulos vasoactivos y los efectos de las contracciones del miometrio. Además, deben apreciarse los efectos únicos de los agentes anestésicos locales.
Relación presión-flujo
Cuando se observan los cambios en la UBF secundarios a las reducciones de la presión de perfusión durante la quiescencia miometrial, puede desarrollarse una relación rectilínea con una pendiente de uno (Fig. 5). Esto refleja la naturaleza ampliamente dilatada de la vasculatura placentaria e indica que la FBP disminuirá casi en idéntica proporción a la disminución de la presión de perfusión. Dado que la presión venosa uterina es bastante constante en la mayoría de las circunstancias, los cambios en la presión sanguínea sistémica (PSM) pueden utilizarse para aproximar los cambios en la FBC. Es decir, se espera que una disminución del 25% en la presión arterial media provoque una disminución del 25% en la PBF. Sin embargo, estas mediciones deben realizarse en posición de decúbito lateral, ya que se ha demostrado que la presión del útero grávido sobre la aorta por sí sola disminuye la presión sanguínea en la zona pélvica por debajo de la observada en la arteria braquial.
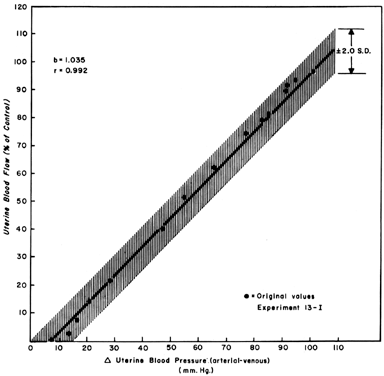 Fig. 5. Línea de regresión presión-flujo determinada a partir de datos proporcionales agrupados en ovejas gestantes a término. Dado que la relación es lineal, el flujo sanguíneo uterino variará con y en proporción a cualquier cambio en la presión de perfusión.(De Greiss FC, Jr: Am J Obstet Gynecol 96:41, 1966.)
Fig. 5. Línea de regresión presión-flujo determinada a partir de datos proporcionales agrupados en ovejas gestantes a término. Dado que la relación es lineal, el flujo sanguíneo uterino variará con y en proporción a cualquier cambio en la presión de perfusión.(De Greiss FC, Jr: Am J Obstet Gynecol 96:41, 1966.)
Respuestas a los estímulos vasoactivos
Dado que las arterias espirales se aproximan a la máxima dilatación en el estado de reposo, los agentes o estímulos vasodilatadores tienen poco o ningún efecto aunque haya receptores para dichos agentes. Sin embargo, la musculatura lisa de estos vasos es exquisitamente sensible a los agentes o estímulos vasoconstrictores, más que la mayoría de los demás lechos vasculares periféricos (fig. 6). Esto significa que aunque la BPM puede aumentar en respuesta a la estimulación por un fármaco vasopresor de acción periférica como la fenilefrina, el aumento proporcional de la resistencia vascular placentaria (Ri) es tan grande que el efecto neto es una marcada disminución de la FBP. Estas diferencias en la sensibilidad vasoconstrictora deben tenerse en cuenta siempre que se indique un fármaco vasopresor. El uso de un fármaco de acción más central, como la efedrina, aunque cause una pequeña cantidad de vasoconstricción placentaria, dará lugar a una mejora proporcionalmente mayor de la PAM con un aumento absoluto de la FBC.
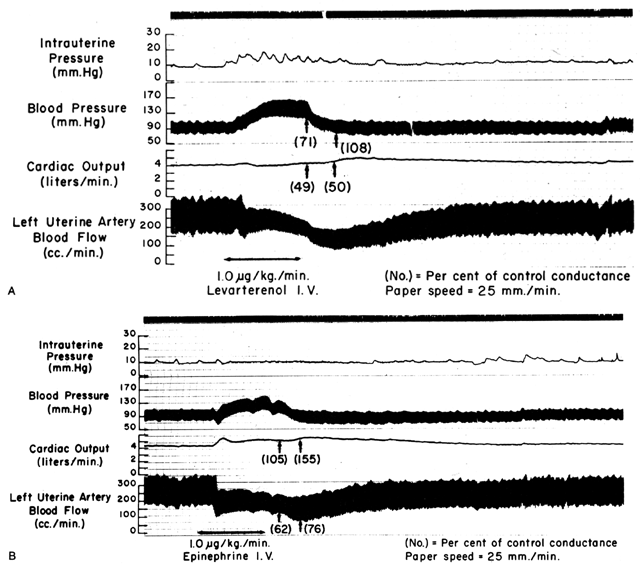 Fig. 6. Registros originales que muestran los efectos del levarterenol (norepinefrina) intravenoso ( A) y ( B) de la epinefrina sobre la presión arterial materna, el gasto cardíaco y el flujo sanguíneo uterino en la gestación ovina a término. Los cambios proporcionales de los niveles de control de la conductancia sistémica y uterina (el recíproco de la resistencia) se han insertado entre paréntesis. Obsérvese que la disminución de la conductancia uterina (aumento de la resistencia) supera la de la conductancia sistémica con otros agentes. (De Greiss FC, Jr: Obstet Gynecol 21:295, 1963. Cortesía de Harper & Row, Publishers.)
Fig. 6. Registros originales que muestran los efectos del levarterenol (norepinefrina) intravenoso ( A) y ( B) de la epinefrina sobre la presión arterial materna, el gasto cardíaco y el flujo sanguíneo uterino en la gestación ovina a término. Los cambios proporcionales de los niveles de control de la conductancia sistémica y uterina (el recíproco de la resistencia) se han insertado entre paréntesis. Obsérvese que la disminución de la conductancia uterina (aumento de la resistencia) supera la de la conductancia sistémica con otros agentes. (De Greiss FC, Jr: Obstet Gynecol 21:295, 1963. Cortesía de Harper & Row, Publishers.)
Contracciones miometriales
Actuando mediante los dos mecanismos comentados anteriormente, el aumento de Re y la disminución de la presión de perfusión, las contracciones miometriales disminuyen la FBP en proporción directa a la intensidad y duración de cada contracción. La relación es tan precisa que un trazado de la presión intrauterina es casi una imagen inversa exacta de la PBF (Fig. 7). El aumento de la frecuencia de las contracciones disminuye la PBF durante una unidad de tiempo determinada al disminuir la duración de la diástole del miometrio, ese tiempo en el que la PBF se encuentra en niveles homeostáticos. Además, si el tono de intercontracción es elevado, como en un desprendimiento de la placenta, la FBP de intercontracción se reducirá proporcionalmente. Los estudios radioangiográficos realizados en primates subhumanos y en mujeres demuestran que durante el apogeo de las contracciones miometriales de intensidad media, la PBF cesa.25 Es evidente, pues, que el trabajo de parto es intrínsecamente estresante para el feto, ya que la cantidad media de PBF que perfunde las vellosidades fetales por un período de tiempo determinado disminuye progresivamente a medida que aumentan la frecuencia y la intensidad de las contracciones uterinas.
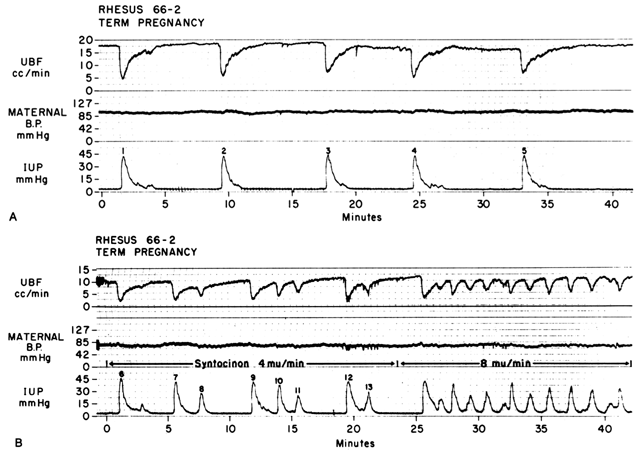 Fig. 7. A. Relación entre el flujo sanguíneo uterino (FSU) y las contracciones uterinas durante el parto espontáneo en un mono rhesus. Obsérvese la relación inversa de la imagen, los descensos bruscos del FCU al inicio de las contracciones y la recuperación más lenta del FCU de los niveles basales. La UBF recuperó los niveles basales sólo durante el tono «normal». B. Efecto del aumento de la frecuencia de las contracciones sobre la UBF producida por la estimulación con oxitocina del parto espontáneo mostrado en A. Obsérvese que la duración de las fases de tonicidad normal está disminuida. La tasa de UBF alcanzada entre las contracciones depende de la intensidad de la contracción precedente y de la duración de la fase de tono normal. Después de las contracciones 7 y 12, la recuperación del flujo fue incompleta porque la contracción siguiente se produjo sin una fase de tono normal. (De Greiss FC, Jr, Anderson SG: Clin Obstet Gynecol 11:96, 1968. Cortesía de Harper & Row, Publishers.)
Fig. 7. A. Relación entre el flujo sanguíneo uterino (FSU) y las contracciones uterinas durante el parto espontáneo en un mono rhesus. Obsérvese la relación inversa de la imagen, los descensos bruscos del FCU al inicio de las contracciones y la recuperación más lenta del FCU de los niveles basales. La UBF recuperó los niveles basales sólo durante el tono «normal». B. Efecto del aumento de la frecuencia de las contracciones sobre la UBF producida por la estimulación con oxitocina del parto espontáneo mostrado en A. Obsérvese que la duración de las fases de tonicidad normal está disminuida. La tasa de UBF alcanzada entre las contracciones depende de la intensidad de la contracción precedente y de la duración de la fase de tono normal. Después de las contracciones 7 y 12, la recuperación del flujo fue incompleta porque la contracción siguiente se produjo sin una fase de tono normal. (De Greiss FC, Jr, Anderson SG: Clin Obstet Gynecol 11:96, 1968. Cortesía de Harper & Row, Publishers.)
Agentes anestésicos locales
Estos fármacos pueden ejercer efectos en un lecho vascular directamente, como después de una inyección intravascular inadvertida, e indirectamente, como resultado de la parálisis de los nervios autónomos que mantienen el tono vascular normal. En la mayoría de los órganos, las inyecciones intravasculares no tienen efectos significativos sobre la resistencia vascular. Sin embargo, las vasculaturas uterina y placentaria responden a tales estímulos con una vasoconstricción significativa. Además, el miometrio es estimulado de forma variable por dichos fármacos (Fig. 8). Solas o en conjunto, estas respuestas disminuyen la FBC. Tras la anestesia de bloqueo paracervical administrada durante el parto, puede producirse una bradicardia fetal retardada. La mejor hipótesis para explicar la respuesta fetal es que los agentes anestésicos locales se inyectan cerca de las arterias uterinas y que, debido a su excelente penetración, atraviesan las paredes arteriales para causar sus efectos uterinos disminuyendo la FBP y provocando hipoxia fetal.
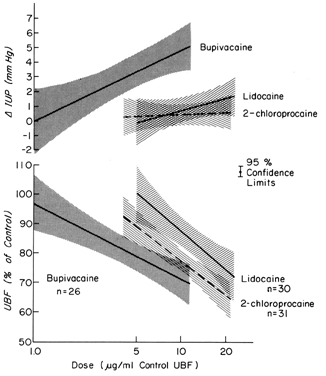 Fig. 8. Relaciones dosis-respuesta de los agentes anestésicos locales administrados directamente en la arteria uterina con la conductancia vascular uterina y la presión intrauterina durante la gestación ovina. Los niveles de la dosis efectiva están dentro de los rangos observados en los fetos durante la bradicardia después de la anestesia de bloqueo paracervical (de Fishburne JI, Jr et al: Responses of the gravid uterine vasculature to arterial levels of local anesthetic agents. Am J Obstet Gynecol 133:753, 1979. Cortesía de The C. V. Mosby Company.)
Fig. 8. Relaciones dosis-respuesta de los agentes anestésicos locales administrados directamente en la arteria uterina con la conductancia vascular uterina y la presión intrauterina durante la gestación ovina. Los niveles de la dosis efectiva están dentro de los rangos observados en los fetos durante la bradicardia después de la anestesia de bloqueo paracervical (de Fishburne JI, Jr et al: Responses of the gravid uterine vasculature to arterial levels of local anesthetic agents. Am J Obstet Gynecol 133:753, 1979. Cortesía de The C. V. Mosby Company.)
