La forme longue du tableau périodique, couramment utilisée, est conçue pour mettre l’accent sur les configurations électroniques. Comme ce sont les électrons les plus externes (de valence) qui sont principalement impliqués dans les interactions chimiques entre les atomes, le dernier électron ajouté à un atome dans le processus de construction est beaucoup plus intéressant pour un chimiste que le premier. Ce dernier électron est appelé électron distinctif car il distingue un atome de celui qui le précède immédiatement dans le tableau périodique. Le type de sous-coquille (s, p, d, f) dans lequel l’électron distinctif est placé est très étroitement lié au comportement chimique d’un élément et donne lieu à la classification illustrée par le code de couleurs sur le tableau périodique que l’on voit ici. Les éléments représentatifs sont ceux dans lesquels l’électron distinctif entre dans la sous coquille ans ou p. La plupart des éléments dont nous avons discuté la chimie et la valence jusqu’à présent appartiennent à cette catégorie. De nombreuses propriétés chimiques des éléments représentatifs peuvent être expliquées sur la base des diagrammes de Lewis. En d’autres termes, les valences des éléments représentatifs peuvent être prédites sur la base du nombre d’électrons de valence qu’ils possèdent, ou du nombre d’électrons qu’il faudrait ajouter pour obtenir la même configuration électronique qu’un atome d’un gaz rare. Pour les éléments représentatifs, le nombre d’électrons de valence est le même que le numéro du groupe périodique, et le nombre nécessaire pour correspondre à la configuration suivante d’un gaz noble est de 8 moins le numéro du groupe. Cela concorde avec les règles de valence dérivées du tableau périodique, et donne lieu à des formules pour les chlorures de la première douzaine d’éléments qui montrent la variation périodique de la valence.
| Elément | Poids atomique | Composés de l’hydrogène | Composés de l’oxygène | Composés du chlore |
|---|---|---|---|---|
| Hydrogène | 1.01 | H2 | H2O, H2O2 | HCl |
| Hélium | 4.00 | Non formé | Non formé | Non formé |
| Lithium | 6.94 | LiH | Li2O, Li2O2 | LiCl |
| Béryllium | 9.01 | BeH2 | BeO | BeCl2 |
| Bore | 10.81 | B2H6 | B2O3 | BCl3 |
| Carbone | 12.01 | CH4, C2H6, C3H8 | CO2, CO, C2O3 | CCl4, C2Cl6 |
| Azote | 14.01 | NH3, N2H4, HN3 | N2O, NO, NO2, N2O5 | NCl3 |
| Oxygène | 16.00 | H2O, H2O2 | O2, O3 | <Cl2O, ClO2, Cl2O7 |
| Fluor | 19.00 | HF | OF2, O2F2 | ClF, ClF3, ClF5 |
| Néon | 20.18 | Non formé | Non formé | Non formé |
| Sodium | 22.99 | NaH | Na2O, Na2O2 | NaCl |
| Magnésium | 24.31 | MgH2 | MgO | MgCl2 |
Les trois premières rangées horizontales ou périodes du tableau périodique moderne sont entièrement constituées d’éléments représentatifs. Dans la première période, les électrons distinctifs de H et He se trouvent dans la sous-couche 1s. Dans la deuxième période, Li et Be ont des électrons distinctifs dans la sous-couche 2s, et des électrons sont ajoutés à la sous-couche 2p dans les atomes de B à Ne. Dans la troisième période, la sous coquille 3s se remplit pour Na et Mg, et donc Al, Si, P, S, Cl et Ar. En règle générale, dans le cas des éléments représentatifs, l’électron distinctif se trouve dans une sous coquille ns ou np. La valeur de n, le nombre quantique principal de l’électron distinctif, peut être rapidement déterminée en comptant vers le bas à partir du haut du tableau périodique. Par exemple, l’iode est un élément représentatif de la cinquième période. Par conséquent, l’électron distinctif doit occuper la sous-coquille 5s ou 5p. Comme l’iode se trouve à droite du tableau, 5p est le bon choix.
Lorsque le nombre quantique principal est de trois ou plus, des sous-coquilles de type d sont également possibles. Les éléments de transition ou les métaux de transition sont les éléments dont l’électron distinctif se trouve dans une orbitale d. Les premiers exemples de métaux de transition (Sc, Ti, V, Cr, Mn, Fe, Co, Ni, Cu, Zn) se trouvent dans la quatrième période même si l’électron distinctif est dans chaque cas un électron 3d et appartient à la troisième enveloppe. Ce hiatus résulte, comme nous l’avons déjà vu, du fait que le 4s est d’énergie plus faible que le 3d. L’orbitale 4s commence donc à se remplir, amorçant la quatrième période avant qu’aucune des orbitales 3d ne puisse être occupée.
La figure \(\PageIndex{1}\) compare les distributions de probabilité d’un électron 4s et d’un électron 3d dans un atome V. Bien que le nuage d’électrons 4s se trouve en moyenne plus loin du noyau que le nuage 3d, une petite partie de la densité électronique 4s se trouve très proche du noyau où elle est à peine protégée de la charge nucléaire totale de +23. C’est la très forte force d’attraction de cette petite fraction de la densité électronique 4s totale qui abaisse l’énergie de l’électron 4s en dessous de celle du 3d.
_and_4s_(color)_Electron_Clouds.jpg?revision=1)
Le fait que le nuage électronique 4s soit plus étendu que le 3d a une influence importante sur la chimie des éléments de transition. Lorsqu’un atome tel que V (figure \(\PageIndex{1}\) ) interagit avec un autre atome, ce sont les électrons 4s s’étendant le plus loin du noyau qui entrent d’abord en contact avec l’autre atome. Ainsi, les électrons 4s sont souvent plus importants que les 3d pour déterminer la valence et les formules des composés. Les électrons 3d sont « enterrés » sous les surfaces des atomes des métaux de transition. L’ajout d’un électron 3d supplémentaire a beaucoup moins d’effet sur leurs propriétés chimiques que l’ajout d’un électron 3s ou 3p dans le cas des éléments représentatifs. On observe donc une transition lente mais régulière des propriétés d’un élément de transition à l’autre. Remarquez, par exemple, qu’à l’exception du Sc, tous les métaux de transition forment des chlorures, MCl2, où le métal a une valence de 2 ; les exemples sont TiCl2, VCl2, CrCl2, et ainsi de suite. Ceci est illustré dans le tableau figurant en haut de cette page. La valence de 2 correspond aux deux électrons de valence 4s.
Chacun des métaux de transition présente également d’autres valences où un ou plusieurs des électrons 3d sont également impliqués. Par exemple, dans certains composés le V (vanadium) a une valence de 2 (VO, VCl2) dans d’autres il a une valence de 3 (V2O3, VCl3), dans d’autres encore il a une valence de 4 (VO2, VCl4), et dans au moins un cas (V2O5) il a une valence de 5. La chimie des métaux de transition est plus compliquée et une plus grande variété de formules pour les composés des métaux de transition est possible en raison de cette valence variable. Dans certains cas, les électrons des sous-coquilles d jouent le rôle d’électrons de valence, alors que dans d’autres cas, ils ne le font pas. Bien que les nuages électroniques 3d ne s’étendent pas plus loin du noyau que 3s et 3p (et ne constituent donc pas une autre enveloppe comme les électrons 4s), ils sont parfaitement protégés de la charge nucléaire et agissent donc souvent comme des électrons de valence. Ce comportement Jekyll et Hyde des électrons 3d rend la vie plus compliquée (et souvent bien plus intéressante) pour les chimistes qui étudient les éléments de transition.
| Z | Elément | Configuration | |
|---|---|---|---|
| 1 | H | 1s 1 | |
| 2 | He | 1s 2 | |
| 3 | Li | 2s 1 | |
| 4 | Be | 2s 2 | |
| 5 | B | 2s 2 2p1 | |
| 6 | C | 2s 2 2p2 | |
| 7 | N | 2s 2 2p3 | |
| 8 | 0 | 2s 2 2p4 | |
| 9 | F | 2s 2 2p5 | |
| 10 | Ne | 2s 2 2p6 | |
| 11 | Na | 3s 1 | |
| 12 | Mg | 3s 2 | |
| 13 | Al | 3s 2 3p1 | |
| 14 | Si | 3s 2 3p2 | |
| 15 | P | 3s 2 3p3 | |
| 16 | S | 3s 2 3p4 | |
| 17 | Cl | 3s 2 3p5 | |
| 18 | Ar | 3s 2 3p6 | |
| 19 | K | 4s 1 | |
| 20 | Ca | 4s 2 | |
| 21 | Sc | 3d 1 4s 2 | |
| 22 | Ti | 3d 2 4s 2 | |
| 23 | V | 3d 3 4s 2 | |
| 24 | Cr | 3d 5 4s 1 | |
| 25 | Mn | 3d 5 4s 2 | |
| 26 | Fe | 3d 6 4s 2 | |
| 27 | Co | 3d 7 4s 2 | |
| 28 | Ni | 3d 8 4s 2 | |
| 29 | Cu | 3d 10 4s 1 | |
| 30 | Zn | 3d 10 4s 2 | |
| 31 | Ga | 3d 10 4s 2 4p 1 | |
| 32 | Ge | 3d 10 4s 2 4p 2 | |
| 33 | . As | 3d 10 4s 2 4p 3 | |
| 34 | Se | 3d 10 4s 2 4p 4 | |
| 35 | Br | 3d 10 4s 2 4p 5 | |
| 36 | Kr | 3d 10 4s 2 4p 6 | |
| 37 | Rb | 5s 1 | |
| 38 | Sr | 5s 2 | |
| 39 | Y | 4d 1 5s 2 | |
| 40 | Zr | 4d 2 5s 2 | |
| 41 | Nb | 4d 4 5s 1 | |
| 42 | Mo | 4d 5 5s 1 | |
| 43 | Tc | 4d 5 5s 2 | |
| 44 | Ru | 4d 7 5s 1 | |
| 45 | Rh | 4d 8 5s 1 | |
| 46 | Pd | 4d 10 | |
| 47 | Ag | 4d 10 5s 1 | |
| 48 | Cd | 4d 10 5s 2 | |
| 49 | In | 4d 10 5s 2 5p 1 | |
| 50 | Sn | 4d 10 5s 2 5p 2 | |
| 51 | Sb | 4d 10 5s 2 5p 3 | |
| 52 | Te | 4d 10 5s 2 5p 4 | |
| 53 | I | 4d 10 5s 2 5p 5 | |
| 54 | Xe | 4d 10 5s 2 5p 6 | |
| 55 | Cs | 6s 1 | |
| 56 | Ba | 6s 2 | |
| 57 | La | 5d 1 6s 2 | |
| 58 | Ce | 4f 1 5d 1 6s 2 | |
| 59 | Pr | 4f 3 6s 2 | |
| 60 | Nd | 4f 4 6s 2 | |
| 61 | Pm | 4f 5 6s 2 | |
| 62 | Sm | 4f 6 6s 2 | |
| 63 | Eu | 4f 7 6s 2 | |
| 64 | Gd | 4f 7 5d 1 6s 2 | |
| 65 | Tb | 4f 9 6s 2 | |
| 66 | Dy | 4f 10 6s 2 | |
| 67 | Ho | 4f 11 6s 2 | |
| 68 | Er | 4f 12 6s 2 | |
| 69 | Tm | 4f 13 6s 2 | |
| 70 | Yb | 4f 14 6s 2 | |
| 71 | Lu | 4f 14 5d 1 6s 2 | |
| 72 | Hf | 4f 14 5d 2 6s 2 | |
| 73 | Ta | 4f 14 5d 3 6s 2 | |
| 74 | W | 4f 14 5d 4 6s 2 | |
| 75 | Re | 4f 14 5d 5 6s 2 | |
| 76 | 0s | 4f 14 5d 6 6s 2 | |
| 77 | Ir | 4f 14 5d 7 6s 2 | |
| 78 | Pt | 4f 14 5d 9 6s 1 | |
| 79 | Au | 4f 14 5d 10 6s 1 | |
| 80 | Hg | 4f 14 5d 10 6s 2 | |
| 81 | Tl | 4f 14 5d 10 6s 2 6p1 | |
| 82 | Pb | 4f 14 5d 10 6s 2 6p2 | |
| 83 | Bi | 4f 14 5d 10 6s 2 6p 3 | |
| 84 | Po | 4f 14 5d 10 6s 2 6p 4 | |
| 85 | At | 4f 14 5d 10 6s 2 6p 5 | |
| 86 | Rn | 4f 14 5d 10 6s 2 6p 6 | |
| 87 | . Fr | 7s 1 | |
| 88 | Ra | 7s 2 | |
| 89 | Ac | 6d 1 7s 2 | |
| 90 | Th | 6d 2 7s 2 | |
| 91 | Pa | 5f 2 6d 1 7s 2 | |
| 92 | U | 5f 3 6d 1 7s 2 | |
| 93 | Np | 5f 4 6d 1 7s 2 | |
| 94 | Pu | 5f 6 7s 2 | |
| 95 | Am | 5f 7 7s 2 | |
| 96 | Cm | 5f 7 6d 1 s 2 | |
| 97 | Bk | 5f 9 s 2 | |
| 98 | Cf | 5f 10 s 2 | |
| 99 | Es | 5f 11 s 2 | |
| 100 | Fm | 5f 12 s 2 | |
| 101 | Md | 5f 13 s 2 | |
| 102 | No | 5f 14 s 2 | |
| 103 | Lr | 5f 14 6d 1 s 2 | |
| 104 | Rf | 5f 14 6d 2 s 2 |
La troisième grande catégorie d’éléments se présente lorsque l’électron distinctif occupe une sous-coquille f. Le premier exemple est celui des lanthanoïdes (éléments dont le numéro atomique est compris entre 57 et 71), qui ont la configuration électronique générale suivante : 4d104f i5s25p65d0 ou 16s2
où i est un nombre compris entre 0 et 14. Ainsi, dans le processus de construction des lanthanoïdes, des électrons sont ajoutés à une sous-coquille (4f) dont le nombre quantique principal est inférieur de deux à celui de l’orbitale la plus externe (6s). L’ajout d’un autre électron à une coquille interne enfouie aussi profondément que la 4f a peu ou pas d’effet sur les propriétés chimiques de ces éléments. Tous ces éléments sont assez semblables au lanthane (La) et pourraient occuper exactement la même place que ce dernier dans le tableau périodique. Les éléments lanthanoïdes sont si semblables les uns aux autres que des techniques spéciales sont nécessaires pour les séparer. Par conséquent, même des échantillons approximativement purs de la plupart d’entre eux n’ont pas été préparés avant les années 1870. Après l’élément actinium (Ac), on trouve une série d’atomes dans lesquels la sous-coquille 5f est remplie. Les actinoïdes sont un peu moins semblables à l’Ac que les lanthanoïdes ne le sont au La, car certaines exceptions à l’ordre habituel des orbitales de remplissage se produisent dans le cas de Th, Pa et U (Tableau \(\PageIndex{1}\) ).
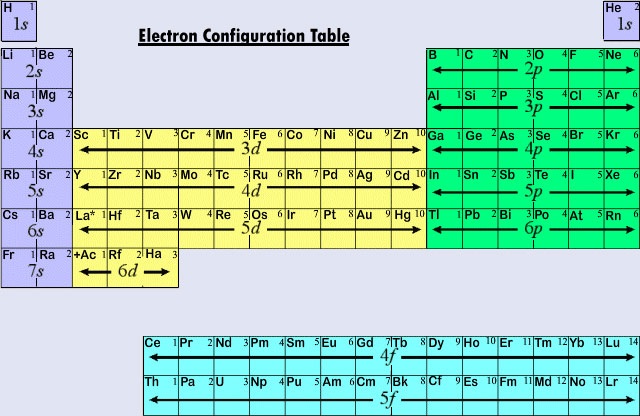
Parce que les lanthanoïdes et la plupart des actinoïdes se comportent chimiquement comme s’ils devaient correspondre au groupe IIIB du tableau périodique (où Lu et Lr se trouvent), les deux groupes sont séparés du reste du tableau et placés ensemble dans un bloc ci-dessous. Pris ensemble, les lanthanoïdes et les actinoïdes sont appelés éléments de transition internes parce que les sous-coquilles f remplies se trouvent si profondément dans la structure électronique restante de leurs atomes.
La figure \(\PageIndex{2}\) résume le type de sous-coquille dans laquelle l’électron distinctif doit être trouvé pour les atomes des éléments dans diverses régions du tableau périodique. Grâce à ces informations sommaires, il est relativement simple d’utiliser le tableau périodique pour obtenir des configurations électroniques, comme le montre l’exemple suivant.
Exemple \(\PageIndex{1}\) : Configuration électronique
Obtenir la configuration électronique pour (a) Nb ; (b) Pr.
Solution
a) Nb, élément numéro 41, se trouve dans la cinquième période et dans une région du tableau périodique où une sous-coquille d se remplit (la deuxième série de transition). En reculant (vers les numéros atomiques inférieurs) dans le tableau périodique, le gaz noble le plus proche est Kr, et nous utilisons donc le noyau Kr :
Nb _____
L’élément suivant après 36K est 37Rb dans lequel la sous coquille 5s se remplit. En se déplaçant vers la droite d’un espace supplémentaire, on arrive à 38Sr qui a une paire 5s2. Jusqu’à présent, nous avons Nb _____ 5s2 pour la configuration Nb. Nous nous déplaçons maintenant plus à droite dans la région de la sous coquille 4d du tableau périodique et comptons sur trois espaces (Y, Zr, Nb) pour atteindre Nb. La configuration électronique totale est donc Nb 4d35s2 (notez que le nombre quantique principal de la sous-coquille d est 4 – un de moins que le nombre de la période. De plus, si vous regardez le tableau des configurations électroniques, il faut noter que Nb est une exception aux règles typiques de remplissage des orbitales) b) Une procédure similaire est suivie pour le Pr, élément numéro 59. En remontant dans le tableau, le gaz noble le plus proche est Xe, et nous utilisons donc le noyau Xe. En comptant à nouveau vers l’avant, Cs et Ba correspondent à 6s2. Puis La, Ce et Pr correspondent à trois électrons supplémentaires dans la sous-couche 4f. La configuration est donc Pr…4f36s2
Il faut souligner un autre point concernant la relation entre la configuration électronique et le tableau périodique. Les atomes des éléments de la même colonne verticale du tableau ont des configurations électroniques similaires. Par exemple, considérons les éléments alcalino-terreux (groupe IIA). En utilisant nos règles pour dériver les configurations électroniques (exemple 1), nous avons
| Élément | Configuration électronique | Diagramme de Lewis |
|---|---|---|
| Be | 2s2 | Be : |
| Mg | 3s2 | Mg : |
| Ca | 4s2 | Ca : |
| Sr | 5s2 | Sr : |
| Ba | 6s2 | Ba : |
| Ra | 7s2 | Ra : |
Ainsi, les similitudes de comportement chimique et de valence notées précédemment pour ces éléments sont corrélées aux similitudes de leurs nuages électroniques les plus externes. De telles similitudes expliquent le succès des prédictions de Mendeleïev sur les propriétés des éléments non découverts.
Contributeurs et attributions
-
Ed Vitz (Université de Kutztown), John W. Moore (UW-Madison), Justin Shorb (Hope College), Xavier Prat-Resina (Université du Minnesota Rochester), Tim Wendorff et Adam Hahn.
