Objectifs d’apprentissage
- Décrire les composants impliqués dans une contraction musculaire
- Expliquer la façon dont les muscles se contractent et se détendent
- Décrire le modèle des filaments coulissants de la contraction musculaire
La séquence d’événements qui aboutit à la contraction d’une fibre musculaire individuelle commence par un signal – le neurotransmetteur, ACh- provenant du motoneurone innervant cette fibre. La membrane locale de la fibre se dépolarise lorsque des ions sodium (Na+) chargés positivement y pénètrent, ce qui déclenche un potentiel d’action qui se propage au reste de la membrane qui se dépolarise, y compris les tubules T. Cela déclenche la libération d’ions calcium dans l’organisme. Cela déclenche la libération d’ions calcium (Ca++) stockés dans le réticulum sarcoplasmique (RS). Le Ca++ déclenche alors la contraction, qui est soutenue par l’ATP (figure 1). Tant que les ions Ca++ restent dans le sarcoplasme pour se lier à la troponine, ce qui maintient les sites de liaison à l’actine » non blindés « , et tant que l’ATP est disponible pour entraîner le cycle des ponts croisés et la traction des brins d’actine par la myosine, la fibre musculaire continuera à se raccourcir jusqu’à une limite anatomique.

Figure 1. Contraction d’une fibre musculaire. Un pont croisé se forme entre l’actine et les têtes de myosine déclenchant la contraction. Tant que les ions Ca++ restent dans le sarcoplasme pour se lier à la troponine, et tant que l’ATP est disponible, la fibre musculaire continue à se raccourcir.
La contraction musculaire s’arrête généralement lorsque la signalisation du motoneurone prend fin, ce qui repolarise le sarcolemme et les tubules T, et ferme les canaux calciques voltage-dépendants dans le SR. Les ions Ca++ sont alors repompés dans le SR, ce qui amène la tropomyosine à recouvrir (ou recouvrir à nouveau) les sites de liaison sur les brins d’actine. Un muscle peut également cesser de se contracter lorsqu’il manque d’ATP et se fatigue (figure 2).

Figure 2. Relaxation d’une fibre musculaire. Les ions Ca++ sont pompés à nouveau dans le SR, ce qui amène la tropomyosine à recouvrir les sites de liaison sur les brins d’actine. Un muscle peut également cesser de se contracter lorsqu’il manque d’ATP et se fatigue.
Les événements moléculaires du raccourcissement des fibres musculaires se produisent à l’intérieur des sarcomères de la fibre (voir figure 3). La contraction d’une fibre musculaire striée se produit lorsque les sarcomères, disposés linéairement au sein des myofibrilles, se raccourcissent lorsque les têtes de myosine tirent sur les filaments d’actine.
La région où les filaments épais et minces se chevauchent a un aspect dense, car il y a peu d’espace entre les filaments. Cette zone où les filaments minces et épais se chevauchent est très importante pour la contraction musculaire, car c’est le site où le mouvement des filaments commence. Les filaments minces, ancrés à leurs extrémités par les disques Z, ne s’étendent pas complètement dans la région centrale qui ne contient que des filaments épais, ancrés à leurs bases à un endroit appelé ligne M. Une myofibrille est composée de nombreux sarcomères qui courent sur toute sa longueur ; ainsi, les myofibrilles et les cellules musculaires se contractent au fur et à mesure que les sarcomères se contractent.
Le modèle des filaments glissants de la contraction
Lorsqu’elle est signalée par un motoneurone, une fibre musculaire squelettique se contracte au fur et à mesure que les filaments fins sont tirés puis glissent au-delà des filaments épais à l’intérieur des sarcomères de la fibre. Ce processus est connu sous le nom de modèle de contraction musculaire à filaments coulissants (figure 3). Le glissement ne peut se produire que lorsque les sites de liaison à la myosine sur les filaments d’actine sont exposés par une série d’étapes qui commencent par l’entrée de Ca++ dans le sarcoplasme.

Figure 3. Le modèle du filament glissant de la contraction musculaire. Lorsqu’un sarcomère se contracte, les lignes Z se rapprochent et la bande I devient plus petite. La bande A conserve la même largeur. À pleine contraction, les filaments fins et épais se chevauchent.
La troomyosine est une protéine qui s’enroule autour des chaînes du filament d’actine et recouvre les sites de liaison de la myosine pour empêcher l’actine de se lier à la myosine. La tropomyosine se lie à la troponine pour former un complexe troponine-tropomyosine. Le complexe troponine-tropomyosine empêche les « têtes » de myosine de se lier aux sites actifs des microfilaments d’actine. La troponine possède également un site de liaison pour les ions Ca++.
Pour initier la contraction musculaire, la tropomyosine doit exposer le site de liaison à la myosine sur un filament d’actine pour permettre la formation de ponts croisés entre les microfilaments d’actine et de myosine. La première étape du processus de contraction consiste à ce que le Ca++ se lie à la troponine afin que la tropomyosine puisse s’éloigner des sites de liaison sur les brins d’actine. Cela permet aux têtes de myosine de se lier à ces sites de liaison exposés et de former des ponts croisés. Les filaments fins sont alors tirés par les têtes de myosine pour glisser au-delà des filaments épais vers le centre du sarcomère. Mais chaque tête ne peut tirer que sur une très courte distance avant d’avoir atteint sa limite et doit être « re-cockée » avant de pouvoir tirer à nouveau, une étape qui nécessite de l’ATP.
ATP et contraction musculaire
Pour que les filaments minces continuent à glisser devant les filaments épais pendant la contraction musculaire, les têtes de myosine doivent tirer l’actine au niveau des sites de liaison, se détacher, se re-cocker, se fixer à d’autres sites de liaison, tirer, se détacher, se re-cocker, etc. Ce mouvement répété est connu sous le nom de cycle des ponts croisés. Ce mouvement répété est connu sous le nom de cycle de pontage croisé. Ce mouvement des têtes de myosine est similaire à celui des avirons lorsqu’un individu rame sur un bateau : La pagaie des avirons (les têtes de myosine) tire, est soulevée de l’eau (détachement), repositionnée (ré-arrimage), puis immergée à nouveau pour tirer (figure 4). Chaque cycle nécessite de l’énergie, et l’action des têtes de myosine dans les sarcomères tirant de façon répétitive sur les filaments fins nécessite également de l’énergie, qui est fournie par l’ATP.
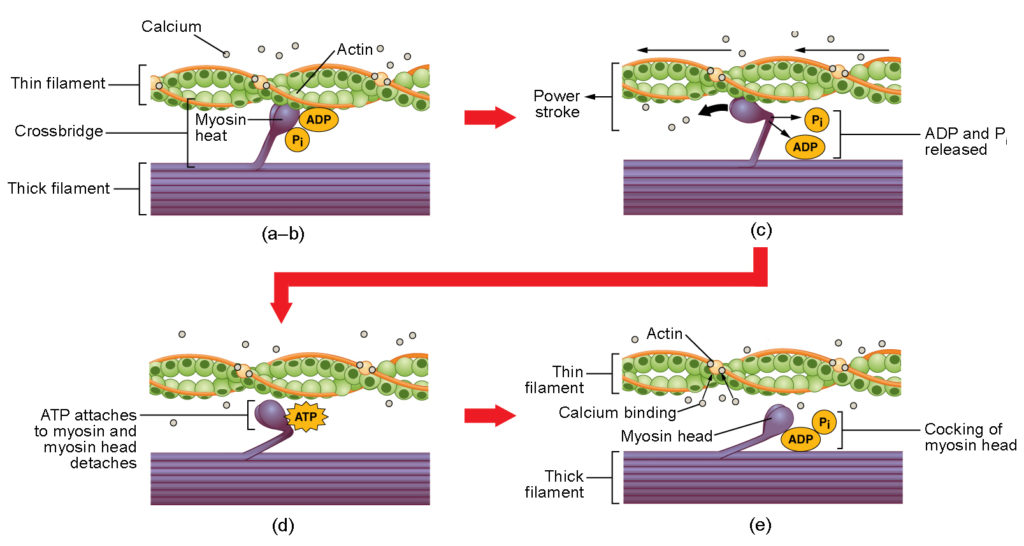
Figure 4. Contraction des muscles squelettiques. (a) Le site actif sur l’actine est exposé lorsque le calcium se lie à la troponine. (b) La tête de la myosine est attirée par l’actine, et la myosine se lie à l’actine au niveau de son site de liaison à l’actine, formant le pont croisé. (c) Pendant le coup de force, le phosphate généré lors du cycle de contraction précédent est libéré. La tête de la myosine pivote alors vers le centre du sarcomère, après quoi l’ADP et le groupe phosphate attachés sont libérés. (d) Une nouvelle molécule d’ATP s’attache à la tête de la myosine, provoquant le détachement du pont croisé. (e) La tête de la myosine hydrolyse l’ATP en ADP et en phosphate, ce qui ramène la myosine en position armée.
La formation du pont croisé se produit lorsque la tête de la myosine se fixe à l’actine alors que l’adénosine diphosphate (ADP) et le phosphate inorganique (Pi) sont encore liés à la myosine (Figure 4a,b). Le Pi est ensuite libéré, ce qui entraîne une fixation plus forte de la myosine à l’actine, après quoi la tête de la myosine se déplace vers la ligne M, entraînant l’actine avec elle. Lorsque l’actine est tirée, les filaments se déplacent d’environ 10 nm vers la ligne M. Ce mouvement est appelé « coup de force ». Ce mouvement est appelé le coup de force, car le mouvement du filament fin se produit à cette étape (figure 4c). En l’absence d’ATP, la tête de myosine ne se détache pas de l’actine.
Une partie de la tête de myosine se fixe au site de liaison sur l’actine, mais la tête possède un autre site de liaison pour l’ATP. La liaison de l’ATP entraîne le détachement de la tête de myosine de l’actine (figure 4d). Après ce détachement, l’ATP est converti en ADP et en Pi par l’activité ATPase intrinsèque de la myosine. L’énergie libérée pendant l’hydrolyse de l’ATP modifie l’angle de la tête de la myosine en une position cockée (Figure 4e). La tête de la myosine est maintenant en position pour un mouvement ultérieur.
Lorsque la tête de la myosine est cockée, la myosine est dans une configuration à haute énergie. Cette énergie est dépensée au fur et à mesure que la tête de la myosine se déplace pendant la course motrice, et à la fin de la course motrice, la tête de la myosine est dans une position à faible énergie. Après le coup de force, l’ADP est libéré, mais le pont croisé formé est toujours en place, et l’actine et la myosine sont liées. Tant que l’ATP est disponible, il se fixe facilement à la myosine, le cycle du pont croisé peut se reproduire et la contraction musculaire peut se poursuivre.
Notez que chaque filament épais d’environ 300 molécules de myosine possède plusieurs têtes de myosine, et que de nombreux ponts croisés se forment et se brisent continuellement pendant la contraction musculaire. Multipliez cela par tous les sarcomères d’une myofibrille, toutes les myofibrilles d’une fibre musculaire et toutes les fibres musculaires d’un muscle squelettique, et vous comprendrez pourquoi tant d’énergie (ATP) est nécessaire pour faire fonctionner les muscles squelettiques. En fait, c’est la perte d’ATP qui entraîne la rigidité cadavérique observée peu après la mort d’une personne. La production d’ATP n’étant plus possible, il n’y a pas d’ATP disponible pour que les têtes de myosine se détachent des sites de liaison à l’actine, de sorte que les ponts croisés restent en place, provoquant la rigidité des muscles squelettiques.
Sources d’ATP
L’ATP fournit l’énergie nécessaire à la contraction musculaire. En plus de son rôle direct dans le cycle des ponts croisés, l’ATP fournit également l’énergie pour les pompes Ca++ à transport actif dans le SR. La contraction musculaire ne peut avoir lieu sans une quantité suffisante d’ATP. La quantité d’ATP stockée dans le muscle est très faible et ne suffit qu’à alimenter des contractions de quelques secondes. Comme il est dégradé, l’ATP doit donc être régénéré et remplacé rapidement pour permettre une contraction soutenue. Il existe trois mécanismes par lesquels l’ATP peut être régénéré : le métabolisme de la créatine phosphate, la glycolyse anaérobie, la fermentation et la respiration aérobie.
La créatine phosphate est une molécule qui peut stocker de l’énergie dans ses liaisons phosphates. Dans un muscle au repos, l’ATP en excès transfère son énergie à la créatine, produisant de l’ADP et du phosphate de créatine. Ce dernier agit comme une réserve d’énergie qui peut être utilisée pour créer rapidement plus d’ATP. Lorsque le muscle commence à se contracter et qu’il a besoin d’énergie, la créatine phosphate retransfère son phosphate à l’ADP pour former de l’ATP et de la créatine. Cette réaction est catalysée par l’enzyme créatine kinase et se produit très rapidement ; ainsi, l’ATP dérivé de la créatine phosphate alimente les premières secondes de la contraction musculaire. Cependant, le phosphate de créatine ne peut fournir qu’environ 15 secondes d’énergie, à partir desquelles une autre source d’énergie doit être utilisée (figure 5).

Figure 5. Métabolisme musculaire. Une partie de l’ATP est stockée dans un muscle au repos. Lorsque la contraction commence, il est utilisé en quelques secondes. Plus d’ATP est généré à partir du phosphate de créatine pendant environ 15 secondes.
Lorsque l’ATP produit par le phosphate de créatine est épuisé, les muscles se tournent vers la glycolyse comme source d’ATP. La glycolyse est un processus anaérobie (non dépendant de l’oxygène) qui décompose le glucose (sucre) pour produire de l’ATP ; cependant, la glycolyse ne peut pas générer de l’ATP aussi rapidement que la créatine phosphate. Le passage à la glycolyse entraîne donc un ralentissement de la disponibilité de l’ATP pour le muscle. Le sucre utilisé dans la glycolyse peut être fourni par le glucose sanguin ou par le métabolisme du glycogène stocké dans le muscle. La dégradation d’une molécule de glucose produit deux ATP et deux molécules d’acide pyruvique, qui peuvent être utilisées dans la respiration aérobie ou, lorsque les niveaux d’oxygène sont faibles, transformées en acide lactique (figure 6).

Figure 6. Glycolyse et respiration aérobie. Chaque molécule de glucose produit deux ATP et deux molécules d’acide pyruvique, qui peuvent être utilisées dans la respiration aérobie ou transformées en acide lactique. Si l’oxygène n’est pas disponible, l’acide pyruvique est converti en acide lactique, ce qui peut contribuer à la fatigue musculaire. Cela se produit lors d’un exercice intense, lorsque de grandes quantités d’énergie sont nécessaires mais que l’oxygène ne peut pas être suffisamment délivré aux muscles.
Si l’oxygène est disponible, l’acide pyruvique est utilisé dans la respiration aérobie. Cependant, si l’oxygène n’est pas disponible, l’acide pyruvique est converti en acide lactique, ce qui peut contribuer à la fatigue musculaire. Cette conversion permet le recyclage de l’enzyme NAD+ à partir du NADH, qui est nécessaire à la poursuite de la glycolyse. Cela se produit lors d’un exercice intense, lorsque de grandes quantités d’énergie sont nécessaires mais que l’oxygène ne peut pas être suffisamment acheminé vers les muscles. La glycolyse elle-même ne peut pas être maintenue pendant très longtemps (environ 1 minute d’activité musculaire), mais elle est utile pour faciliter de courtes poussées d’activité de haute intensité. En effet, la glycolyse n’utilise pas le glucose très efficacement, produisant un gain net de deux ATP par molécule de glucose, et le produit final de l’acide lactique, qui peut contribuer à la fatigue musculaire lorsqu’il s’accumule.
La respiration aérobie est la décomposition du glucose ou d’autres nutriments en présence d’oxygène (O2) pour produire du dioxyde de carbone, de l’eau et de l’ATP. Environ 95 % de l’ATP nécessaire aux muscles au repos ou modérément actifs est fourni par la respiration aérobie, qui a lieu dans les mitochondries. Les intrants de la respiration aérobie sont le glucose circulant dans le sang, l’acide pyruvique et les acides gras. La respiration aérobie est beaucoup plus efficace que la glycolyse anaérobie, produisant environ 36 ATP par molécule de glucose contre quatre pour la glycolyse. Cependant, la respiration aérobie ne peut être maintenue sans un apport régulier d’O2 au muscle squelettique et est beaucoup plus lente (figure 7). Pour compenser, les muscles stockent une petite quantité d’oxygène excédentaire dans des protéines appelées myoglobine, ce qui permet des contractions musculaires plus efficaces et une moindre fatigue. L’entraînement aérobie augmente également l’efficacité du système circulatoire de sorte que l’O2 peut être fourni aux muscles pendant de plus longues périodes.

Figure 7. La respiration cellulaire. La respiration aérobie est la dégradation du glucose en présence d’oxygène (O2) pour produire du dioxyde de carbone, de l’eau et de l’ATP. Environ 95 % de l’ATP nécessaire aux muscles au repos ou modérément actifs est fourni par la respiration aérobie, qui a lieu dans les mitochondries.
La fatigue musculaire survient lorsqu’un muscle ne peut plus se contracter en réponse aux signaux du système nerveux. Les causes exactes de la fatigue musculaire ne sont pas entièrement connues, bien que certains facteurs aient été mis en corrélation avec la diminution de la contraction musculaire qui se produit pendant la fatigue. L’ATP est nécessaire à une contraction musculaire normale, et lorsque les réserves d’ATP diminuent, la fonction musculaire peut décliner. Ce facteur peut être plus important lors d’un effort musculaire bref et intense que lors d’un effort soutenu et de faible intensité. L’accumulation d’acide lactique peut abaisser le pH intracellulaire, ce qui affecte l’activité des enzymes et des protéines. Les déséquilibres des niveaux de Na+ et de K+ résultant de la dépolarisation de la membrane peuvent perturber le flux de Ca++ hors du SR. De longues périodes d’exercice soutenu peuvent endommager le SR et le sarcolemme, entraînant une altération de la régulation du Ca++.
Une activité musculaire intense entraîne une dette d’oxygène, c’est-à-dire la quantité d’oxygène nécessaire pour compenser l’ATP produite sans oxygène pendant la contraction musculaire. L’oxygène est nécessaire pour rétablir les niveaux d’ATP et de créatine phosphate, pour convertir l’acide lactique en acide pyruvique et, dans le foie, pour convertir l’acide lactique en glucose ou en glycogène. D’autres systèmes utilisés pendant l’exercice ont également besoin d’oxygène, et tous ces processus combinés entraînent l’augmentation de la fréquence respiratoire qui se produit après l’exercice. Tant que la dette d’oxygène n’a pas été comblée, la consommation d’oxygène est élevée, même après l’arrêt de l’exercice.
Relaxation d’un muscle squelettique
Le relâchement des fibres musculaires squelettiques, et finalement du muscle squelettique, commence par le motoneurone, qui arrête de libérer son signal chimique, l’ACh, dans la synapse au niveau de la NMJ. La fibre musculaire se repolarise, ce qui ferme les portes dans le SR où le Ca++ était libéré. Des pompes actionnées par l’ATP font passer le Ca++ du sarcoplasme vers le SR. Cela entraîne le « re-blindage » des sites de liaison à l’actine sur les filaments fins. Sans la possibilité de former des ponts croisés entre les filaments fins et épais, la fibre musculaire perd sa tension et se détend.
La force musculaire
Le nombre de fibres musculaires squelettiques dans un muscle donné est déterminé génétiquement et ne change pas. La force musculaire est directement liée à la quantité de myofibrilles et de sarcomères dans chaque fibre. Des facteurs, tels que les hormones et le stress (et les stéroïdes anabolisants artificiels), agissant sur le muscle peuvent augmenter la production de sarcomères et de myofibrilles dans les fibres musculaires, un changement appelé hypertrophie, qui se traduit par une augmentation de la masse et du volume d’un muscle squelettique. De même, la diminution de l’utilisation d’un muscle squelettique entraîne une atrophie, où le nombre de sarcomères et de myofibrilles disparaît (mais pas le nombre de fibres musculaires). Il est fréquent qu’un membre plâtré présente des muscles atrophiés lorsque le plâtre est retiré, et certaines maladies, comme la polio, présentent des muscles atrophiés.
Troubles du système musculaire
La dystrophie musculaire de Duchenne (DMD) est un affaiblissement progressif des muscles squelettiques. C’est l’une des nombreuses maladies collectivement désignées sous le nom de « dystrophie musculaire ». La DMD est due à une carence en dystrophine, une protéine qui aide les fins filaments des myofibrilles à se lier au sarcolemme. En l’absence d’une quantité suffisante de dystrophine, les contractions musculaires entraînent une déchirure du sarcolemme, ce qui provoque un afflux de Ca++, entraînant des lésions cellulaires et la dégradation des fibres musculaires. Au fil du temps, à mesure que les dommages musculaires s’accumulent, la masse musculaire est perdue et des déficiences fonctionnelles plus importantes se développent.
La DMD est une maladie héréditaire causée par un chromosome X anormal. Elle affecte principalement les hommes, et elle est généralement diagnostiquée dans la petite enfance. La DMD se manifeste généralement d’abord par des difficultés d’équilibre et de mouvement, puis évolue vers une incapacité à marcher. Elle continue à progresser vers le haut du corps, des extrémités inférieures vers le haut du corps, où elle affecte les muscles responsables de la respiration et de la circulation. Elle entraîne finalement la mort par insuffisance respiratoire, et les personnes atteintes ne dépassent généralement pas la vingtaine.
Comme la DMD est causée par une mutation du gène qui code pour la dystrophine, on a pensé que l’introduction de myoblastes sains chez les patients pourrait être un traitement efficace. Les myoblastes sont les cellules embryonnaires responsables du développement musculaire et, dans l’idéal, ils seraient porteurs de gènes sains capables de produire la dystrophine nécessaire à la contraction normale des muscles. Cette approche s’est avérée largement infructueuse chez l’homme. Une approche récente a consisté à tenter de stimuler la production par le muscle d’utrophine, une protéine similaire à la dystrophine qui pourrait être en mesure d’assumer le rôle de la dystrophine et de prévenir les dommages cellulaires.
Questions d’autocontrôle
Réalisez le quiz ci-dessous pour vérifier votre compréhension de la contraction et de la relaxation des fibres musculaires:
.
