A : LES ACIDES AMINES
BIOCHEMIE – DR. JAKUBOWSKI
Dernière mise à jour : 27/02/16
Buts/objectifs d’apprentissage pour le chapitre 2A : Après le cours et cette lecture, les étudiants seront capables
- d’énoncer la charge sur les chaînes latérales des acides aminés en utilisant l’équation de Henderson Hasselbach et la charge approximative par inspection à tout pH donné
- dessiner les mécanismes et identifier les produits pour la réaction des chaînes latérales nucléophiles Lys et Cys avec des agents de modification chimique communs et étendre cette compréhension aux réactions de His.
- dessiner les mécanismes des réactions d’échange de disulfure pour les sulfhydryls en les utilisant et les nombres d’oxydation pour expliquer les réactions d’oxydoréduction de la cystéine/cystine.
A7. Chimie de la cystine
Deux chaînes latérales de cystine peuvent interagir de manière covalente dans une protéine pour produire un disulfure. Tout comme HOOH (peroxyde d’hydrogène) est plus oxydé que HOH (l’O dans H2O2 a un nombre d’oxydation de 1- alors que l’O dans H2O a un nombre d’oxydation de 2-) , RSSR est la forme oxydée (S nombre d’oxydation 1-) et RSH est la forme réduite (S nombre d’oxydation 2-) des thiols. Là, les nombres d’oxydation sont analogues puisque O et S sont tous deux dans le groupe 6 du tableau périodique et tous deux sont plus électronégatifs que C.
Une revue rapide des réactions d’oxydoréduction et des nombres d’oxydation.
Figure : DISULFURE – CYSTINE – RÉACTIONS
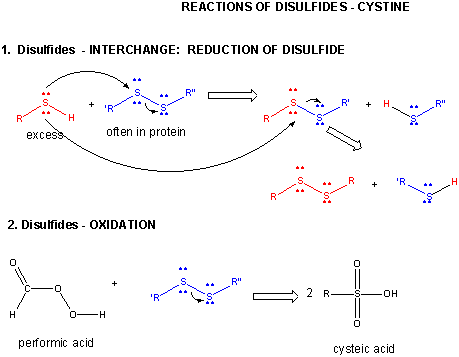
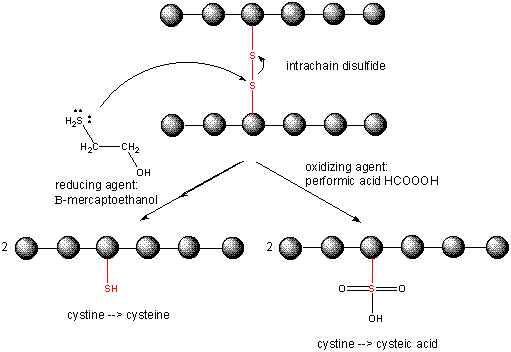
Lorsqu’une protéine se replie, deux chaînes latérales Cys pourraient se rapprocher l’une de l’autre, et former un lien disulfure intra-chaîne. De même, deux chaînes latérales Cys sur des protéines distinctes pourraient s’approcher l’une de l’autre et former un disulfure inter-chaîne. De tels disulfures doivent être clivés, et les chaînes séparées avant d’analyser la séquence de la protéine. Le disulfure dans la protéine peut être clivé par des agents réducteurs tels que le bêta-mercaptoéthanol,le dithiothréitol, la tris (2-carboxyéthyl) phosphine (TCEP) ou des agents oxydants qui oxydent encore le disulfure pour séparer les acides cystéiques.
Figure : Agents oxydants des disulfures – b-mercaptoéthanol, dithiothréitol et phosphines
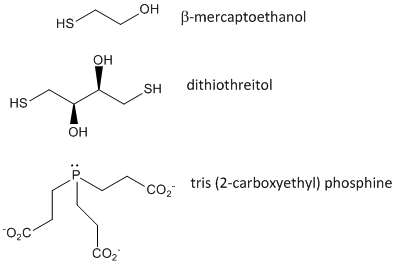
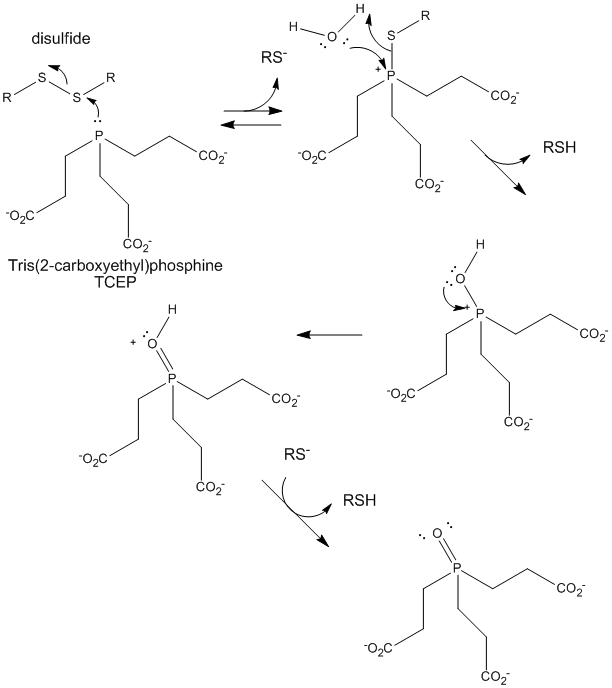
Figure : Réduction des disulfures par le TCEP
L’intérieur des cellules est maintenu dans un environnement réduit par la présence de nombreux agents « réducteurs », comme le tripeptide g-glu-cys-gly (glutathion). Par conséquent, les protéines intracellulaires ne contiennent généralement pas de disulfures, qui sont abondants dans les protéines extracellulaires (comme celles que l’on trouve dans le sang) ou dans certains organites comme le réticulum endoplasmique et l’espace intermembranaire mitochondrial où des disulfuresc peuvent être introduits.
Figure :
La rupture des liaisons disulfures dans les protéines
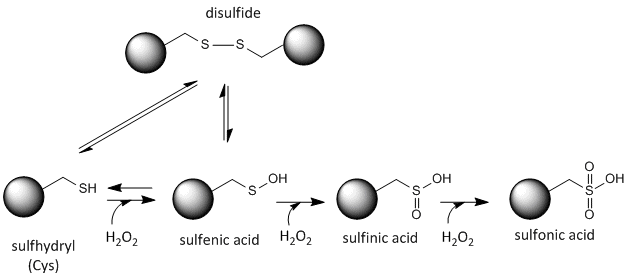
La chimie redox de la cystéine
Le soufre de la cystéine est redox-actif et peut donc exister dans une grande variété d’états, selon l’environnement redox local et la présence d’agents oxydants et réducteurs. Le peroxyde d’hydrogène est un agent oxydant puissant qui peut être produit dans les cellules, ce qui peut entraîner des modifications chimiques plus radicales et irréversibles des chaînes latérales de la cystéine. Si une Cys réactive est importante pour la fonction de la protéine, alors la fonction de la protéine peut être modulée (parfois de manière réversible, parfois de manière irréversible) avec divers agents oxydants, comme le montre la figure ci-dessous.
Figure:État rédox de la cystéine
Navigation
Retour auChapitre 2A : Sections des acides aminés
Retour à la table des matières de la biochimie en ligne
Version archivée duChapitre 2A : Acides aminés
complet.
