![]()
Les personnes utilisant une technologie d’assistance peuvent ne pas être en mesure d’accéder pleinement aux informations contenues dans ce fichier. Pour obtenir de l’aide, veuillez envoyer un courriel à : [email protected]. Tapez 508 Accommodation et le titre du rapport dans la ligne d’objet du courriel.
![]() PDF
PDF
Le Comité consultatif sur les pratiques d’immunisation (ACIP) révise chaque année le calendrier de vaccination recommandé pour les adultes afin de s’assurer que le calendrier reflète les recommandations actuelles pour l’utilisation des vaccins homologués. En juin 2005, l’ACIP a approuvé le calendrier de vaccination des adultes pour la période octobre 2005-septembre 2006. Ce calendrier a également été approuvé par l’American Academy of Family Physicians et l’American College of Obstetricians and Gynecologists.
Modifications du calendrier pour octobre 2005-septembre 2006
Le calendrier 2005–2006 diffère du calendrier précédent comme suit :
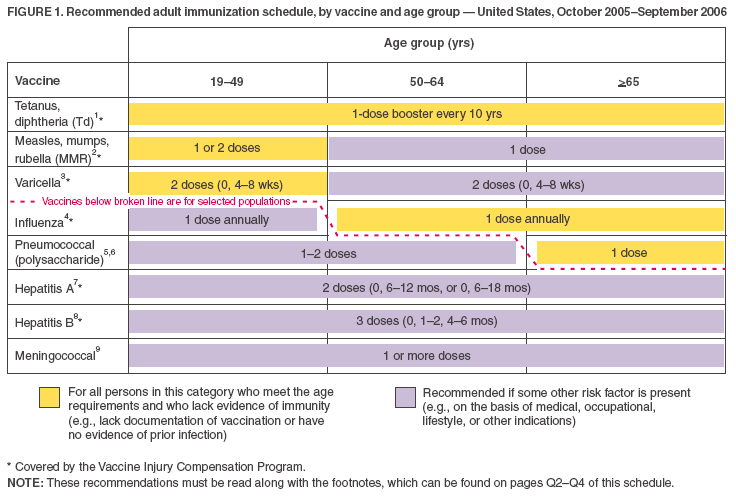
- Les vaccins figurant sur le calendrier basé sur l’âge (figure 1) sont affichés de façon à ce que les vaccins recommandés pour un usage systématique puissent être différenciés de ceux recommandés pour les adultes présentant certains indicateurs de risque (semblable au calendrier de vaccination des enfants). Cela est illustré à la fois par le jeu de couleurs et par la ligne brisée.
- Les barres jaunes (« Pour toutes les personnes de ce groupe ») et les barres vertes (« Pour les personnes dépourvues de documentation de vaccination ou de preuve de maladie ») du calendrier précédent ont été fusionnées en une seule barre jaune, qui se lit désormais comme suit : « Pour toutes les personnes de cette catégorie qui répondent aux critères d’âge et qui ne présentent pas de preuve d’immunité (par ex,
- La barre violette a été modifiée de « Pour les personnes à risque (par exemple, avec des indications médicales ou d’exposition) » à « Recommandé si un autre facteur de risque est présent (par exemple, sur la base d’indications médicales, professionnelles, de style de vie ou autres) ». La barre violette a été ajoutée aux colonnes des groupes d’âge 50–64 ans et >65 ans pour le vaccin contre la rougeole, les oreillons et la rubéole (ROR).
- La colonne « Diabète, maladie cardiaque, maladie pulmonaire chronique ou maladie hépatique chronique, y compris l’alcoolisme chronique » a été transposée avec la colonne « Immunodéficience congénitale, leucémie, lymphome, tumeur maligne généralisée, thérapie avec des agents alkylants, des antimétabolites, des fuites de liquide céphalorachidien, des radiations ou de grandes quantités de corticostéroïdes » sur le tableau des indications médicales/autres (figure 2) afin que les contre-indications des vaccins ROR et varicelle soient maintenant côte à côte.
- La rangée pour le vaccin contre la varicelle a été déplacée vers le haut sur les deux figures (c’est-à-dire, à immédiatement après le vaccin ROR) parce que le vaccin est maintenant universellement recommandé pour certains groupes d’âge.
- Le vaccin contre le méningocoque a été ajouté au calendrier des indications médicales/autres (figure 2). La note de bas de page a été révisée pour intégrer les recommandations de l’ACIP récemment publiées pour ce vaccin (1).
- La note de bas de page sur le tétanos et la diphtérie (#1) a été reformulée.
- La note de bas de page sur la varicelle (#3) a été reformulée conformément aux recommandations de l’ACIP adoptées en juin 2005.
- La note de bas de page sur la grippe (#4) a été révisée pour ajouter la plus récente condition à haut risque : les conditions neuromusculaires qui compromettent la fonction respiratoire (2).
- Une 10e note de bas de page a été ajoutée concernant la vaccination contre l’Haemophilus influenzae de type b pour les populations à haut risque (c’est-à-dire, les personnes atteintes d’asplénie, de leucémie et d’infection par le virus de l’immunodéficience humaine).
Le calendrier de vaccination des adultes est disponible en anglais et en espagnol à http://www.cdc.gov/nip/recs/adult-schedule.htm. Des informations générales sur la vaccination des adultes, y compris des recommandations concernant la vaccination des personnes atteintes du VIH et d’autres affections immunosuppressives, sont disponibles auprès des services de santé des États et des collectivités locales et auprès du Programme national d’immunisation à l’adresse http://www.cdc.gov/nip. Les déclarations d’information sur les vaccins sont disponibles sur le site http://www.cdc.gov/nip/publications/vis. Les déclarations de l’ACIP pour chaque vaccin recommandé peuvent être consultées, téléchargées et imprimées sur le site Web du National Immunization Program à l’adresse http://www.cdc.gov/nip/publications/acip-list.htm. Les instructions pour signaler les effets indésirables au système de déclaration des effets indésirables des vaccins sont disponibles à http://www.vaers.hhs.gov ou par téléphone, 800-822-7967.
- CDC. Prévention et contrôle des maladies à méningocoques : recommandations du Comité consultatif pour les pratiques de vaccination (ACIP). MMWR 2005;54(No. RR-7).
- CDC. Prévention et contrôle de la grippe : recommandations du Comité consultatif pour les pratiques d’immunisation (ACIP). MMWR 2005;54(No. RR-8).
Figure 1
Retour en haut.
Figure 2

Retour en haut.
Approuvé par le Comité consultatif sur les pratiques d’immunisation, le Collège américain des obstétriciens et gynécologues et l’Académie américaine des médecins de famille
1. Vaccination contre le tétanos et la diphtérie (Td). Les adultes ayant des antécédents incertains d’une série complète de primovaccination avec des vaccins contenant de l’anatoxine diphtérique et tétanique doivent recevoir une série de primovaccination utilisant l’anatoxine Td combinée. Une série de primovaccination pour les adultes comprend 3 doses ; les 2 premières doses doivent être administrées à au moins 4 semaines d’intervalle et la troisième dose 6 à 12 mois après la seconde. Administrer 1 dose si la personne a reçu la série primaire et si la dernière vaccination a été reçue >10 ans auparavant. Consulter la déclaration de l’ACIP pour les recommandations concernant l’administration du Td en prophylaxie dans le cadre du traitement des plaies (http://www.cdc.gov/mmwr/preview/mmwrhtml/00041645.htm). L’American College of Physicians Task Force on Adult Immunization soutient une deuxième option pour l’utilisation du Td chez les adultes : un seul rappel de Td à l’âge de 50 ans pour les personnes qui ont terminé la série pédiatrique complète, y compris le rappel pour les adolescents/jeunes adultes. Un vaccin contre le tétanos, la diphtérie et la coqueluche aciculaire récemment homologué est disponible pour les adultes. Les recommandations de l’ACIP concernant son utilisation seront publiées.
2. vaccination contre la rougeole, les oreillons et la rubéole (ROR). Composante rougeole : les adultes nés avant 1957 peuvent être considérés comme immunisés contre la rougeole. Les adultes nés pendant ou après 1957 doivent recevoir >1 dose de ROR à moins qu’ils n’aient une contre-indication médicale, une documentation de >1 dose, des antécédents de rougeole basés sur le diagnostic d’un fournisseur de soins de santé ou une preuve d’immunité en laboratoire. Une deuxième dose de ROR est recommandée pour les adultes qui 1) ont été récemment exposés à la rougeole ou dans le cadre d’une épidémie ; 2) ont déjà été vaccinés avec un vaccin antirougeoleux tué ; 3) ont été vaccinés avec un type inconnu de vaccin antirougeoleux entre 1963 et 1967 ; 4) sont étudiants dans des établissements d’enseignement postsecondaire ; 5) travaillent dans un établissement de soins de santé ; ou 6) prévoient voyager à l’étranger. Ne pas administrer le vaccin ROR ou d’autres vaccins contenant la rougeole aux personnes infectées par le VIH et présentant une immunosuppression grave. Composante oreillons : 1 dose de vaccin ROR devrait suffire à protéger les personnes nées pendant ou après 1957 qui n’ont pas d’antécédents d’oreillons selon le diagnostic d’un professionnel de la santé ou qui n’ont pas de preuve d’immunité en laboratoire. Composante rubéole : administrer une dose de vaccin ROR aux femmes dont les antécédents de vaccination contre la rubéole ne sont pas fiables ou qui n’ont pas de preuve d’immunité en laboratoire. Pour les femmes en âge de procréer, quelle que soit leur année de naissance, déterminer systématiquement l’immunité contre la rubéole et conseiller les femmes concernant le syndrome de rubéole congénitale. Ne pas vacciner les femmes qui sont enceintes ou qui pourraient le devenir dans les 4 semaines suivant l’administration du vaccin. Les femmes qui n’ont pas de preuve d’immunité devraient recevoir le vaccin ROR à la fin ou à l’arrêt de la grossesse et avant de quitter l’établissement de soins de santé.
3. Vaccination contre la varicelle. La vaccination contre la varicelle est recommandée pour tous les adultes sans preuve d’immunité contre la varicelle. Une attention particulière doit être accordée aux personnes qui 1) ont des contacts étroits avec des personnes à haut risque de maladie grave (travailleurs de la santé et contacts familiaux de personnes immunodéprimées) ou 2) sont à haut risque d’exposition ou de transmission (par exemple, les enseignants de jeunes enfants, les employés des services de garde d’enfants, les résidents et les membres du personnel des établissements institutionnels, y compris les établissements correctionnels, les étudiants universitaires, le personnel militaire, les adolescents et les adultes vivant dans des ménages avec des enfants, les femmes non enceintes en âge de procréer et les voyageurs internationaux). La preuve de l’immunité contre la varicelle chez les adultes comprend l’un des éléments suivants : 1) une vaccination contre la varicelle documentée et adaptée à l’âge (c’est-à-dire l’administration d’une dose avant l’âge de 13 ans ou l’administration de deux doses après l’âge de 13 ans) ; 2) une personne née aux États-Unis avant 1966 ou des antécédents de maladie varicelleuse avant 1966 pour les personnes non nées aux États-Unis ; 3) des antécédents de maladie varicelleuse avant 1966 pour les personnes nées aux États-Unis.3) antécédents de varicelle basés sur le diagnostic d’un prestataire de soins de santé ou sur la déclaration parentale ou personnelle d’une maladie varicelleuse typique pour les personnes nées entre 1966 et 1997 (pour un patient déclarant des antécédents d’un cas atypique et bénin, les prestataires de soins de santé doivent rechercher un lien épidémiologique avec un cas typique de varicelle ou une preuve de confirmation en laboratoire, si celle-ci a été effectuée au moment de la maladie aiguë) ; 4) antécédents d’herpès zoster basés sur le diagnostic d’un prestataire de soins de santé ; ou 5) preuve d’immunité en laboratoire. Ne pas vacciner les femmes qui sont enceintes ou qui pourraient le devenir dans les 4 semaines suivant l’administration du vaccin. Évaluer les femmes enceintes pour vérifier l’immunité contre la varicelle. Les femmes qui n’ont pas de preuve d’immunité doivent recevoir la dose 1 du vaccin contre la varicelle à la fin ou à l’arrêt de la grossesse et avant de quitter l’établissement de santé. La dose 2 doit être administrée 4–8 semaines après la dose 1.
4. vaccination contre la grippe. Indications médicales : troubles chroniques des systèmes cardiovasculaire ou pulmonaire, y compris l’asthme ; maladies métaboliques chroniques, y compris le diabète sucré, le dysfonctionnement rénal, les hémoglobinopathies ou l’immunosuppression (y compris l’immunosuppression causée par des médicaments ou le VIH) ; toute affection (par ex, dysfonctionnement cognitif, lésion de la moelle épinière, trouble convulsif ou autre trouble neuromusculaire) qui compromet la fonction respiratoire ou la manipulation des sécrétions respiratoires ou qui peut augmenter le risque d’aspiration ; et la grossesse pendant la saison grippale. Il n’existe pas de données sur le risque de maladie grippale grave ou compliquée chez les personnes aspléniques ; cependant, la grippe est un facteur de risque d’infections bactériennes secondaires qui peuvent causer une maladie grave chez les personnes aspléniques. Indications professionnelles : personnel soignant et employés des établissements de soins de longue durée et des résidences assistées. Autres indications : résidents des maisons de retraite et autres établissements de soins de longue durée et d’aide à la vie autonome ; personnes susceptibles de transmettre la grippe à des personnes à haut risque (c’est-à-dire contacts familiaux à domicile et personnes s’occupant d’enfants âgés de 0 à 23 mois, ou personnes de tous âges présentant des conditions à haut risque), et toute personne souhaitant être vaccinée. Pour les personnes en bonne santé, non enceintes, âgées de 5 à 49 ans et ne présentant pas de conditions à haut risque, qui ne sont pas des contacts de personnes gravement immunodéprimées dans des unités de soins spéciaux, le vaccin antigrippal administré par voie intranasale (FluMist®) peut être administré à la place du vaccin inactivé.
5. Vaccination antipneumococcique polysaccharidique. Indications médicales : troubles chroniques du système pulmonaire (à l’exclusion de l’asthme) ; maladies cardiovasculaires ; diabète sucré ; maladies chroniques du foie, y compris les maladies du foie résultant d’un abus d’alcool (par exemple, cirrhose) ; insuffisance rénale chronique ou syndrome néphrotique ; asplénie fonctionnelle ou anatomique (par exemple, immunodéficience congénitale, infection par le VIH, leucémie, lymphome, myélome multiple, maladie de Hodgkin, malignité généralisée ou transplantation d’organe ou de moelle osseuse), chimiothérapie avec des agents alkylants, des antimétabolites ou des corticostéroïdes systémiques à long terme, et implants cochléaires. Autres indications : Amérindiens d’Alaska et certaines populations amérindiennes ; résidents de maisons de retraite et autres établissements de soins de longue durée.
6. Revaccination avec le vaccin polysaccharide pneumococcique. Revaccination unique après 5 ans pour les personnes souffrant d’insuffisance rénale chronique ou de syndrome néphritique ; asplénie fonctionnelle ou anatomique (par exemple, drépanocytose ou splénectomie) ; conditions immunosuppressives (par exemple, immunodéficience congénitale, infection par le VIH, leucémie, lymphome, myélome multiple, maladie de Hodgkin, malignité généralisée ou transplantation d’organe ou de moelle osseuse) ; ou chimiothérapie avec des agents alkylants, des antimétabolites ou des corticostéroïdes systémiques à long terme. Pour les personnes âgées de >65 ans, revaccination unique si elles ont été vaccinées >5 ans auparavant et étaient âgées de <65 ans au moment de la primo-vaccination.
7. vaccination contre l’hépatite A. Indications médicales : personnes présentant des troubles du facteur de coagulation ou une maladie hépatique chronique. Indications comportementales : hommes ayant des rapports sexuels avec des hommes ou consommateurs de drogues illicites. Indications professionnelles : Personnes travaillant avec des primates infectés par le virus de l’hépatite A (VHA) ou avec le VHA dans un laboratoire de recherche. Autres indications : les personnes voyageant ou travaillant dans des pays où l’endémicité de l’hépatite A est élevée ou intermédiaire (pour la liste des pays, voirhttp://www.cdc.gov/travel/diseases.htm#hepa) ainsi que toute personne souhaitant obtenir une immunité. Les vaccins actuels doivent être administrés en une série de 2 doses soit à 0 et 6–12 mois, soit à 0 et 6–18 mois. Si le vaccin combiné hépatite A et hépatite B est utilisé, administrer 3 doses à 0, 1 et 6 mois.
8. Vaccination contre l’hépatite B. Indications médicales : patients hémodialysés (utiliser une formulation spéciale ou deux doses de 20-µg/mL) ou patients qui reçoivent des concentrés de facteur de coagulation. Indications professionnelles : travailleurs de la santé et de la sécurité publique qui sont exposés au sang sur leur lieu de travail et personnes en formation dans les écoles de médecine, de dentisterie, d’infirmières, de technologie de laboratoire et autres professions paramédicales. Indications comportementales : utilisateurs de drogues injectables ; personnes ayant eu plus d’un partenaire sexuel au cours des 6 derniers mois ; personnes ayant récemment contracté une maladie sexuellement transmissible (MST) ; et hommes ayant des rapports sexuels avec des hommes. Autres indications : les contacts familiaux et les partenaires sexuels des personnes atteintes d’une infection chronique par le virus de l’hépatite B (VHB) ; les clients et les membres du personnel des institutions pour personnes ayant une déficience intellectuelle ; tous les clients des cliniques de MTS ; les détenus des établissements correctionnels ; et les voyageurs internationaux qui séjourneront dans des pays où la prévalence de l’infection chronique par le VHB est élevée ou intermédiaire pendant plus de 6 mois (pour la liste des pays, voir http://www.cdc.gov/travel/diseases.htm#hepa).
9. Vaccination contre le méningocoque. Indications médicales : adultes présentant une asplénie anatomique ou fonctionnelle ou des déficits en composants du complément terminal. Autres indications : étudiants de première année de collège vivant dans des dortoirs ; microbiologistes qui sont régulièrement exposés à des isolats de Neisseria meningitidis ; recrues militaires ; et les personnes qui voyagent ou résident dans des pays où la méningococcie est hyperendémique ou épidémique (par exemple, la « ceinture de la méningite » de l’Afrique subsaharienne pendant la saison sèche), en particulier si le contact avec les populations locales est prolongé. La vaccination est exigée par le gouvernement d’Arabie Saoudite pour tous les voyageurs se rendant à la Mecque pendant le Hajj annuel. Le vaccin conjugué contre le méningocoque est préférable pour les adultes répondant à l’une des indications ci-dessus et âgés de <55 ans, bien que le vaccin polysaccharidique contre le méningocoque (MPSV4) soit une alternative acceptable. La revaccination après 5 ans pourrait être indiquée pour les adultes précédemment vaccinés avec le MPSV4 qui restent à haut risque d’infection (par exemple, les personnes résidant dans des zones où la maladie est épidémique).
10. Conditions sélectionnées pour lesquelles le vaccin contre Haemophilus influenzae de type b (Hib) peut être utilisé. Les vaccins conjugués Hib sont autorisés pour les enfants âgés de 6 à 71 mois. Il n’existe pas de données d’efficacité sur lesquelles fonder une recommandation concernant l’utilisation du vaccin Hib chez les enfants plus âgés et les adultes souffrant de maladies chroniques associées à un risque accru de maladie Hib. Cependant, des études suggèrent une bonne immunogénicité chez les patients atteints de drépanocytose, de leucémie ou d’infection par le VIH ou qui ont subi une splénectomie ; l’administration du vaccin à ces patients n’est pas contre-indiquée.
Le calendrier de vaccination recommandé pour les adultes a été approuvé par l’Advisory Committee on Immunization Practices, l’American College of Obstetricians and Gynecologists et l’American Academy of Family Physicians. Le format standard des notes de bas de page du MMWR a été modifié pour la publication de ce calendrier.
Citation suggérée : Centres de contrôle et de prévention des maladies. Calendrier de vaccination recommandé pour les adultes–États-Unis, octobre 2005–Septembre 2006. MMWR 2005;54:Q1–Q4.
Ce calendrier indique les groupes d’âge et les indications médicales recommandés pour l’administration systématique des vaccins actuellement homologués pour les personnes âgées de >19 ans. Les vaccins associés homologués peuvent être utilisés chaque fois que l’un des composants de l’association est indiqué et que les autres composants du vaccin ne sont pas contre-indiqués. Pour des recommandations détaillées, consultez les notices des fabricants et les déclarations complètes de l’ACIP (http://www.cdc.gov/nip/publications/acip-list.htm).
Signalez toutes les réactions post-vaccinales cliniquement significatives au Vaccine Adverse Event Reporting System (VAERS). Les formulaires de déclaration et les instructions sur le dépôt d’un rapport VAERS sont disponibles par téléphone, au 800-822-7967, ou sur le site Web du VAERS à l’adresse http://www.vaers.hhs.gov.
Les informations sur la façon de déposer une demande d’indemnisation dans le cadre du Programme d’indemnisation des blessures causées par un vaccin sont disponibles à l’adresse http://www.hrsa.gov/osp/vicp ou par téléphone, au 800-338-2382. Pour déposer une demande d’indemnisation pour un préjudice causé par un vaccin, contactez la U.S. Court of Federal Claims, 717 Madison Place, N.W., Washington, DC 20005, téléphone 202-357-6400.
Des informations supplémentaires sur les vaccins énumérés ci-dessus et les contre-indications à la vaccination sont également disponibles sur le site http://www.cdc.gov/nip ou auprès du CDC-INFO Contact Center au 800-CDC-INFO (232-4636) en anglais et en espagnol, 24 heures sur 24, 7 jours sur 7.
L’utilisation de noms commerciaux et de sources commerciales est faite à des fins d’identification uniquement et n’implique pas l’approbation du Département américain de la santé et des services sociaux.Les références à des sites non-CDC sur Internet sont fournies à titre de service aux lecteurs du MMWR et ne constituent pas ou n’impliquent pas l’approbation de ces organisations ou de leurs programmes par le CDC ou le Département américain de la santé et des services sociaux. Le CDC n’est pas responsable du contenu des pages trouvées sur ces sites. Les adresses URL figurant dans le MMWR étaient à jour à la date de publication.
Disclaimer Toutes les versions HTML des articles du MMWR sont des conversions électroniques de texte ASCII en HTML. Cette conversion peut avoir entraîné des erreurs de traduction de caractères ou de format dans la version HTML. Les utilisateurs ne doivent pas se fier à ce document HTML, mais se référer à la version électronique PDF et/ou à la copie papier originale du MMWR pour le texte, les figures et les tableaux officiels. Une copie papier originale de ce numéro peut être obtenue auprès du Superintendent of Documents, U.S. Government Printing Office (GPO), Washington, DC 20402-9371 ; téléphone : (202) 512-1800. Contactez le GPO pour connaître les prix actuels.
**Les questions ou les messages concernant les erreurs de formatage doivent être adressés à [email protected].
Date de la dernière révision : 10/13/2005
