Lorsqu’un gaz en écoulement régulier passe par une constriction, par exemple dans un orifice ou une vanne, il subit normalement un changement de température. Ceci est en partie dû aux changements de l’énergie cinétique, mais il y a une autre partie contribuée par la non-idéalité du gaz. Si les conduits amont et aval sont suffisamment grands pour que l’énergie cinétique soit négligeable à ces postes, les températures amont et aval sont mesurées suffisamment loin de la perturbation créée par le rétrécissement et le système est adiabatique ; l’effet mesuré est dû à la seule non-idéalité. A partir de la première loi de la thermodynamique, un tel processus est isenthalpique et on peut utilement définir un coefficient de Joule-Thomson comme :
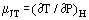
comme une mesure du changement de température qui résulte d’une chute de pression à travers la constriction.
Pour la plupart des gaz réels à peu près aux conditions ambiantes, μ est positif – c’est-à-dire que la température baisse en passant par la constriction. Pour l’hydrogène et l’hélium, il est négatif et la température augmente. À des températures plus élevées, pour la plupart des gaz, μ diminue et peut même devenir négatif.μ peut également devenir négatif par application d’une pression, même à température ambiante, mais des pressions supérieures à 200 bars sont normalement nécessaires pour y parvenir.
.
