Les composés ioniques, covalents (moléculaires simples et atomiques géants) et métalliques ont tous des propriétés différentes. Par conséquent, pour classer une substance dans l’un ou l’autre de ces composés, il faut effectuer une série de tests/expériences afin de déterminer les propriétés qu’elle possède. Observez le tableau suivant :
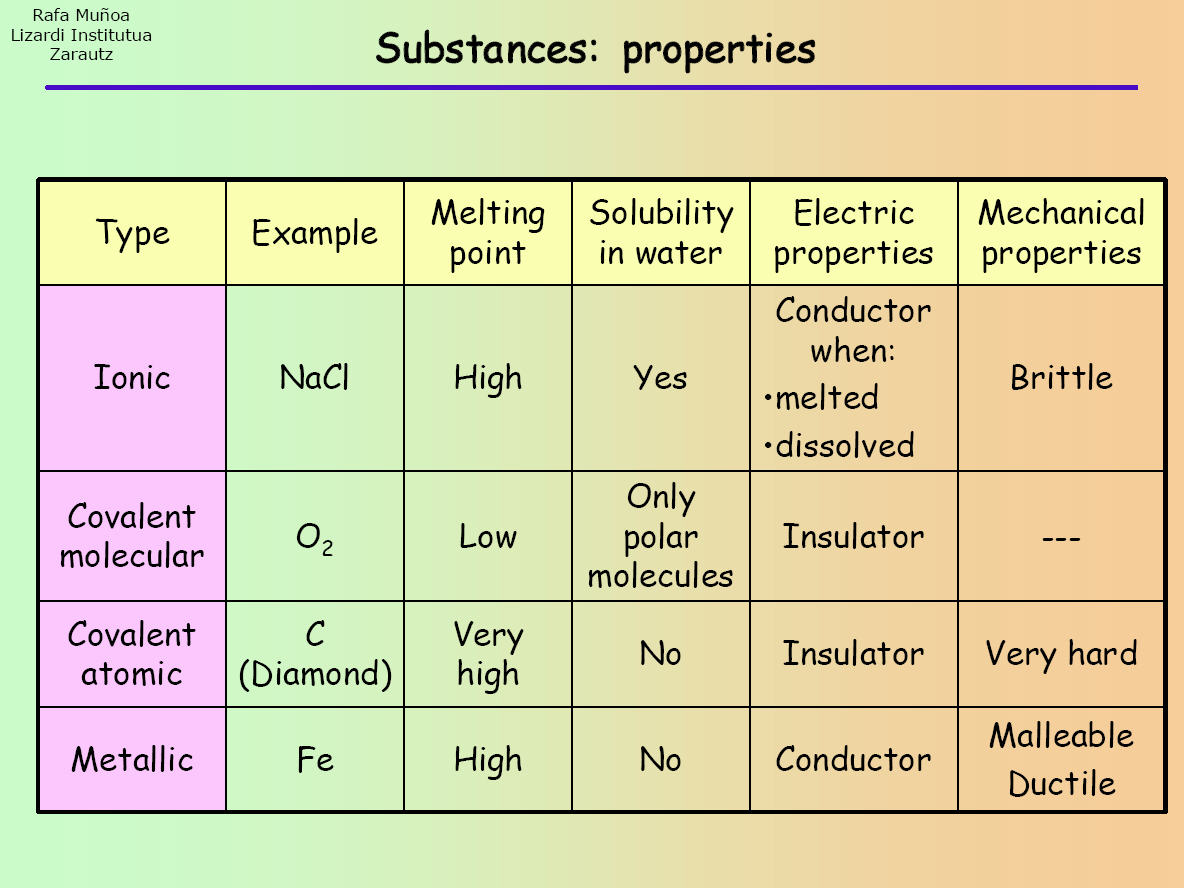
Une fois l’expérience réalisée, les résultats que vous obtenez peuvent être comparés à ceux du tableau pour identifier quelle sorte de composé est la substance.
Premièrement, un échantillon de la substance inconnue peut être placé dans un tube à essai et mis au-dessus d’une flamme. Ceci est fait pour déterminer le point de fusion. Si la substance fond, alors il s’agit probablement d’une substance moléculaire simple covalente (comme indiqué dans le tableau). Cependant, si aucune fusion ne se produit, la substance peut être soit ionique, soit atomique géante covalente, soit métallique.
C’est vraiment la raison pour laquelle nous devons effectuer plus d’un test sur la substance inconnue car certaines catégories de composés partagent des propriétés similaires (par exemple, les composés ioniques et les composés covalents ont tous deux des points de fusion élevés).
Puis, vous pouvez essayer de dissoudre une partie de la substance dans l’eau (ou un autre solvant polaire). Si elle se dissout, alors il peut s’agir d’un composé moléculaire simple ionique ou covalent. Vos résultats du test précédent et du suivant vous aideront à réduire vos résultats à un seul type de composé.
Puis, vous pouvez connecter l’échantillon à un circuit comme celui présenté ci-dessous pour voir s’il conduit un courant électrique.
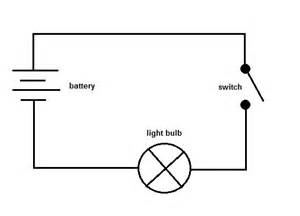
Vous pouvez remplacer l’interrupteur par l’échantillon. Si l’ampoule s’allume, alors c’est un conducteur et si ce n’est pas le cas, alors c’est un non-conducteur.
Donc, par exemple, à la fin de cette expérience, si l’échantillon est resté non fondu, s’il s’est dissous dans l’eau et a conduit un courant électrique, alors c’est un composé ionique.
Toutes ces observations peuvent être expliquées plus en détail en examinant les liaisons et les forces d’attraction intermoléculaires qui maintiennent ensemble les composants d’un composé.
