 Article en accès libre
Article en accès libre Cet article en accès libre est sous licence
Cet article en accès libre est sous licence
Creative Commons Attribution 3.0 Unported Licence
Guoqiang Liua, Yongsan Liab, Lei Yangd, Yen Weia, Xing Wangb, Zhiming Wangc et Lei Tao *a
*a
aKey Laboratory of Bioorganic Phosphorus Chemistry & Chemical Biology (Ministry of Education), Department of Chemistry, Tsinghua University, Beijing 100084, P. R. China. E-mail : [email protected]
bLe laboratoire clé de l’Etat pour l’ingénierie des ressources chimiques, Université de technologie chimique de Pékin, Pékin 100029, République populaire de Chine
collège des sciences pharmaceutiques, Université médicale chinoise de Zhejiang, Hangzhou, Zhejiang 311400, République populaire de Chine. Chine
dCancer Institute & Hospital, Peking Union Medical College & Chinese Academy of Medical Science, Beijing 100021, P. R. China
Première publication le 27 mars 2017
Les dérivés du polyéthylène glycol (PEG) ont été largement utilisés dans la recherche bio-liée. Cependant, les oligomères de PEG (avec différents poids moléculaires) ou les monomères à base de PEG (avec différents groupes de fin de chaîne) ont en fait des propriétés chimiques et physiques différentes, ce qui pourrait conduire à une toxicité potentielle. Dans ce travail, la cytotoxicité d’une série de dérivés du PEG (oligomères et monomères) a été mesurée en utilisant des cellules humaines de cancer du col de l’utérus (HeLa) et une lignée cellulaire de fibroblastes dérivés de souris (L929) comme cellules modèles. La plupart des oligomères du PEG sont sans danger pour les deux types de cellules, à l’exception du triéthylène glycol (TEG), qui est toxique à des concentrations élevées pour les cellules L929. En revanche, les monomères à base de PEG, notamment l’acrylate d’éther méthylique de poly(éthylène glycol) (mPEGA) et le méthacrylate d’éther méthylique de poly(éthylène glycol) (mPEGMA), présentent une cytotoxicité évidente. Par la suite, ces dérivés toxiques du PEG ont été étudiés afin de révéler les différents mécanismes de leur toxicité. Cette recherche actuelle a évalué la cytotoxicité des dérivés du PEG et a souligné le danger potentiel des biomatériaux « sûrs », ce qui pourrait offrir une référence utile pour les personnes qui utilisent les dérivés du PEG dans la recherche biomédicale future.
Introduction
Le polyéthylène glycol (PEG) a été largement appliqué dans divers domaines médicaux en raison de ses propriétés exceptionnelles telles que la sécurité satisfaisante, la biocompatibilité, l’hydrophilie, etc. Par exemple, le PEG a été utilisé dans certains laxatifs approuvés par la Food and Drug Administration en raison de son excellente capacité de rétention de l’humidité et de lubrification.1-3 Dans un autre exemple, la modification de médicaments/protéines avec du PEG (PEGylation) peut améliorer efficacement leur hydrosolubilité et la demi-vie de circulation des médicaments,4,5 ce qui permet d’améliorer la sécurité et les effets thérapeutiques. À l’heure actuelle, la PEGylation est en train de devenir l’une des biotechnologies les plus attrayantes et connaît un succès considérable dans la recherche fondamentale et sur le marché.6-11 À l’heure actuelle, de nombreux dérivés du PEG ont été utilisés comme d’excellents matériaux de départ pour synthétiser un certain nombre de nouveaux matériaux polymères pour des applications biologiques.12 Par exemple, un PEG linéaire a été modifié en tant que PEG difonctionnalisé (DF-PEG) qui pourrait être utilisé pour générer rapidement un hydrogel auto-cicatrisant intéressant.13,14 Certains oligomères de PEG ont été utilisés pour modifier la surface des nanoparticules inorganiques afin d’améliorer la solubilité dans l’eau et de réduire la toxicité de ces matériaux inorganiques15.-Certains monomères commerciaux à base de PEG, tels que l’acrylate d’éther méthylique de poly(éthylène glycol) (mPEGA) et le méthacrylate d’éther méthylique de poly(éthylène glycol) (mPEGMA), ont été utilisés pour préparer des polymères ramifiés en vue de la conjugaison ultérieure de protéines, de l’auto-assemblage, de l’administration de médicaments, etc.18-27
Bien que le PEG soit normalement considéré comme presque non toxique, les chercheurs ont remarqué certains problèmes de sécurité liés au PEG à faible poids moléculaire. Smyth et al. ont signalé la toxicité orale chronique de l’oligomère PEG (Mn ∼ 200) chez les rats,28,29 les résultats indésirables ont également été observés chez les singes,30 suggérant des problèmes de sécurité potentiels de ces matériaux « sûrs ». Par conséquent, compte tenu de la large utilisation des dérivés du PEG dans les domaines de la recherche, l’étude systématique de la cytotoxicité de ces oligomères du PEG et des monomères à base de PEG est nécessaire et importante pour leur application ultérieure dans les domaines bio-liés (Schéma 1).
Dans le présent travail, la cytotoxicité de certains oligomères de PEG (avec différents poids moléculaires) et de monomères commerciaux à base de PEG (avec différents groupes terminaux de chaîne) pour les cellules cancéreuses cervicales humaines (HeLa) et une lignée cellulaire de fibroblastes dérivés de souris (L929) a été évaluée. La cytotoxicité des oligomères de PEG en fonction du poids moléculaire a été observée, et les différents mécanismes de cytotoxicité des oligomères de PEG et des monomères à base de PEG ont été révélés pour la première fois. Ces informations de cytotoxicité des dérivés du PEG pourraient être des références précieuses pour les personnes qui choisissent le PEG comme matériaux de départ et conçoivent des voies de purification pour préparer des matériaux biocompatibles à base de PEG pour d’autres applications biomédicales.
Matériaux et méthodes
2.1. Produits chimiques
Triéthylène glycol (TEG, 97%, HEOWNS), PEG-400 (Mn ∼ 400, TCI), PEG-1000 (Mn ∼ 1000, Jiangsu Haitian Petrochemical Works), PEG-2000 (Mn ∼ 2000, SCRC), PEG-4000 (Mn ∼ 4000, SCRC), poly(éthylène glycol) méthyl éther acrylate 480 (mPEGA-480, Mn ∼ 480, Sigma-Aldrich), méthacrylate d’éther méthylique de poly(éthylène glycol) 500 (mPEGMA-500, Mn ∼ 500, Sigma-Aldrich) et méthacrylate d’éther méthylique de poly(éthylène glycol) 950 (mPEGMA-950, Mn ∼ 950, Sigma-Aldrich) ont été utilisés directement sans purification supplémentaire.
Les cellules cancéreuses cervicales humaines (HeLa) et une lignée cellulaire de fibroblastes dérivés de souris (L929) ont été acquises auprès de l’American type culture collection (ATCC). Milieu d’aigle modifié de Dulbecco (DMEM, Corning-Cellgro), Phosphate Buffered Saline (PBS, pH ∼ 7,2-7,4, 0,01 M, Solarbio), sérum bovin fœtal (FBS, Gibco), milieu de culture Roswell Park Memorial Institute 1640 (RPMI 1640, Gibco), solution de pénicilline-streptomycine (Gibco), trypsine-EDTA (Gibco, 0.25%), 4-(3-(2-méthoxy-4-nitrophényl)-2-(4-nitrophényl)-2H-tétrazol-3-ium-5-yl)benzène-1,3-disulfonate (CCK-8, Beyotime), 2,7-dichlorodihydrofluorescéine diacétate (DCFH-DA, Beyotime), glutathion oxydé (GSSG, Beyotime), nicotinamide adénine dinucléotide phosphate (NADPH, Beyotime), 5,5′-dithiobis-(acide 2-nitrobenzoïque) (DTNB, Beyotime), diacétate de fluorescéine (FDA, Sigma) et iodure de propidium (PI, 94%, Sigma) ont été utilisés tels qu’achetés.
2.2 Culture cellulaire
La culture cellulaire a été maintenue dans un incubateur à 37 °C avec 5% de CO2, le milieu de culture a été changé tous les un ou deux jours pour maintenir la croissance exponentielle des cellules. Les cellules HeLa sont dérivées de cellules de cancer du col de l’utérus et cultivées dans un milieu DMEM complété par 10% de sérum bovin fœtal (FBS) et 1% de pénicilline et de streptomycine. Les cellules L929 ont été dérivées de souris et cultivées dans un milieu RPMI 1640 supplémenté avec 10% de sérum bovin fœtal (FBS) et 1% de pénicilline et de streptomycine.
2.3 Analyse de cytotoxicité
Les résultats ont été présentés sous forme de moyenne ± écart-type (SD), et les valeurs de concentration inhibitrice semi-maximale 50% (IC50) des dérivés du PEG ont été calculées par SPSS 15.0.
Selon nos travaux précédents,32,33 le diacétate de fluorescéine (FDA) et l’iodure de propidium (PI) pourraient être utilisés comme méthode de double coloration rapide et pratique pour observer la viabilité cellulaire. Les cellules L929 ont été ensemencées dans une plaque à 24 puits à une densité de ∼5 × 104 cellules par mL. Après fixation, les cellules ont été lavées avec du PBS et cultivées avec différentes concentrations de dérivés de PEG dans le milieu de culture pendant 24 h. Ensuite, le milieu a été retiré, les cellules ont été lavées avec du PBS. Une solution mixte PBS-FDA-PI (FDA : 3 μg mL-1 ; PI : 3 μg mL-1) a ensuite été ajoutée et la plaque 24 puits a été incubée à 37 °C pendant 15 min. Un microscope à fluorescence (Leica Allemagne) a été utilisé pour observer les cellules vivantes et mortes sous des filtres d’excitation à bande passante de 450-490 nm et de 515-560 nm (I3 et N2.1), respectivement (lampe à mercure de 100 W).
Briefly, les cellules L929 ont été ensemencées dans une plaque à 24 puits et incubées dans 0,5 ml de milieu de culture avec différentes concentrations de TEG (A, A′) pendant 1 h (Fig. 1), les puits A1-A6 ont été utilisés pour mesurer la quantité totale de glutathion (GSH + GSSG) tandis que les puits A′1-A′6 ont été utilisés pour mesurer la quantité de glutathion oxydé (GSSG) en présence de TEG. Après 1 h, les cellules ont été collectées par digestion à la trypsine et centrifugation (1000 rpm, 5 min). Ensuite, une solution d’élimination des protéines en triple volume (50 mg mL-1) a été ajoutée pour éliminer les protéines bruyantes. Après trois cycles rapides de congélation-décongélation dans l’azote liquide et dans un bain-marie à 37 °C, la suspension a été placée dans un réfrigérateur (4 °C) pendant 5 min, et les échantillons de surnageant cellulaire ont été obtenus après centrifugation (10 000 rpm, 10 min). Les échantillons des puits A1-A6 ont été utilisés pour mesurer le niveau de glutathion total (GSH + GSSG). Une solution de NADPH (0,5 mg mL-1) a été ajoutée pour réduire tout le glutathion en GSH, puis, le 5,5′-dithiobis-(acide 2-nitrobenzoïque) (DTNB) a été utilisé pour oxyder le GSH, l’absorbance modifiée à 405 nm a été enregistrée par un lecteur de microplaques (VICTOR™ X3 PerkinElmer 2030 Multilabel Plate Reader).35,36 Des échantillons provenant des puits A′1-A′6 ont été utilisés pour mesurer le taux de glutathion oxydé (GSSG). En utilisant la solution d’élimination du GSH, seul le GSSG a été laissé dans la solution de l’échantillon. Les échantillons ont été analysés par la même méthode que ci-dessus pour mesurer le niveau de GSSG. La quantité totale de glutathion et la quantité de glutathion oxydé ont été recueillies pour calculer le niveau de glutathion réduit, tandis que le niveau de GSH des cellules dans le milieu de culture pur a été utilisé comme contrôle. Les résultats ont été présentés sous forme de moyenne ± SD.
000 rpm, 10 min). Les échantillons des puits A1-A6 ont été utilisés pour mesurer le niveau de glutathion total (GSH + GSSG). Une solution de NADPH (0,5 mg mL-1) a été ajoutée pour réduire tout le glutathion en GSH, puis, le 5,5′-dithiobis-(acide 2-nitrobenzoïque) (DTNB) a été utilisé pour oxyder le GSH, l’absorbance modifiée à 405 nm a été enregistrée par un lecteur de microplaques (VICTOR™ X3 PerkinElmer 2030 Multilabel Plate Reader).35,36 Des échantillons provenant des puits A′1-A′6 ont été utilisés pour mesurer le taux de glutathion oxydé (GSSG). En utilisant la solution d’élimination du GSH, seul le GSSG a été laissé dans la solution de l’échantillon. Les échantillons ont été analysés par la même méthode que ci-dessus pour mesurer le niveau de GSSG. La quantité totale de glutathion et la quantité de glutathion oxydé ont été recueillies pour calculer le niveau de glutathion réduit, tandis que le niveau de GSH des cellules dans le milieu de culture pur a été utilisé comme contrôle. Les résultats ont été présentés sous forme de moyenne ± SD.
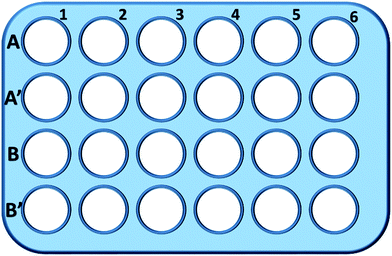
Les puits de la ligne B et B′ ont été utilisés pour tester la quantité totale de GSH et de GSSG en présence de mPEGA-480, respectivement, par la même procédure.
Résultats et discussion
3.1 Étude de viabilité cellulaire
Lorsque la cellule HeLa (un modèle de cellules cancéreuses) a été utilisée (figure 2A), la cytotoxicité de tous les oligomères du PEG à faible concentration (≤5 mg mL-1) a pu être négligée. Avec une concentration accrue (≥10 mg mL-1), la cytotoxicité des échantillons de PEG dépendante du poids moléculaire a été observée. Le triéthylène glycol (TEG) a montré une cytotoxicité évidente au-delà de 10 mg mL-1 (p < 0,05 ; contraste avec tout autre oligomère lorsque la concentration est supérieure à 5 mg mL-1) et la valeur IC50 du TEG pour les cellules HeLa a été calculée à 19,8 mg mL-1. Pendant ce temps, d’autres oligomères de PEG (Mn ∼ 400-4000) ont également montré une cytotoxicité minuscule.
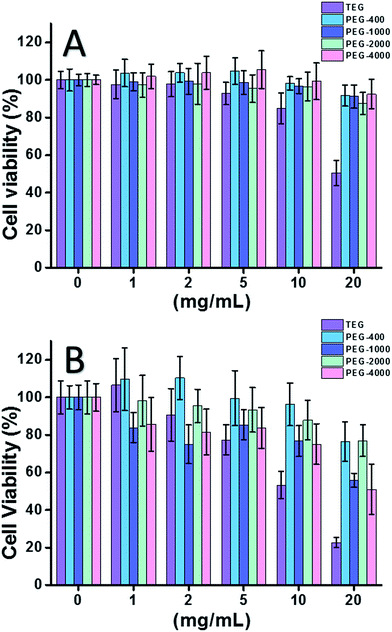
La cytotoxicité des oligomères du PEG pour les cellules L929 (un modèle de cellules normales) a également été évaluée (Fig. 2B). Comme prévu, la viabilité cellulaire a diminué avec l’augmentation de la concentration de PEG. Outre le TEG, certains oligomères du PEG (PEG-1000, PEG-4000) qui sont sans danger pour les cellules HeLa ont également montré une cytotoxicité détectable, les valeurs IC50 du TEG, du PEG-1000 et du PEG-4000 ont été calculées comme étant de 12,4, 22,5 et 20,0 mg mL-1 pour les cellules L929, respectivement, indiquant également la cytotoxicité des oligomères du PEG en fonction du poids moléculaire.
Les résultats ci-dessus suggèrent que les cellules HeLa ont une meilleure tolérance aux oligomères de PEG que les cellules L929 en raison de la vitalité tenace des cellules cancéreuses, et le TEG a une cytotoxicité beaucoup plus élevée que les autres oligomères de PEG avec des poids moléculaires plus élevés (p < 0,05 ; contraste avec tout autre oligomère lorsque la concentration est supérieure à 5 mg mL-1). On remarque que la présente recherche a démontré la cytotoxicité modérée du PEG-1000 et du PEG-4000 pour les cellules L929, et la quasi absence de cytotoxicité du PEG-400 et du PEG-2000, ce qui est différent de l’impression commune selon laquelle les PEG de poids moléculaire élevé devraient être plus biocompatibles que leurs homologues de faible poids moléculaire. Bien que la raison de la cytotoxicité du PEG ne soit pas encore claire, le PEG-400 et le PEG-2000 semblent être de meilleurs choix pour les personnes qui veulent synthétiser des matériaux biocompatibles.
Lorsque le mPEGMA-500 a été testé, la viabilité cellulaire des cellules HeLa et des cellules L929 a diminué avec l’augmentation de la concentration de mPEGMA-500 (Fig. 3A), et aucune différence apparente entre les deux types de cellules n’a été observée. Les valeurs de la CI50 du mPEGMA-500 sont de 4,7 mg mL-1 pour les cellules HeLa et de 5,3 mg mL-1 pour les cellules L929 après 24 heures de culture, ce qui indique une cytotoxicité plus importante du mPEGMA-500 que des oligomères de PEG susmentionnés et implique que les groupes d’extrémité de chaîne des dérivés de PEG sont cruciaux pour leur toxicité. Lorsque le mPEGMA-950, un autre méthacrylate à base de PEG ayant le même groupe terminal de chaîne mais un poids moléculaire plus élevé, a été testé selon la même procédure (Fig. 3B), on a observé une cytotoxicité beaucoup plus faible du mPEGMA-950 pour les cellules HeLa ou L929 (p < 0,05 ; lorsque la concentration est supérieure à 2 mg mL-1), les valeurs de la CI50 du mPEGMA-950 sont de 20,8 mg mL-1 pour les cellules HeLa et de 21.7 mg mL-1 aux cellules L929 après 24 h de culture, démontrant également la cytotoxicité dépendante du poids moléculaire du méthacrylate à base de PEG.
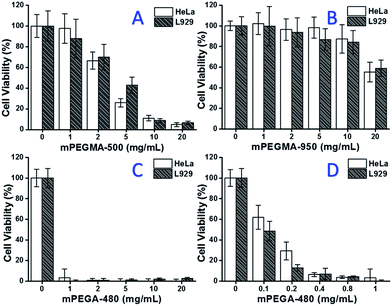
De plus, l’acrylate à base de PEG mPEGA-480 a également été testé. Bien que la différence entre mPEGA-480 et mPEGMA-500 ne soit qu’un groupe méthyle en bout de chaîne, mPEGA-480 a montré une cytotoxicité aiguë (Fig. 3C). Plus de 95 % des cellules ont perdu leur viabilité même avec 1 mg mL-1 de mPEGA-480 dans le milieu de culture. Ainsi, des expériences supplémentaires doivent être réalisées avec des concentrations plus faibles pour déterminer sa cytotoxicité (Fig. 3D), et les valeurs IC50 du mPEGA-480 ont été calculées comme étant de 0,2 mg mL-1 pour les cellules HeLa et de 0,1 mg mL-1 pour les cellules L929 après 24 h de culture.
Les expériences de viabilité cellulaire ont confirmé que les groupes d’extrémité de chaîne et le poids moléculaire sont tous deux des éléments d’influence importants pour la cytotoxicité des dérivés du PEG, et les monomères à base de PEG ont montré une cytotoxicité beaucoup plus notable par rapport aux oligomères de PEG.
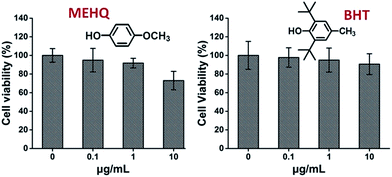
Pendant ce temps, la cytotoxicité des inhibiteurs dans les monomères à base de PEG, l’éther méthylique d’hydroquinone (MEHQ, 100 ppm dans le mPEGA) et l’hydroxytoluène butylé (BHT, 300 ppm dans le mPEGMA), a également été évaluée (Fig. 4), et les cellules L929 ont conservé une viabilité élevée (≥90 %) à des inhibiteurs faiblement concentrés (≤1 μg mL-1). Il y a 0,1 μg mL-1 de MEHQ dans 1 mg mL-1 de mPEGA-480, et 3 μg mL-1 de BHT dans 10 mg mL-1 de mPEGA-500, alors que mPEG-480 et mPEGMA-500 ont démontré une cytotoxicité évidente à ces concentrations. Ainsi, les traces d’inhibiteurs dans les monomères à base de PEG semblent avoir une influence négligeable sur la cytotoxicité des monomères.
3.2 Observation de la morphologie cellulaire
L’observation au microscope optique a été utilisée pour évaluer directement la cytotoxicité des dérivés du PEG sur les cellules L929. Les images optiques des cellules L929 exposées à 20 mg mL-1 de TEG et 0,1 mg mL-1 de mPEGA pendant 24 h ont été présentées dans les figures 5A et B, respectivement.
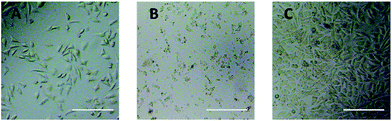
Après incubation avec 20 mg mL-1 de TEG pendant 24 h, les cellules ont conservé la même morphologie (Fig. 5A) avec le groupe témoin (Fig. 5C, cellules dans le milieu de culture pur), mais le nombre de cellules a considérablement diminué, indiquant la cytotoxicité du TEG à haute concentration, qui a conduit à la mort et au détachement consécutif des cellules du fond de la microplaque. La figure 5B montre la morphologie des cellules L929 après incubation avec 0,1 mg mL-1 de mPEGA-480. Presque toutes les cellules ont perdu leur morphologie normale, ce qui suggère la cytotoxicité aiguë du mPEGA-480, même à une concentration aussi faible.
En outre, les cellules ont également été colorées à l’aide de fluorescéine. La double coloration FDA/PI est une procédure rapide, simple et simultanée pour observer les cellules vivantes et mortes.43 Le FDA peut entrer dans les cellules complètes et s’accumuler dans les cellules, par conséquent, la membrane cellulaire complète est nécessaire pour empêcher la fuite de la fluorescéine de la cellule. En revanche, l’IP ne peut pas traverser la membrane cellulaire intacte, mais peut colorer le noyau des cellules mortes en traversant la membrane cellulaire endommagée. Comme le montre la Fig. 6, les cellules L929 incubées avec 20 mg mL-1 de TEG ont moins de cellules viables après la coloration FDA (Fig. 6b) par rapport au contrôle (Fig. 6a), et plus de cellules mortes peuvent être observées après la coloration PI (Fig. 6b′), identique au résultat par observation à travers un microscope optique. La cytotoxicité aiguë de mPEGA-480 a également été observée après la procédure de double coloration FDA/PI, aucun signal vert n’a pu être identifié après l’incubation des cellules avec 0,1 mg mL-1 mPEG-480 pendant 24 h (Fig. 6c et c′′).
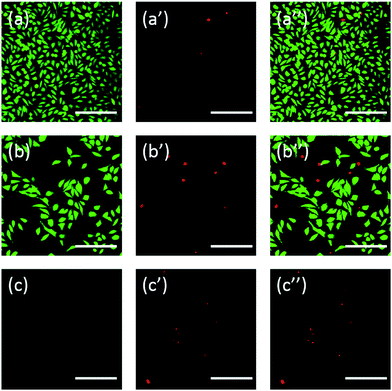
Les images optiques et fluorescentes ont toutes deux démontré intuitivement la cytotoxicité de ces dérivés de PEG, ce qui appuie davantage la conclusion obtenue par les essais CCK-8. On remarque que le mPEGA-480 semble plus toxique par le test de double coloration FDA/PI, ce qui est attribué à la double coloration FDA/PI qui distingue l’intégralité de la membrane des cellules vivantes/mortes alors que le test CCK-8 détecte l’activité de la déshydrogénase dans les mitochondries, ce qui suggère que la coloration FDA/PI est un excellent complément du test CCK-8 pour offrir plus de détails sur l’état des cellules.
3.3 Étude du mécanisme
Selon les expériences de viabilité cellulaire, les valeurs IC50 des oligomères PEG et des monomères à base de PEG pour les cellules HeLa et L929 après 24 h de culture ont été calculées et résumées (tableau 1), suggérant que les monomères à base de PEG sont beaucoup plus toxiques pour les cellules que les oligomères PEG, et le mPEGA a la cytotoxicité la plus élevée. La génération de ROS et le déclin du GSH dans les cellules, deux mécanismes principaux de la cytotoxicité ont donc été analysés pour sonder la raison possible de la cytotoxicité.
| TEG | PEG-400 | PEG-1000 | PEG-2000 | PEG-4000 | mPEGMA-500 | mPEGMA-950 | mPEGA-480 | |
|---|---|---|---|---|---|---|---|---|
| Cellules HeLa | 19.8 | 32,5 | 36,2 | 38,2 | 29,6 | 4,7 | 20,8 | 0,2 |
| Cellules L929 | 12,4 | 24.7 | 22,5 | 28,7 | 20,0 | 5,3 | 21,7 | 0,1 |
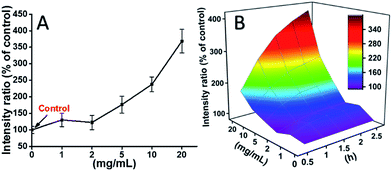
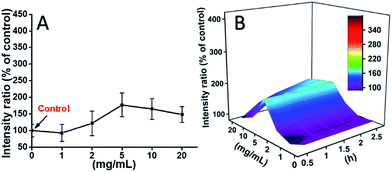
Les cellules 929 ont été incubées avec la TEG, et les niveaux de ROS à différents moments (0, 0,5, 1,0, 1,5, 2 h) ont été détectés conformément à nos rapports précédents et présentés dans la Fig. 7. Par exemple, les niveaux de ROS après incubation avec différentes concentrations de TEG pendant 2 h ont été montrés dans la Fig. 7A. On voit clairement que les niveaux de ROS sont restés stables avec une faible concentration de TEG (≤2 mg mL-1), mais qu’ils ont augmenté de manière significative lorsque la concentration de TEG est supérieure à 2 mg mL-1, ce qui est cohérent avec le résultat de l’expérience de viabilité cellulaire de la Fig. 2B. De même, les figures du niveau de ROS en fonction de la concentration de TEG à différents points de temps ont été dessinées et fusionnées pour obtenir une carte 3D (Fig. 7B). Les niveaux maximaux de ROS ont été trouvés à 2 h avec 20 mg mL-1 de TEG, une augmentation d’environ 400% du niveau de ROS par rapport au contrôle (niveau de ROS = 100) a été détectée, résultant en l’intensité de fluorescence la plus brillante. Ces résultats suggèrent que la génération de ROS est le mécanisme possible de la cytotoxicité du TEG, et le niveau élevé de ROS induit par le TEG pourrait être la raison principale de l’apoptose cellulaire.
Les niveaux de ROS induits par le mPEGA-480 après 2 h ont également été testés (Fig. 8A). Différent du TEG, le mPEGA n’a pas provoqué l’augmentation rapide des ROS dans les cellules, seulement ∼170% d’augmentation des ROS par rapport au contrôle a été observé comme maximum. Le niveau de ROS 3D par rapport au temps de mPEGA & (Fig. 8B) a montré le niveau de ROS induit par mPEGA-480 comme une vague et la crête est apparue à une concentration modérée de mPEGA (5 mg mL-1), aucune génération significative de ROS ne peut être observée, ce qui suggère que la génération de ROS pourrait seulement contribuer partiellement à la cytotoxicité de mPEGA-480.
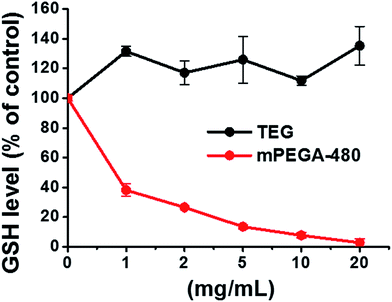
Le groupe thiol réducteur du GSH est une source anti-oxydation importante dans les organismes. Un mécanisme possible de la cytotoxicité du mPEGA-480 est ainsi attribué à la réaction d’addition de Michael entre le groupe thiol et la liaison vinyle, conduisant à la rupture de l’équilibre redox intracellulaire et à l’apoptose cellulaire. Des recherches antérieures ont suggéré que l’addition de Michael entre le thiol et l’acrylate est beaucoup plus rapide que celle entre le thiol et le méthacrylate,52 ce qui pourrait être une cause raisonnable de la cytotoxicité aiguë différente entre le mPEGA-480 et le mPEGMA-500.
Conclusions
La cytotoxicité des oligomères de PEG et des monomères à base de PEG sur les cellules HeLa et les cellules L929 a été évaluée pour la première fois. La cytotoxicité dépendante de la concentration des oligomères PEG et des monomères à base de PEG a été confirmée, et présentée sous forme de valeurs IC50 pour les cellules HeLa et L929. Le PEG-400, le PEG-2000 semblent presque non cytotoxiques dans la recherche actuelle. Les PEG-1000, PEG-4000 et mPEGMA-950 ont montré une cytotoxicité modérée, en particulier à forte concentration. Le TEG et le mPEGMA-500 ont montré une cytotoxicité significative, et le mPEGA-480 une cytotoxicité aiguë. De plus, les types de cellules influencent également les résultats de l’étude de cytotoxicité, les cellules HeLa sont plus robustes que les cellules L929 pour tolérer les dérivés du PEG. Ces résultats sur la cytotoxicité des dérivés de PEG sont préliminaires mais fondamentaux pour leur future application biomédicale, plus d’informations sur la réponse et le comportement des cellules à d’autres dérivés de PEG seront étudiées plus en détail.
Remerciements
Cette recherche a été soutenue par la Fondation nationale des sciences de Chine (21574073, 21534006).
- M. V. Cleveland, D. P. Flavin, R. A. Ruben, R. M. Epstein et G. E. Clark, South. Med. J., 2001, 94, 478-481 CrossRef CAS PubMed.
- J. A. DiPalma, M. V. B. Cleveland, J. McGowan et J. L. Herrera, Am. J. Gastroenterol., 2007, 102, 1436-1441 CrossRef CAS PubMed.
- B. A. Erickson, J. C. Austin, C. S. Cooper et M. A. Boyt, J. Urol., 2003, 170, 1518-1520 CrossRef CAS PubMed.
- J. L. Cleland, S. E. Builder, J. R. Swartz, M. Winkler, J. Y. Chang et D. I.. C. Wang, Bio/Technologie, 1992, 10, 1013-1019 CrossRef CAS PubMed.
- Z. Liu, J. T. Robinson, X. M. Sun et H. J. Dai, J. Am. Chem. Soc., 2008, 130, 10876-10877 CrossRef CAS PubMed.
- J. M. Harris et R. B. Chess, Nat. Rev. Drug Discovery, 2003, 2, 214-221 CrossRef CAS PubMed.
- F. M. Veronese et G. Pasut, Drug Discovery Today, 2005, 10, 1451-1458 CrossRef CAS PubMed.
- M. J. Roberts, M. D. Bentley et J. M. Harris, Adv. Drug Delivery Rev., 2002, 54, 459-476 CrossRef CAS PubMed.
- F. M. Veronese, Biomaterials, 2001, 22, 405-417 CrossRef CAS PubMed.
- H. Zhang, T. Zhao, P. Duffy, Y. Dong, A. Ni Annaidh, E. O’Cearbhaill et W. Wang, Adv. Healthcare Mater., 2015, 4, 2260-2268 CrossRef CAS PubMed.
- Y. Dong, Y. Qin, M. Dubaa, J. Killion, Y. Gao, T. Zhao, D. Zhou, D. Duscher, L. Geever, G. C. Gurtner et W. Wang, Polym. Chem., 2015, 6, 6182-6192 RSC.
- T. M. Allen, C. Hansen, F. Martin, C. Redemann et A. Yauyoung, Biochim. Biophys. Acta, Biomembr., 1991, 1066, 29-36 CrossRef CAS.
- Y. L. Zhang, L. Tao, S. X. Li et Y. Wei, Biomacromolecules, 2011, 12, 2894-2901 CrossRef CAS PubMed.
- Y. L. Zhang, B. Yang, L. X. Xu, X. Y. Zhang, L. Tao et Y. Wei, Acta Chim. Sin., 2013, 71, 485-492 CrossRef CAS.
- C. C. Luo, Y. H. Zhang, X. W. Zeng, Y. W. Zeng et Y. G. Wang, J. Colloid Interface Sci., 2005, 288, 444-448 CrossRef CAS PubMed.
- S. Dhar, F. X. Gu, R. Langer, O. C. Farokhzad et S. J. Lippard, Proc. Natl. Acad. Sci. U. S. A., 2008, 105, 17356-17361 CrossRef CAS PubMed.
- J. Manson, D. Kumar, B. J. Meenan et D. Dixon, Gold Bull. 2011, 44, 99-105 CrossRef CAS.
- X. Y. Zhang, C. K. Fu, L. Feng, Y. Ji, L. Tao, Q. Huang, S. X. Li et Y. Wei, Polymer, 2012, 53, 3178-3184 CrossRef CAS.
- X. Y. Zhang, J. F. Hui, B. Yang, Y. Yang, D. D. Fan, M. Y. Liu, L. Tao et Y. Wei, Polym. Chem., 2013, 4, 4120-4125 RSC.
- D. Bontempo et H. D. Maynard, J. Am. Chem. Soc., 2005, 127, 6508-6509 CrossRef CAS PubMed.
- K. L. Heredia, Z. P. Tolstyka et H. D. Maynard, Macromolecules, 2007, 40, 4772-4779 CrossRef CAS.
- H. Hussain, K. Y. Mya et C. He, Langmuir, 2008, 24, 13279-13286 CrossRef CAS PubMed.
- J. P. Magnusson, S. Bersani, S. Salmaso, C. Alexander et P. Caliceti, Bioconjugate Chem. 2010, 21, 671-678 CrossRef CAS PubMed.
- F. J. Xu, Y. L. Li, E. T. Kang et K. G. Neoh, Biomacromolecules, 2005, 6, 1759-1768 CrossRef CAS PubMed.
- L. L. Yu, L. Yao et K. Yang, J. Porous Mater., 2016, 23, 1581-1589 CrossRef CAS.
- S. Yuan, D. Wan, B. Liang, S. O. Pehkonen, Y. P. Ting, K. G. Neoh et E. T. Kang, Langmuir, 2011, 27, 2761-2774 CrossRef CAS PubMed.
- S. A, Q. Xu, D. Zhou, Y. Gao, J. M. Vasquez, U. Greiser, W. Wang, W. Liu et W. Wang, Polym. Chem. 2017, 8, 1283-1287 RSC.
- H. F. Smyth, C. P. Carpenter et C. S. Weil, J. Am. Pharm. Assoc., 1950, 39, 349-354 CrossRef CAS.
- H. F. Smyth, C. P. Carpenter et C. S. Weil, J. Am. Pharm. Assoc., 1955, 44, 27-30 CrossRef CAS.
- D. E. Prentice et S. K. Majeed, Toxicol. Lett. 1978, 2, 119-122 CrossRef CAS.
- H. Tominaga, M. Ishiyama, F. Ohseto, K. Sasamoto, T. Hamamoto, K. Suzuki et M. Watanabe, Anal. Commun. 1999, 36, 47-50 RSC.
- Y. Li, Y. Zhang, F. Shi, L. Tao, Y. Wei et X. Wang, Colloids Surf., B, 2016, 149, 168-173 CrossRef PubMed.
- B. Yang, Y. Zhang, X. Zhang, L. Tao, S. Li et Y. Wei, Polym. Chem. 2012, 3, 3235-3238 RSC.
- H. Wang et J. A. Joseph, Free Radical Biol. Med., 1999, 27, 612-616 CrossRef CAS PubMed.
- I. K. Smith, T. L. Vieweller et C. A. Thorne, Anal. Biochem. 1988, 175, 408-413 CrossRef CAS PubMed.
- I. Rahman, A. Kode et S. K. Biswas, Nat. Protoc., 2006, 1, 3159-3165 CrossRef CAS PubMed.
- R. Jevprasesphant, J. Penny, R. Jalal, D. Attwood, N. B. McKeown et A. D’Emanuele, Int. J. Pharm., 2003, 252, 263-266 CrossRef CAS PubMed.
- A. K. Gupta et S. Wells, IEEE Trans. Nanobioscience, 2004, 3, 66-73 CrossRef PubMed.
- D. Luo, K. Haverstick, N. Belcheva, E. Han et W. M. Saltzman, Macromolecules, 2002, 35, 3456-3462 CrossRef CAS.
- C. W. Chang, E. Bays, L. Tao, S. N. S. Alconcel et H. D. Maynard, Chem. Commun. 2009, 3580-3582 RSC.
- B. D. Fairbanks, P. A. Gunatillake et L. Meagher, Adv. Drug Delivery Rev., 2015, 91, 141-152 CrossRef CAS PubMed.
- T. Zhou, Y. Zhu, X. Li, X. Liu, K. W. K. Yeung, S. Wu, X. Wang, Z. Cui, X. Yang et P. K. Chu, Prog. Mater. Sci., 2016, 83, 191-235 CrossRef CAS.
- K. H. Jones et J. A. Senft, J. Histochem. Cytochem., 1985, 33, 77-79 CrossRef CAS PubMed.
- M. Hayyan, M. A. Hashim et I. M. AlNashef, Chem. Rev., 2016, 116, 3029-3085 CrossRef CAS PubMed.
- A. Lankoff, W. J. Sandberg, A. Wegierek-Ciuk, H. Lisowska, M. Refsnes, B. Sartowska, P. E. Schwarze, S. Meczynska-Wielgosz, M. Wojewodzka et M. Kruszewski, Toxicol. Lett. 2012, 208, 197-213 CrossRef CAS PubMed.
- Y. Chang, S.-T. Yang, J.-H. Liu, E. Dong, Y. Wang, A. Cao, Y. Liu et H. Wang, Toxicol. Lett. 2011, 200, 201-210 CrossRef CAS PubMed.
- X. Cai, J. Hao, X. Zhang, B. Yu, J. Ren, C. Luo, Q. Li, Q. Huang, X. Shi, W. Li et J. Liu, Toxicol. Appl. Pharmacol., 2010, 243, 27-34 CrossRef CAS PubMed.
- S. J. Park, Y. C. Park, S. W. Lee, M. S. Jeong, K.-N. Yu, H. Jung, J.-K. Lee, J. S. Kim et M.-H. Cho, Toxicol. Lett. 2011, 207, 197-203 CrossRef CAS PubMed.
- K. Pulskamp, S. Diabate et H. F. Krug, Toxicol. Lett. 2007, 168, 58-74 CrossRef CAS PubMed.
- A. M. Studer, L. K. Limbach, L. Van Duc, F. Krumeich, E. K. Athanassiou, L. C. Gerber, H. Moch et W. J. Stark, Toxicol. Lett. 2010, 197, 169-174 CrossRef CAS PubMed.
- T. Thurnherr, C. Brandenberger, K. Fischer, L. Diener, P. Manser, X. Maeder-Althaus, J.-P. Kaiser, H. F. Krug, B. Rothen-Rutishauser et P. Wick, Toxicol. Lett. 2011, 200, 176-186 CrossRef CAS PubMed.
- G. Li, R. K. Randev, A. H. Soeriyadi, G. Rees, C. Boyer, Z. Tong, T. P. Davis, C. R. Becer et D. M. Haddleton, Polym. Chem. 2010, 1, 1196-1204 RSC.
